Эндометриоз – это системное иммуно- и гормонозависимое мультифакториальное заболевание [1]. Эндометриоз поражает каждую десятую женщину в возрасте от 12 до 52 лет, что составляет ориентировочно 176 млн человек по всему миру. Существенное количество пациентов (до 7%) может быть не учтено в связи с малосимптомным течением процесса в течение десятилетий [2]. Особенная значимость данного заболевания заключается в существенном влиянии на фертильность у пациентов репродуктивного возраста, а также на качество жизни в связи с доминирующей симптоматикой в виде выраженных тазовых болей с присоединением нейропатического компонента, снижающих работоспособность и социальную активность женщин, что представляет значимую нагрузку на систему здравоохранения и экономику [1, 3].
Эндометриоз является самым распространенным интраоперационно установленным диагнозом у пациентов, подвергшихся хирургическому вмешательству для установления причин хронической тазовой боли и лечения бесплодия [4]. Заболевание является гетерогенным и подразделяется на несколько фенотипов: эндометриоидная киста яичника, поверхностный перитонеальный и глубокий инфильтративный эндометриоз [1, 5].
Изменение стероидогенеза является одним из ключевых звеньев патобиологического каскада при развитии эндометриоза. Оценка гормонального профиля пациентов с эндометриозом рутинно выполняется с диагностической целью, а также для подбора послеоперационной гормономодулирующей терапии. В зависимости от особенностей строения гормонов их способность к ионизации значительно отличается, но вследствие наличия нейтрального заряда интенсивность сигнала обычно слабо выражена. Стероиды, имеющие конъюгированную двойную связь с карбонильной группой (дельта-4-стероиды, например, тестостерон), обычно легче ионизируются, благодаря чему их возможно измерить даже в минимальных концентрациях. Противоположная тенденция присуща эстрадиолу: содержание фенольной группы и предельно низкие концентрации данного гормона в образцах приводят к истинным сложностям при измерении уровня данного стероида [6].
Кроме того, в системном кровотоке и тканях стероидные гормоны представлены в низких концентрациях, в связи с чем требуются высокочувствительные методы для их идентификации. Измерение концентраций осуществляется посредством метода масс-спектрометрии, совмещенной с хроматографией, или иммунологическими методами. Для иммунологических методов характерна высокая пропускная способность, однако специфичность метода ограничена в связи с выраженным структурным сходством различных стероидов, а также «перекрытием» прочими эндогенными и экзогенными компонентами. Хроматографические методы более специфичны в анализе стероидома [7–11].
Метод высокоэффективной жидкостной хроматографии и масс-спектрометрии (ВЭЖХ-МС), особенно в модификации, изложенной в исследовании M.R. Häkkinen et al., характеризуется высокой чувствительностью для количественного определения уровней низкомолекулярных метаболитов, в том числе стероидных гормонов [7].
В данном исследовании методом ВЭЖХ-МС проведен анализ изменений стероидных гормонов сыворотки крови при распространенном наружном генитальном эндометриозе (РНГЭ) III–IV стадии с целью изучить диагностическую ценность одномоментного анализа, а также влияние эндометриоидных кист на изменение стероидома.
Материалы и методы
Дизайн исследования
С марта 2018 по апрель 2020 гг. на базе ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России проведено обсервационное исследование «случай-контроль», включившее 65 женщин репродуктивного возраста. Пациентки были распределены на 3 группы. В 1-ю группу вошли 16 пациенток с глубоким инфильтративным эндометриозом III–IV стадии по классификации R-AFS [6] и эндометриоидной кистой яичника (возраст исследуемых 23–37 лет; средний диаметр кисты 4,4±1,1 см), во 2-ю группу – 23 пациентки с глубоким инфильтративным эндометриозом (возраст исследуемых 27–39 лет). Пациенткам было выполнено оперативное вмешательство лапароскопическим доступом. Диагноз РНГЭ был подтвержден хирургически и верифицирован при гистологическом исследовании удаленной ткани.
Третью группу (группа контроля) составили 26 здоровых добровольцев (женщины 23–34 лет с благополучно реализованной репродуктивной функцией), у которых на основании клинико-лабораторных (сбор анамнеза, осмотр, клинический и биохимический анализы крови) и инструментальных (ультразвуковое исследование экспертного уровня) методов диагностики были исключены объемные образования яичников, отсутствовали жалобы; концентрации стероидных гормонов крови, исследованные иммунологическими методами диагностики, находились в пределах референсных значений. Уровни гормонов данной группы, установленные посредством ВЭЖХ-МС, соответствовали показателям в диапазоне нормальных значений, рекомендованных для оборудования лаборатории.
Гормональное исследование крови у всех пациенток проводилось в I (пролиферативную) фазу менструального цикла. На момент забора крови пациенты не принимали гормональную терапию в течение 3 мес и более. Наличие сочетанной патологии (миома матки, гиперпролиферативные состояния эндометрия) явилось критерием невключения [1].
Каждому пациенту, включенному в исследование, перед взятием крови было предложено подписать информированное добровольное согласие. Исследование было одобрено комиссией по этике биомедицинских исследований ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Реагенты
Для построения калибровочных прямых использовали набор стандартов Jasem Steroid Hormones. В 200 мкл стандарта вносили 20 мкл внутреннего стандарта Jasem (набор меченных дейтерием соответствующих стероидов), далее высаживали белки с использованием 450 мкл ацетонитрила, декантировали надосадочный раствор и экстрагировали стероиды с помощью 1 мл метилтретбутилового эфира. Отбирали аликвоту 800 мкл, высушивали в потоке азота и реконструировали образец 100 мкл метанол/вода (v/v=1/1). Аналогичным образом проводилась пробоподготовка образцов сыворотки крови. Для одного анализа использовали 20 мкл образца.
Условия масс-спектрометрического анализа
Для одномоментного количественного анализа эстрогенов (эстрадиол, Е2), андрогенов (тестостерон, Т; дигидротестостерон; андростендион, А4; дегидроэпиандростерон, ДГЭА; дегидроэпиандростерона сульфат, ДГЭАС), прогестагенов (прогестерон, Р4; 17α-гидроксипрогестерон, 17ОНР4), глюкокортикостероидов (кортизол, F; кортикостерон, В) и минералокортикоидов (11-дезоксикортикостерон, S; альдостерон, А) сыворотки крови пациентов с РНГЭ и группы контроля был использован метод ВЭЖХ-МС. Исследования проводились на масс-спектрометре QTRAP 5500, ABSciex (ABSciex, Canada) с хроматографической системой Agilent 1260 (Agilent, USA). Ионизация была достигнута с помощью электрораспыления в положительном режиме (ESI+), напряжение 5500 В, в качестве распыляющего и осушающего газов использовали азот, температура 350°С, тип сканирования – мониторинг множественных реакций. Разделение гормонов проводилось на обратнофазной колонке Jasem Steroids (Turkey). Мобильная фаза состояла из деионизированной воды (A) и ацетонитрила (В) (99,9%), содержащих 0,01% муравьиной кислоты. Элюирование проводили со скоростью 400 мкл/мин, 0,5 минуты – 15% В; далее содержание органической фазы линейно поднимали до 60% в течение 13,5 минуты, промывали колонку в течение 1 минуты 85% В со скоростью потока 800 мкл/мин и уравновешивали аналитическую колонку 4 мин составом 15% В.
Статистический анализ
Статистическую обработку полученных экспериментальных данных проводили с помощью скриптов, написанных на языке R [R CoreTeam (2018). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL https://www.R-project.org/] в RStudio [RStudio Team (2016). RStudio: Integrated Development for R. RStudio, Inc., Boston, MA URL http://www.rstudio.com/]. Соответствие анализируемых параметров закону нормального распределения оценивали по значениям теста Шапиро–Уилка. Статистическую значимость отличия параметров между исследуемыми группами оценивали с помощью теста Манна–Уитни. Величину порогового уровня значимости (p) принимали равной 0,05. Для оценки возможности классификации пациентов по группам на основании исследуемых параметров были разработаны модели логистической регрессии. В качестве зависимых переменных в моделях рассматривали все возможные комбинации стероидных гормонов. В качестве независимой переменной выступала принадлежность пациентки к группе. Из всех разработанных моделей выбирали четыре с наибольшей величиной площади под ROC-кривой (AUC). Для каждой модели были определены критерий Вальда, 95% доверительный интервал (ДИ), отношение шансов (ОШ) и его доверительный интервал. Качество разработанных моделей определяли путем построения ROC-кривой, определения площади под ROC-кривой, а также расчета чувствительности и специфичности.
Результаты
Методом ВЭЖХ-МС установлены особенности стероидного профиля (12 гормонов) сыворотки крови пациентов с РНГЭ (1-я и 2-я группы) и группы контроля.
Сравнение стероидного профиля сыворотки крови пациентов исследуемых групп и группы контроля
При анализе сывороток крови пациентов с РНГЭ и группы контроля получены статистически значимые отличия концентраций Е2, Р4, 17-ОНР4, Т, дигидротестостерона, ДГЭА, ДГЭАС, S, B и F (табл. 1).
Эстрогены
У пациентов с РНГЭ установленные концентрации Е2 были значимо выше, чем в группе контроля: 0,18 (0,09–1,07) и 0,12 (0,09–0,15) нг/мл соответственно (р=0,04).
Прогестагены
При РНГЭ концентрации Р4 в обеих группах оказались меньше нижней границы измерения: 0,00–6,09 нг/мл.
При сравнении концентраций 17-ОНР4 в группе пациентов с РНГЭ (0,55 [0,33–1,01] нг/мл) и группе контроля (0,44 [0,32–0,49] нг/мл) получены статистически значимые различия (р=0,05).
Андрогены
У пациентов с РНГЭ установленные концентрации Т были выше, чем в группе контроля: 0,81 [0,33–2,18] и 0,43 [0,29–0,56] нг/мл соответственно (р<0,01).
При РНГЭ значимо снижена концентрация дигидротестостерона 0,16 [0,10–0,23] нг/мл по сравнению с 0,37 [0,27–0,63] нг/мл в группе контроля (р<0,01).
Установленные концентрации ДГЭА (3,56 [2,66–5,90] нг/мл) и ДГЭАС (2533,00 [1405,00–3096,00]нг/мл) были значимо ниже (р<0,01 и р<0,01), чем в группе контроля (5,98 [5,13–7,33] нг/мл и 4425,00 [3746,50–4934,50] нг/мл соответственно).
Статистически значимых отличий в группах при сравнении А4 получено не было: 1,35 [0,91–1,49] нг/мл в крови пациентов с РНГЭ и 1,31 [1,02–1,80] нг/мл в крови пациентов группы контроля (р=0,29).
Глюкокортикостероиды
У пациентов с РНГЭ установленные концентрации F были значимо выше, чем в группе контроля (164,00 [100,16–876,502] и 90,50 [57,79–112,90] нг/мл соответственно; р<0,01). Аналогичные данные получены при сравнении уровней В (4,87 [1,93–33,70] и 1,20 [0,30–2,00] нг/мл соответственно; р<0,01).
Минералокортикоиды
У пациентов с РНГЭ концентрации S были значимо выше, чем в группе контроля: 0,87 [0,36–1,42] и 0,37 [0,31–0,48] нг/мл, р<0,01.
Статистически значимых отличий в группах при сравнении А получено не было: 0,09 [0,06–0,13] нг/мл в группе пациентов с РНГЭ и 0,09 [0,05–0,13] нг/мл у пациентов группы контроля (р=0,74).
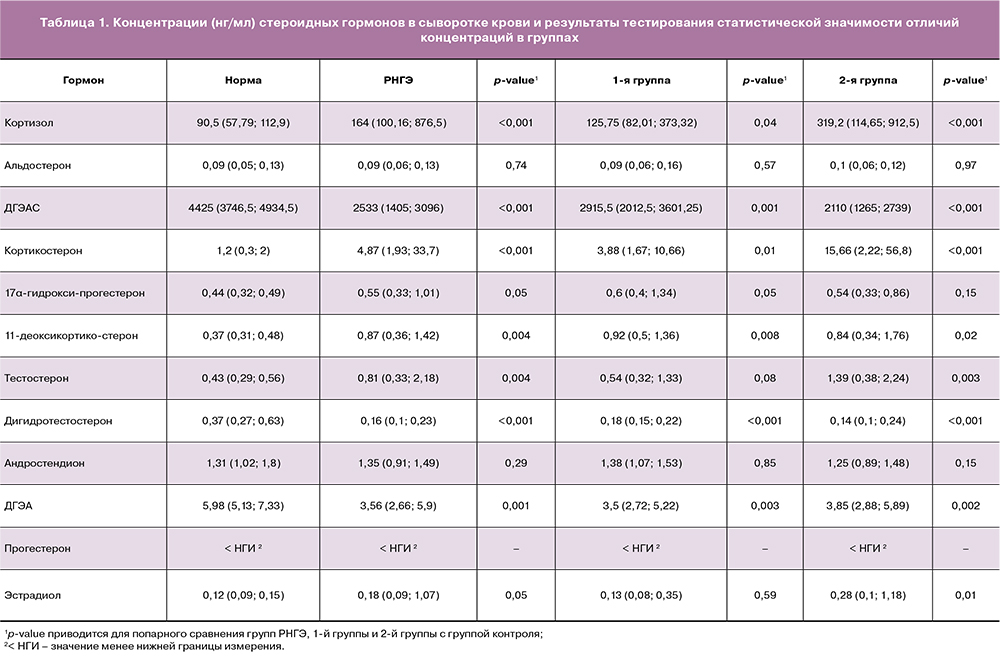
Таким образом, статистически значимые различия концентраций гормонов крови пациентов с РНГЭ и группы контроля получены для Е2, F, ДГЭА и ДГЭАС, B, 17-ОНР4, S, Т и дигидротестостерона (рис. 1.)
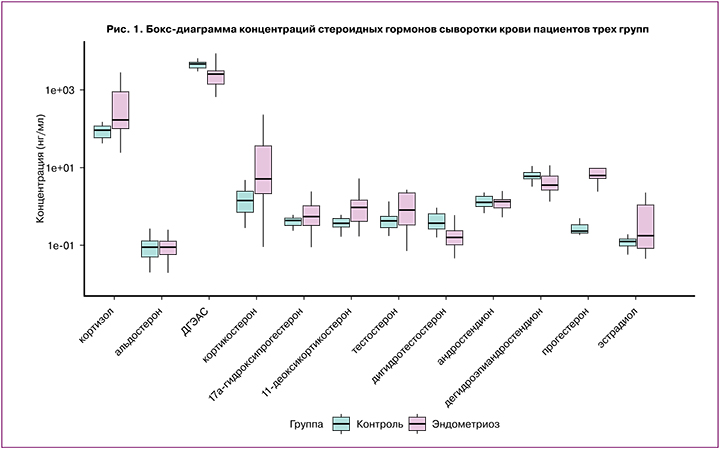
На основании концентраций стероидных гормонов крови пациентов групп контроля и больных РНГЭ построены модели логистической регрессии (табл. 2). Модель логистической регрессии:

где i – свободный член; kSH1, kSH2, … – коэффициенты для концентраций гормонов; cSH1, cSH2, … – концентрации соответствующего гормона.
На основании данных моделей построены ROC-кривые (рис. 2).

Е2, дигидротестостерон, ДГЭА, ДГЭАС, В, А: чувствительность = 0,90, специфичность = 0,93, AUC=0,95.
Е2, Р4, дигидротестостерон, ДГЭА, ДГЭАС, В: чувствительность = 0,87, специфичность = 0,93, AUC=0,94.
Е2, 17-ОНР4, F, ДГЭА, ДГЭАС, А: чувствительность = 0,85, специфичность = 0,89, AUC=0,94.
Е2, дигидротестостерон, ДГЭА, ДГЭАС, В, S: чувствительность = 0,95, специфичность = 0,85, AUC=0,94.
Попарное сравнение стероидного профиля сыворотки пациентов исследуемых групп и группы контроля
При проведении сравнения концентраций гормонов в каждой из исследуемых групп и в группе контроля с выполнением анализа результатов по Манну–Уитни без коррекции на множественные сравнения были получены следующие данные (табл. 1).
Сравнение стероидного профиля сыворотки крови пациентов с овариальным и инфильтративным РНГЭ
Уровни стероидных гормонов в 1-й и 2-й исследуемых группах сопоставимы, статистически значимых отличий получено не было (табл. 1).
Дисперсия концентрационных уровней анализируемых стероидных гормонов крови в трех группах пациентов представлена на диаграммах размахов (box-whiskerplots) (рис. 3).

Обсуждение
В ряде исследований сформирована устойчивая модель этиологии и патогенеза эндометриоза, при которой изменение биосинтеза гормонов (гиперэстрогения, резистентность к прогестерону и чрезмерная экспрессия ароматазы, цитохрома семейства CYP19) является не только следствием, но также причиной прогрессирования заболевания, поскольку коррелирует с активностью каскадов провоспаления, неоангиогенеза и нейрогенеза [12, 13].
В последнее время выяснены некоторые генетические аспекты патогенеза эндометриоза. Найдены гены, контролирующие активность конкретных внутриклеточных специфических ферментов, ответственных за образование того или иного стероида. Эпигенетический механизм метилирования ДНК затрагивает рецепторы эстрогена, а также гены HOXA10 и NR5A1, причем последний из упомянутых ответственен за гиперэкспрессию ароматазы и синтез пептида, регулирующего стероидогенез (стероидогенезрегулирующий пептид, СРП), что характерно для эндометриоза [14]. Метилированный ген NR5A1 экспрессирует «специфический фактор транскрипции 1» (СФТ-1), взаимодействие которого с промоторами активирует энхансеры и стимулирует патологический синтез ароматазы и СРП. В ткани нормального эндометрия подобные сигнальные пути, опосредованные циклическим аденозинмонофосфатом или стимулируемые простагландином Е2, отсутствуют, а мультимерные комплексы не содержат СФТ-1 [15]. Данные процессы проявляются сложно идентифицируемой локальной гиперэстрогенией [16].
В 1991 г. F. Labrie ввел понятие «интракринология». Данный раздел эндокринологии изучает пути и механизмы образования андрогенов и эстрогенов из предшественников, а также биологический ответ самих клеток на секретируемые ими гормоны (пептиды, протеины, стероиды) [17]. Существенный вклад в этом виде гомеостаза принадлежит интракринной регуляции: синтезированный компонент оказывает воздействие внутри клетки, его синтезировавшей, при этом в связи с отсутствием попадания гормона в кровоток изменение концентрации не коррелирует с его истинной активностью. Кроме этого, для ряда биологических жидкостей характерна концентрация, которая недостаточна для идентификации стандартными методами [18]. Рядом исследований было показано, что анализ гормональной активности репродуктивных органов, обладающих интракринной регуляцией, может быть информативнее методом ВЭЖХ-МС [8, 15].
В рамках исследования, помимо гиперэстрогении, у пациентов с РНГЭ была обнаружена гиперандрогенемия. У женщин доминирует интракринный путь образования и воздействия Т и 5α-дигидротестостерона из ДГЭА, который является одним из важных предшественников Е2 и биоактивных андрогенов, в которые он конвертируется в периферических тканях [18, 19]. Выявление характера ферментативных нарушений в системном и местном стероидогенезе является важным для диагностики источника гипо- и гиперандрогенемии.
Определение Т сыворотки крови является наиболее информативным для оценки андрогенсинтезирующей функции яичника при эндометриозе. По данным K. Huhtinen et al., концентрации Т, установленные при использовании жидкостной масс-спектрометрии образцов сыворотки крови и тканей, были выше в группе пациенток с эндометриозом, особенно при локализации гетеротопий в ткани яичника, что может быть ассоциировано с повышением HSD3B2 (изофермент 3β-hydroxysteroid dehydrogenase), CYP11A1 и CYP17A1 (Cholesterol side chain-cleavage enzyme), а также с повышенной экспрессией андроген-активирующих генов PRUNE2, HGD, PDGFRL [15]. В нашем исследовании повышение Т было отмечено, напротив, у пациентов без эндометриоидных кист, однако оно не достигло статистически значимого уровня. Таким образом, можно предположить, что повышение концентрации андрогенов ассоциировано с усилением функции надпочечников на фоне выраженного болевого синдрома, хронического стресса (о чем также свидетельствует установленное повышение концентрации F), обусловленного заболеванием.
На основании данных, полученных при построении и анализе моделей, можно утверждать о высокой диагностической значимости стероидных гормонов изученной панели (рис. 2, 4). При РНГЭ отмечено значимое изменение 9 стероидных гормонов.
При сопоставлении концентраций эстрогенов, прогестагенов, андрогенов, глюко- и минералокортикоидов в 1-й (РНГЭ III–IV стадии, киста яичника) и 2-й (РНГЭ III–IV стадии) группах пациенток статистически значимых отличий получено не было, что позволило прийти к выводу о том, что вовлечение в процесс ткани яичника не является фактором интенсивности стероидогенеза, это может свидетельствовать о единстве эндометриоза как патологического процесса, субстратом которого является активность, а не локализация гетеротопической ткани (рис. 4). Данные результаты могут свидетельствовать об отсутствии дополнительного влияния эндометриоидных кист на стероидогенез при РНГЭ. Полученные данные требуют дальнейшего исследования на большей выборке пациентов.
Ограничения
Следует иметь в виду, что изменение концентраций стероидных гормонов в крови может быть связано не только с изменением скорости их синтеза (стероидогенеза) или секреции, но и с изменением содержания в крови соответствующих транспортных белков – глобулина, связывающего половые гормоны, транскортина и др. От их образования в печени и концентрации в крови во многом зависит и общее содержание стероидных гормонов, а также их метаболически активных свободных форм.
При анализе гормональной активности репродуктивных органов, обладающих интракринной функцией, изучение методом ВЭЖХ-МС стероидома клеточного компартмента может быть информативнее, чем анализ изменений периферической крови. Очевидно, детальное изучение этих аспектов, а также проведение многомерного анализа с целью минимизации влияния конфаундеров составляет реальные перспективы продолжения данного исследования на большей выборке пациентов.
Заключение
В исследовании представлены возможности одномоментного метаболомного анализа расширенной панели из 12 стероидных гормонов сыворотки крови посредством совмещения методов масс-спектрометрии и жидкостной хроматографии.
Получены признаки патологического изменения стероидогенеза у женщин репродуктивного возраста с РНГЭ, а именно: значимое увеличение концентраций Е2, Т, 17-α-ОНР4, S, В и F, снижение ДГЭА, ДГЭАС и дигидротестостерона.
Построение моделей логистической регрессии позволяет дифференцировать стероидом крови пациентов с РНГЭ от группы контроля. Четыре комбинации стероидных гормонов отличаются наибольшей величиной площади под ROC-кривой (AUC), чувствительностью и специфичностью; однако следует отметить модель, построенную на основании сочетания Е2, дигидротестостерона, ДГЭА, ДГЭАС, В и А. Рассчитанные показатели указывают на возможность применения данного сочетания гормонов для диагностики РНГЭ I–IV стадий, что требует валидации в дальнейшем.
В настоящем исследовании получены данные об отсутствии различий между первой и второй группами пациентов, то есть стероидом крови не отображает вовлечение в эндометриоидный процесс ткани яичника, в связи с чем можно предположить единство эндометриоза как патологического процесса, субстратом которого является активность, а не локализация гетеротопической ткани. Результаты настоящего исследования подтверждают возможность применения метода ВЭЖХ-МС для количественного определения предшественников и метаболитов стероидных гормонов, что позволяет сделать косвенные выводы о причинах нарушения активности ферментов стероидогенеза.
В целом использование масс-спектрометрии, обладающей высокой специфичностью и чувствительностью, является перспективным методом для определения уровня стероидов как при проведении фундаментальных исследований, так и в клинической диагностике при пограничных результатах классических тестов.



