Бесплодие в браке влияет на качество отношений в паре, и в целом на качество жизни [1–3]. У женщин, страдающих бесплодием, в сравнении с фертильными женщинами, чаще наблюдаются снижение сексуального функционирования, которое проявляется не только низким сексуальным влечением, но и трудностями сексуального возбуждения, ухудшением оргастичности, нарушением любрикации и диспареунией [4, 5].
Психофизиологические процессы, связанные с реализацией сексуальных реакций у женщины, обеспечиваются последовательной активацией морфофункциональных комплексов копулятивного цикла к которым относится генито-сегментарная составляющая, включающая рецепторные секреторные структуры, нервно-мышечный аппарат половых органов и цереброспинальные нервные центры с их проводящими путями [6]. При сексуальном возбуждении в гениталиях происходит нейрососудистая реакция, проявляющаяся увеличением вагинального и клиторального кровотока, вазоконгестией, генитальным нагрубанием, а также любрикацией [7]. Нарушение генитальной реакции на сексуальную стимуляцию часто ассоциировано с диспареунией.
Половые стероиды оказывают ключевое воздействие на морфофункциональное состояние урогенитального тракта. Наиболее изучены разнообразные эффекты эстрогенов на урогенитальную ткань у женщин, которые участвуют в процессах созревания клеток, активации вагинального кровотока, любрикации. Эстрогены влияют на поддержание плотности гладких мышц стенки влагалища, морфологию кровеносных сосудов и плотность нервных окончаний в эпителии слизистой [8]. В клетках эпителия влагалища присутствуют ядерные рецепторы эстрогена ERα, которые кодируются геном ESR1. ERα регулирует экспрессию различных белковых молекул, в том числе аквапоринов (AQP), а также факторов роста эндотелия сосудов [9, 10]. Также известно, что эстрогены непосредственно могут влиять на экспрессию ESR1. Исследования показывают, что в различных тканях эстрогены могут, как повышать, так и снижать экспрессию ESR1 [11].
AQP – это белки, являющиеся клеточными водными каналами, через которые транспортируются вода, глицерин и другие небольшие нейтральные растворенные вещества. Kim S.O. et al. изучили локализацию и экспрессию AQP1-9 в тканях влагалища у женщин в пременопаузе и показали, что AQP1 в основном экспрессировался в капиллярах и венулах влагалища, AQP2 – в цитоплазме эпителия; AQP3 в основном был связан с плазматической мембраной эпителия влагалища, а AQP5 и AQP6 экспрессировались в цитоплазме по всему эпителию влагалища [12]. Таким образом, именно AQP3, по мнению Lee H.S. et al., можно рассматривать, как потенциальный компонент механизма вагинальной любрикации [13].
Фактор роста эндотелия сосудов (Vascular endothelial growth factor, VEGF) является цитокином, имеющим не менее 8 изоформ, вырабатываемым клетками для стимуляции васкуло- и ангиогенеза. VEGF-A значительно увеличивает проницаемость сосудов, чем обеспечивает транссудацию белков и других молекул из кровеносных сосудов [14]. Интересно, что в дополнение к определяющей роли в ангиогенезе в последние годы накапливаются данные о нейротрофической и нейропротекторной активности VEGF-A [15, 16].
VEGF121 и VEGF165 – это сигнальные белки, которые выполняют функции, необходимые для нормального выделения вагинального секрета; причем известно, что изоформа VEGF121 в основном регулирует проницаемость сосудов, тогда как VEGF165 индуцирует ангиогенез [17].
Во время естественных менструальных циклов уровень эстрогенов в сыворотке повышается параллельно с фолликулогенезом и обычно снижается после первоначального выброса ЛГ [18]. В циклах ЭКО осуществляется контролируемая овариальная стимуляция яичников (ОС), при этом изменения уровня эстрогенов являются важным компонентом в оценке ответа яичников и эндометрия на стимуляцию [19].
При использовании вспомогательных репродуктивных технологий (ВРТ) в лечении бесплодия у женщин уровни эстрогенов на порядок превышают естественные уровни во время спонтанной овуляции. Влияние этих супрафизиологических уровней эстрогена на микробиоту влагалища и эндометрия исследовали Carosso A. et al., которые установили, что ОС значительно изменяет состав микробиоты влагалища и эндометрия [20].
На сегодняшний день не изучены особенности вагинальной секреции при сниженном сексуальном функционировании у женщин, а также влияние ОС на молекулярные механизмы вагинальной трансклеточной секреции.
Цель исследования: изучить особенности генной экспрессии факторов вагинальной трансклеточной секреции (AQP3, ESR1, VEGF121 и VEGF165) в программе ЭКО при гормональной стимуляции и в естественном цикле у женщин со сниженным сексуальным функционированием.
Материалы и методы
Обследование и лечение пациенток, а также набор материала проводились в отделении вспомогательных технологий в лечении бесплодия им. Б.В. Леонова и в научно-поликлиническом отделении ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России. В исследование включены 47 женщин со сниженным сексуальным функционированием; из них первую группу составили 24 женщины, проходившие ОС в программе ЭКО, вторую группу – 23 женщины, получавшие лечение в рамках программы ЭКО в естественном цикле.
В настоящее исследование были включены женщины в возрасте от 21 до 46 лет с трубно-перитонеальным фактором бесплодия и/или с мужским фактором бесплодия, подписавшие информированное согласие на участие в исследовании. Обязательными условиями включения в исследование являлись наличие постоянного партнера, нормальный кариотип супругов/партнеров; нормальный индекс массы тела (ИМТ) женщины или наличие избыточной массы тела (ИМТ пациенток от 19 до 30,0 кг/м2). В исследование не включались женщины с III–IV степенью наружного генитального эндометриоза, пороками развития внутренних половых органов, острыми воспалительными заболеваниями органов малого таза, кистозными/опухолевидными образованиями яичников, миомой матки больше 4 см или миомой субмукозной локализации; с онкологическими заболеваниями; пациентки, которым проводилась бы программа ЭКО с донорскими ооцитами/сперматозоидами. Обследование супружеских пар/партнеров было регламентировано списком анализов, представленным в приказе Минздрава России №107н от 30.08.2012 г. «О порядке использования вспомогательных репродуктивных технологий».
Протокол исследования был одобрен этическим комитетом ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
В группе женщин с ОС был выбран протокол с антагонистами гонадотропин-рилизинг-гормона (антГнРГ) с препаратами рекомбинантного ФСГ (рФСГ) или рФСГ и рекомбинантного ЛГ (рЛГ) или человеческих менопаузальных гонадотропинов (ЧМГ); введение гонадотропинов начиналось со 2–4-го дня менструального цикла. При назначении дозы препаратов для ОС принимались во внимание следующие параметры каждой пациентки: возраст, уровень антимюллерова гормона (АМГ), количество антральных фолликулов, визуализируемых при проведении ультразвукового исследования (УЗИ) органов малого таза. Коррекция дозы препаратов рФСГ/рФСГ+рЛГ/ЧМГ проводилась в соответствии с ответом яичников на овариальную стимуляцию. Ежедневное ведение антГнРГ с целью предупреждения возникновения эндогенных пиков ЛГ начиналось при величине диаметра доминантного фолликула более 14 мм. Овуляторная доза препаратов хорионического гонадотропина (ХГЧ) 10 000 ЕД или агониста ГнРГ при риске развития синдрома гиперстимуляции яичников в дозе 0,2 мг и финальная доза антГнРГ назначались при определении диаметра доминантного фолликула более 17–17,5 мм по данным УЗИ органов малого таза.
Выбор программы ЭКО в естественном цикле для пациенток группы 2 обусловлен снижением овариального резерва у данных женщин. Овуляторная доза препарата ХГЧ в дозе 5000 ЕД назначалась при достижении лидирующим фолликулом диаметра 17–17,5 мм.
При включении пациентов в исследование проводилось клиническое интервью, верификация диагноза осуществлялась в соответствии с диагностическими критериями МКБ 10. Сексуальное функционирование оценивались с помощью самоопросника «Индекс женской сексуальной функции» (ИЖСФ) по доменам «желание», «возбуждение», «любрикация», «оргазм», «удовлетворенность», «боль» и суммарному баллу ИЖСФ (FSFI). Границей клинических и доклинических показателей считали общий балл ИЖСФ (FSFI), равный 26,55 [21].
Забор материала для исследования в обеих группах проводился в день трансвагинальной пункции яичников. После обработки физиологическим раствором с помощью урогенитального зонда типа «D» (цитощетки цервикальной) собирался эпителий с передней стенки наружной трети влагалища.
Образцы эпителия влагалища помещались в лизирующий буфер. Суммарную РНК выделяли набором для выделения тотальной РНК из эпителиальных соскобов на магнитных частицах (Silex, Россия) по протоколу производителя. Концентрацию и чистоту выделенной суммарной РНК определяли с использованием спектрофотометра DeNovix, США. Реакцию обратной транскрипции проводили набором ОТ-1 («Синтол», Россия). Синтезированную кДНК использовали для количественной полимеразной цепной реакции (ПЦР). Условия проведения ПЦР: денатурация – 95°С, 5 мин; отжиг и элонгация – 95°С, 10 с; 60°С, 20 с; 35 циклов амплификации. В качестве референсного гена был использован RPL19 (табл. 1).
Статистический анализ
Статистический анализ данных был проведен с использованием программного обеспечения Attastat (США) и Origin (США). Данные представлены медианой (Мe) и интерквартильным размахом (Q1, Q3). Непрерывные переменные анализировали с помощью U-критерия Манна–Уитни. Категориальные переменные анализировались с использованием точного критерия Фишера. Графики представлены в виде диаграммы размаха (5%, Q1, Me, Q3, 95%). Различия считали статистически значимыми при p<0,05.
Результаты
На основании проведенного анализа установлены различия социо-демографических, клинико-анамнестических, лабораторных данных пациенток, включенных в исследование (табл. 2).
На основании анализа клинико-анамнестических данных участниц исследования установлено, что пациентки в группе 1 в сравнении с группой 2 были достоверно моложе (р<0,001). Исследуемые группы были сопоставимы между собой по показателям менструальной функции (возраст менархе, длительность менструального цикла и менструального кровотечения), а также возрасту сексуального дебюта.
Соматические заболевания у пациенток представлены хроническими тонзиллитом, фарингитом, гастритом, энтероколитом, циститом, уретритом; атопическим дерматитом, бронхиальной астмой, аутоиммунным гипотиреозом и гиперпролактинемией. Все соматические заболевания на момент вступления пациенток в программу ВРТ были в состоянии стойкой ремиссии или компенсации. При анализе соматической заболеваемости не установлены различия между группами пациенток.
Гинекологическая заболеваемость исследуемых пациенток по данным анамнеза сопоставима в обеих группах; представлена хроническим сальпингоофоритом с тубэктомией, наружным генитальным эндометриозом и аденомиозом I–II стадии, интрамуральной миомой матки малых размеров и миомэктомией, полипами эндометрия и заболеваниями, передающимися половым путем (хламидиоз, гонорея). У пациенток, которым проводилось ЭКО в естественном цикле (группа 2) по сравнению с пациентками, проходившими стандартную ОС (группа 1) продолжительность бесплодия была больше (р<0,001), составив в среднем 5 лет.
При оценке акушерского анамнеза (число беременностей, число своевременных и преждевременных родов, число самопроизвольных и искусственных прерываний беременности) группы также были сопоставимы; обращает на себя внимание в целом низкая гравидарность и паритет у пациенток, включенных в исследование. Число попыток программ ЭКО или ИКСИ в анамнезе было выше в группе пациенток, проходивших лечение в естественном цикле (р<0,001). Число беременностей, наступивших в результате программ ВРТ, было сопоставимо в обеих группах.
Проведенный анализ гормонального профиля пациенток в обеих группах установил различия показателей АМГ (выше в группе 1) и ФСГ (выше в группе 2) (p<0,001). У пациенток в обеих группах в начале цикла ЭКО не выявлены различия в уровнях ЛГ, пролактина, СТГ, ТТГ, тироксина, эстрадиола, тестостерона, ДГЭА-С. Следует отметить, что все пациентки во время исследования не принимали гормональные средства с целью контрацепции.
В исследование были включены пациентки со сниженным сексуальным функционированием по данным опросника ИЖСФ (FSFI) (табл.3).
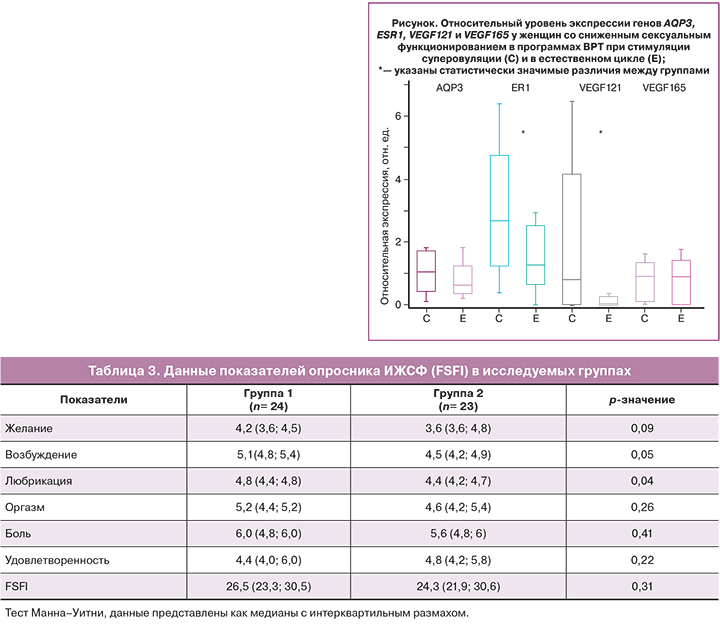
При анализе результатов показателей ИЖСФ (FSFI) у пациенток в группе 1 были выявлены более высокие показатели в сравнении с пациентками в группе 2. Установлены различия медианы между группами пациенток по доменам «возбуждение» (p=0,05), «любрикация» (p=0,04), тенденции различия медианы по домену «желание» (p= 0,09).
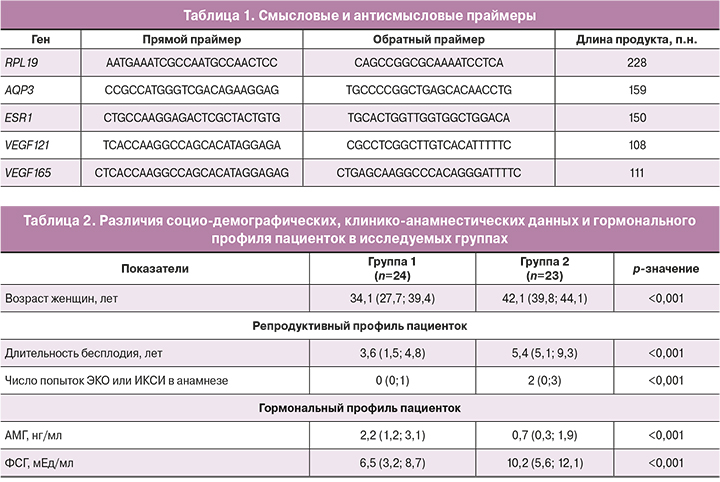
Чтобы оценить влияние стимуляции овуляции на молекулярные механизмы вагинальной секреции, связанные с сексуальной реакцией, у женщин со сниженным сексуальным функционированием проведен ПЦР-анализ генной экспрессии в соскобе эпителиальной ткани влагалища генов AQP3, ESR1, VEGF121 и VEGF165 (рисунок).
На основании ПЦР-анализа у пациенток с ОС (группа 1) установлены уровни экспрессии ESR1, превышающие в 2 раза (p=0,012) показатели у пациенток, проходивших программу ВРТ в естественном цикле (группа 2).
Также установлено, что уровень экспрессии VEGF121 в группе 1 превышал более чем в 13 раз (p=0,01) результаты в группе 2; при этом не выявлены различия уровней экспрессии VEGF165 между группами.
Уровень экспрессии AQP3 в вагинальном эпителии пациенток с ОС (группа 1) был выше в 1,64 раза по сравнению с пациентками, проходившими программу ВРТ в естественном цикле (группа 2), различия установлены на уровне тенденции (p=0,09).
Обсуждение
Сниженное сексуальное функционирование являлось одним из критериев включения в настоящее исследование. Несмотря на то, что в обеих группах у пациенток общий балл опросника ИЖСФ (FSFI) < 26,55, при анализе результатов установлены различия: у пациенток в группе 1 были выявлены более высокие показатели среднего в сравнении с пациентками в группе 2 по доменам «возбуждение» (p=0,05), «любрикация» (p=0,04), тенденции различия по домену «желание» (p=0,09).
Tanha F.D. et al. также сообщили о сниженном сексуальном функционировании у пациенток с первичным и вторичным бесплодием [22]. Анализ структуры сексуальных нарушений показал, что хотя общий балл ИЖСФ (FSFI) существенно не отличался между группами, средний балл показателя домена «желание» был значительно ниже в группе с вторичным бесплодием. Авторами установлено, что возраст был независимым предиктором сексуальной дисфункции у женщин с первичным бесплодием, в отличие от пациенток с вторичным бесплодием.
Keskin U. et al. сообщили по результатам исследования, что возраст и доход были независимыми предикторами низких показателей ИЖСФ (FSFI), а у женщин с вторичным бесплодием риск сексуальной дисфункции в 9,5 раз выше, чем у женщин с первичным бесплодием; в этой группе были значительно ниже показатели возбуждения, оргазма и удовлетворенности [23].
Сексуальное возбуждение у женщин представляет собой нейро-сосудистое явление, связанное с нейрорегулируемыми сосудистыми реакциями [24]. Любрикация – эстроген-зависимый физиологический процесс, является одним из показателей полового возбуждения. Данные, полученные на животных моделях in vivo, убедительно демонстрируют, что эстрогены, но не андрогены, регулируют генитальный кровоток, любрикацию и структурную целостность вагинальной ткани [25].
Эффекты эстрадиола в женском репродуктивном тракте в основном опосредуются его рецептором ER1. В данном исследовании ПЦР-анализ у пациенток с ОС в сравнении с пациентками, проходившими программу ВРТ в естественном цикле, показал больший уровень экспрессии ESR1 (p=0,012).
Как сообщили Li S. et al., отсутствие эпителиального ESR1 способствует потере ороговения, снижению целостности клеток, чрезмерному производству гликопротеинов, лейкоцитозу влагалища, что приведет к чрезмерной активности матриксной металлопротеиназы и последующей модификации внеклеточного матрикса [26]. Более того, эпителиальные клетки неспособны продуцировать кератины (Krt6a и Krt10), что приводит к формированию недифференцированного эпителиального слоя. Эти аберрантные модификации внеклеточного матрикса и недифференцированный эпителиальный слой приводят к потере целостности эпителиальной ткани, и клетки легко отделяются от стромы во время спаривания.
Таким образом, низкий уровень экспрессии ESR1 в эпителии влагалища может являться одним из патогенетических механизмов нарушения вагинальной секреции, генитальной сексуальной реакции (возбуждение, любрикация), а также диспареунии и вульводинии.
Исламов Р.Р. и соавт. сообщили о нейропротекторном действии эстрогенов, связанном с перекрестным взаимодействием эстрогенов с внутриклеточными сигнальными каскадами многих других биологически активных соединений, включающих активацию рецепторов эстрогена ERα и ERβ, а также VEGF [27].
VEGF является мощным митогеном, ангиогенным и нейротрофическим фактором, оказывающим стимулирующее, антиапоптотическое действие на все типы мышечных клеток и нейроны [9, 28–30]. Zhang Y. et al. на модели клеток эндотелия пупочной вены человека (HUVEC) показали, что изоформы VEGF 121 и VEGF 165 активируют разные сигнальные пути, которые способствуют различным специализированным биологическим функциям. VEGF 165 является более мощным индуктором пролиферации через активацию пути митоген-активированная протеинкиназа-киназа (MEK) / внеклеточный каскад сигнально-регулируемых киназ (ERK) (MEK/ERK) чем VEGF121 [17]. Напротив, VEGF121 индуцирует гиперпроницаемость, опосредованную специфическими киназами семейства Src.
Проведенный нами в исследовании ПЦР-анализ уровней экспрессии VEGF121 и VEGF165 в обеих группах показал существенные различия: в то время как уровень экспрессии VEGF165 в группах был сопоставим, уровень экспрессии VEGF121 различался в 13 раз (p=0,01). Таким образом, установлено, что у пациенток, получавших препараты для стимуляции функции яичников по протоколу с ант-ГнРГ (рФСГ, рФСГ и ЛГ или чМГ), а также ХГЧ в дозе 8000–10000 МЕ в отличие от пациенток без стимуляции яичников, получавших ХГЧ в дозе 5000 МЕ, экспрессия VEGF121 была значительно более интенсивной, тогда как экспрессия VEGF165 была сопоставимой, что свидетельствует об индукции гиперпроницаемости у пациенток в группе 1, но не ангиогенеза. Более высокие показатели доменов ИЖСФ (FSFI) «возбуждение» (p=0,05), «любрикация» (p=0,04) у пациенток группы 1, по нашему мнению, обусловлены также повышенной экспрессией VEGF121. Снижение экспрессии VEGF121, а также его сигнальных путей может являться одним из патогенетических механизмов нарушения вагинальной секреции, генитальной сексуальной реакции (возбуждение, любрикация).
В настоящее время экспрессия VEGF хорошо изучена при некоторых видах глазных болезней, онкологических заболеваний, разработаны терапевтические препараты на основе анти-VEGF. Многообещающие терапевтические стратегии в лечении кожных заболеваний, включая псориаз и атопический дерматит, связывают с новым классом агентов на основе блокирования сигнальных путей VEGF [17]. Диспареуния при различных заболеваниях вульвы, включая склероатрофический лишай, атопический дерматит, нейродермит и пр., также является возможной терапевтической мишенью для будущих препаратов, регулирующих функцию VEGF.
Большой интерес в связи с терапевтическими возможностями вызывают и AQP, которые связаны с патогенезом значительного количества болезней человека. Так, активно проводятся клинические испытания модуляторов и ингибиторов AQP [31, 32]. Ribeiro J.C. et al. рассматривают различия между паттернами экспрессии AQP, как потенциальные биомаркеры репродуктивного здоровья, как мужчин, так и женщин [33]. Регуляция AQP в гаметах, репродуктивном тракте мужчин и женщин могут быть применены, по их мнению, для обеспечения лучших результатов лечения бесплодия в программах ВРТ.
В исследовании мы оценили уровень экспрессии AQP3 в вагинальном эпителии у женщин со сниженным сексуальным функционированием и установили отсутствие сверхэкспрессии в обеих группах, а также тенденцию (p=0,09) более высоких значений у пациенток с ОС в сравнении с пациентками, проходившими программу ЭКО в естественном цикле. Таким образом, уровень экспрессии AQP3 в эпителиальных клетках влагалища у пациенток значимо не различался, несмотря на различия гормональной терапии и возраста.
AQP3 позволяет транспортировать не только воду, но и глицерин, а также перекись водорода, что помогает передаче сигналов универсального фактора транскрипции (NF-κB), контролирующего экспрессию генов иммунного ответа, апоптоза и клеточного цикла [34]. В дополнение к этому, AQP3 играет роль в нормальной функции бактериального фагоцитоза макрофагами и в транспортировке Т-клеток, то есть во врожденном иммунитете [35, 36]. Эти данные позволяют предположить, что AQP3 является новой терапевтической мишенью для модуляции иммунного ответа при различных инфекционных и воспалительных состояниях.
Заключение
На основании проведенного исследования установлены различия пациенток в группе подготовки к ЭКО с ОС в сравнении с пациентками в группе подготовки к ЭКО в естественном цикле: они были моложе (р<0,001), у них была меньше длительность бесплодия (р<0,001), был выше уровень АМГ (p<0,001) и ниже уровень ФСГ (p<0,001).
В программах ВРТ в группе подготовки к ЭКО с ОС в сравнении с группой подготовки к ЭКО в естественном цикле у пациенток с низким сексуальным функционированием (FSFI < 26,55) установлены более высокие показатели медианы по доменам ИЖСФ (FSFI) «возбуждение» (p=0,05), «любрикация» (p=0,04), «желание» (p=0,09).
Методом ПЦР установлено, что у пациенток с ОС в сравнении с пациентками, проходившими программу ВРТ в естественном цикле, большие уровни экспрессии ESR1 (p=0,012), VEGF 121 (p=0,01), тенденция более высоких значений AQP3 (p=0,09); уровень экспрессии VEGF165 сопоставим в обеих группах. Высокие уровни экспрессии ESR1, VEGF121, AQP3 у пациенток с ОС ассоциированы с более высокими показателями доменов ИЖСФ (FSFI) «возбуждение», «любрикация», «желание».
Изученные особенности генной экспрессии факторов вагинальной трансклеточной секреции (AQP3, ESR1, VEGF121 и VEGF165) в программе ЭКО при гормональной стимуляции и в естественном цикле у женщин со сниженным сексуальным функционированием позволили определить некоторые патогенетические механизмы нарушений вагинальной секреции, генитальной сексуальной реакции (возбуждение, любрикация), а также формирования диспареунии. Полученные результаты раскрывают терапевтические возможности секреторных молекулярных компонентов при различных заболеваниях вульвы, включая склероатрофический лишай, атопический дерматит, нейродермит, вульводинию.



