Гистерэктомия – одна из наиболее распространенных операций в практике хирурга-гинеколога; в среднем треть женщин старше 50 лет подвергаются выполнению гистерэктомии [1]. Наиболее частые причины, ассоциированные с тотальной гистерэктомией: лейомиома матки и аденомиоз [2]. Сведения о первой в мире лапароскопической тотальной гистерэктомии (ЛТГ) опубликованы в 1989 г. С этого времени частота выполнения операции возросла с 1 до 28%. Противоречивость взглядов в отношении дороговизны ЛТГ до сих пор продолжает обсуждаться [3, 4]. В свою очередь, бесспорны ее преимущества — менее выраженные тошнота, рвота и болевой синдром, ранняя активизация и начало перорального питания, возможность ускоренной реабилитации и ранней выписки из стационара и, что особенно важно — полная удовлетворенность пациентов качеством оказания медицинской помощи [5]. При этом частота осложнений эндоскопического и абдоминального доступа сопоставимы между собой, но некоторые осложнения специфичны именно для лапароскопии. Так, несостоятельность купола влагалища (НКВ) после лапароскопии, когда при отсечении матки от влагалища используется монополярная коагуляция, наблюдается в 14–35 раз чаще (4,1%), чем при вагинальном (0,29%) и абдоминальном доступе (0,12%), где применяется «острый» способ [6]. В связи с этим можно предположить, что процессы репаративной регенерации «ожоговой» поверхности и ткани, иссеченной «острым» путем, имеют качественные и временные различия, что и объясняет высокую частоту НКВ при эндоскопическом доступе. Более того, вредные привычки (курение), некоторые состояния: гиповитаминоз, истощение, иммуносупрессия, длительный прием кортикостероидов, менопауза, лучевая и химиотерапия в анамнезе, сопутствующие заболевания дыхательной системы, ожирение, сахарный диабет – способны качественно изменить процессы заживления раны, повышая риск НКВ [7, 8]. Как правило, осложнение возникает на 14–16-е сутки после выписки из стационара и может представлять жизненно опасную ситуацию для пациентки [9].
Целью исследования явился поиск факторов риска осложнений после ЛТГ, что позволит обоснованно выбирать доступ и способ ушивания купола влагалища, аргументированно планировать оптимальный срок пребывания стационаре, а также рационально осуществлять послеоперационное ведение пациентов, сокращая тем самым число повторных госпитализаций и связанные с этим финансовые затраты.
Материалы и методы
Проведена ретроспективная оценка течения послеоперационного периода у 87 пациенток после ЛТГ, выполненной по поводу заболеваний матки и придатков матки. Из них у 54 (62,1%) женщин выполнено трансвагинальное закрытие купола влагалища, в 33 (37,9%) случаях — интракорпоральное. Ретроспективное исследование выполнено на базе ГАУЗ Кемеровской области «Новокузнецкая городская клиническая больница № 1 им. Г.П. Курбатова» и Группы компаний «Мать и Дитя Сибирь».
Критериями включения в исследование послужили: наличие доброкачественных заболеваний матки и придатков матки, требующих гистерэктомии (миома, аденомиоз, их сочетанные формы, доброкачественные новообразования яичников), информированное добровольное согласие пациентки. Критериями исключения являлись: злокачественные новообразования матки и придатков матки, случаи конверсионной лапаротомии, закрытие купола влагалища через мини-лапаротомический доступ. Всего было проанализировано 58 клинических, анамнестических и периоперационных факторов: соматические заболевания и оперативные вмешательства в анамнезе, показания к операции (миома матки, аденомиоз, доброкачественные опухоли яичника), интраоперационная кровопотеря, продолжительность операции, способ закрытия купола влагалища (интракорпоральный, трансвагинальный), вариации наложения шва (одиночный, непрерывный).
В послеоперационном периоде комплекс исследования включал: ультразвуковое исследование, допплерометрию, цветовое допплеровское картирование культи влагалища на 2-е сутки после операции, общий анализ крови на 3-и сутки после операции с вычислением лейкоцитарного индекса интоксикации (ЛИИ) по Кальфу–Калифу. Кодирование послеоперационных осложнений проводилось по МКБ-10; длительность наблюдения составила 6 недель. В 16 случаях были зарегистрированы осложнения позднего послеоперационного периода: в 10 случаях – кровотечение из слизистой купола влагалища по причине его частичной несостоятельности, в 2 – инфекционные осложнения зоны хирургического вмешательства (ИОХВ), в 2 – перитонит, в 1 – перитонит в сочетании с ИОХВ, в 1 – эвентрация.
Статистический анализ
Проверка нормальности распределения признаков проводилась критерием Шапиро–Уилка. В результате были выявлены значительные отклонения распределения признаков от нормального. Описательная статистика количественных признаков представлена медианой и интерквартильным размахом – Me (Q1;Q3). Анализ двух групп по количественному показателю проводился с помощью критерия Манна–Уитни.
Сравнения двух групп по качественным номинальным показателям проводили в ходе анализа таблиц сопряженности критерием χ2 Пирсона. Для слабонасыщенных таблиц (имелись ячейки со значениями ≤5) оценку статистической значимости проводили с помощью точного критерия Фишера. В качестве показателя величины эффекта рассчитывали относительные шансы (ОШ) с 95% доверительным интервалом (ДИ).
Многофакторный анализ проводился с помощью бинарной логистической регрессии, отбор переменных – методом прямого включения на основе статистики Вальда, оценка качества на каждом шаге выполнялась на основе R2 Нейджелкерка.
Различия считали статистически значимыми при p≤0,05. Расчеты и графические построения выполнялись с использованием программы GraphPad Prism (v.9.3.0 лицензия GPS-1963924) и статистической среды R (v.3.6, лицензия GNU GPL2).
Результаты
Всего в исследовании принимали участие 87 женщин, медианный возраст которых составил 50 (46;57) лет. У 16 пациенток были зарегистрированы осложнения позднего послеоперационного периода. Анализ показал, что пациентки без осложнений и женщины, у которых были выявлены осложнения позднего послеоперационного периода, были сопоставимы по большинству основных показателей акушерского, гинекологического и клинического анамнеза, а также показателей оперативного вмешательства и послеоперационного периода (табл. 1).

Женщины, у которых были выявлены осложнения послеоперационного периода, по сравнению с женщинами без осложнений (рисунок), характеризуются более высоким индексом массы тела; в частности у них чаще встречалось ожирение (81% против 25%; p<0,001); среди них была выше доля женщин репродуктивного возраста (31% против 6%; р=0,009); чаще встречались выкидыши в анамнезе (31% против 11%; р=0,05), наботовы кисти шейки матки (81% против 49%; р=0,03) и заболевания дыхательной системы (25% против 6%; р=0,03). У женщин с осложнениями послеоперационного периода, по сравнению с группой без осложнений, ушивание купола влагалища проводилась трансвагинально (63% против 18%; p<0,001), непрерывными швами (38% против 11%; р=0,02). Компенсированный тип индекса резистентности (IR) влагалищной ветви маточной артерии у таких женщин встречался реже, чем у женщин без осложнений (31% против 70%; р=0,003). То есть наличие полноценного кровотока в зоне оперативного вмешательства является, по сути, протективным фактором, обеспечивающим полноценный процесс заживления раны.
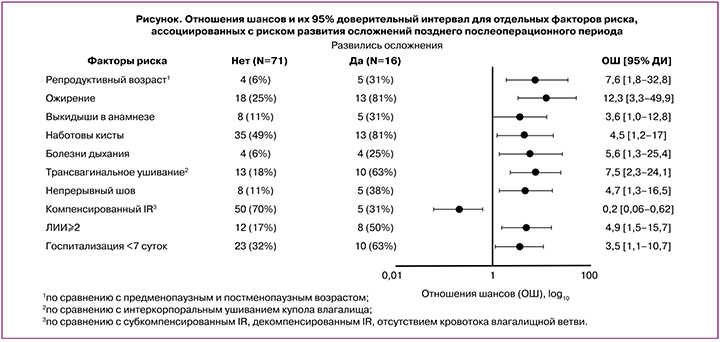
Анализ показателей послеоперационного периода выявил, что в группе женщин, у которых впоследствии развились осложнения, была выше доля пациенток с уровнем ЛИИ на 3-и сутки ≥2 (50% против 17%; р=0,008). Также стоит отметить, что женщины с развившимися осложнениями позднего послеоперационного периода меньше времени проводили в стационаре: доля женщин, длительность госпитализации которых была менее 7 суток, выше у женщин с осложнениями (63% против 32%; р=0,04).
Для выявления факторов риска, имеющих самую сильную взаимосвязь с риском развития осложнений послеоперационного периода, был проведен многофакторный анализ (табл. 2), который выявил, что факторами, наиболее сильно ассоциированными с риском развития послеоперационных осложнений, являются: ожирение – ОШ=13,7 (95% ДИ 2,2–83,2), трансвагинальное ушивание купола влагалища (по сравнению с интеркорпоральным) – ОШ=8,8 (95% ДИ 1,7–46,4), ЛИИ на 3-и сутки выше 2 – ОШ=7,2 (95%ДИ 1,2–42,8), репродуктивный возраст пациентки (по сравнению с предменопаузным и постменопаузным) – ОШ=6,5 (95%ДИ 1,0–44,7).

Статистически значимым протективным фактором установлен компенсированный кровоток IR влагалищной ветви маточной артерии (по сравнению с субкомпенсированным, декомпенсированным типом либо отсутствием кровотока) – ОШ=0,2 (95%ДИ 0,03–0,9).
Обсуждение
Несмотря на столь значительные плюсы, минимально инвазивная хирургия не является «минимальной» в отношении развития послеоперационных осложнений, частота которых не имеет тенденции к снижению. Среди осложнений, связанных с ЛТГ, выделяют: кровотечение в раннем послеоперационном периоде, ранение мочевого пузыря и мочеточников (0,02–1,7%), образование пузырно-влагалищного свища (0,2%), повреждение стенки кишечника (0–0,05%), целлюлит купола влагалища (0,2%), повреждение крупных сосудов (0,04–0,1%) и НКВ с эвисцерацией или без таковой [10].
Случаи формирования НКВ крайне редки после открытой и трансвагинальной гистерэктомии – от 0,14 до 4,1%; напротив, частота развития данного вида осложнений после лапароскопической и роботической тотальной гистерэктомии составляет более 5% [11]. В нашем исследовании НКВ имела наибольшую частоту в структуре осложнений у пациенток, перенесших ЛТГ. Как правило, НКВ возникает после выписки из стационара, что требует повторной госпитализации и операции под общим наркозом (кровотечение, эвентрация петель кишечника во влагалище, перитонит) [9].
Важной составляющей рисков НКВ является неблагоприятный преморбидный фон пациентки, снижающий процессы репарации тканей: курение, ожирение, сахарный диабет, хроническая обструктивная болезнь легких, иммунокомпрометированный статус, длительный прием кортикостероидов [7, 8]. Кроме того, монополярная электрокоагуляция во время кольпотомии способствует расширению зоны некроза и деваскуляризации стенки влагалища, компрометируя тем самым процессы репарации [12]. Наслоение нескольких неблагоприятных факторов делает риск осложнений значительным. В свою очередь, наличие адекватной перфузии в области купола влагалища было бы залогом полноценного заживления после операции, но эта связь мало обсуждается в научной литературе [13]. При этом оценка кровотока краев раны эффективно используется при создании анастомозов в колоректальной, пластической и реконструктивной хирургии с интраоперационным применением лазерной ангиографии и ICG (Indocyanine Green) перфузии [14, 15]. Такая практика представляется чрезвычайно полезной, что требует разработки и актуализации в гинекологической хирургии [16]. Тем более что в акушерско-гинекологической практике оценка кровотока с прогностической целью осложнений беременности (эклампсия, аутоиммунные заболевания, гипертензия) широко используется [17].
Маточная артерия, будучи крупной ветвью внутренней подвздошной артерии, обеспечивает кровоток не только в матке, но и в некоторых отделах маточных труб и яичников, а также принимает участие в кровоснабжении влагалищного свода и мочевого пузыря [18]. В этой связи, кроме послеоперационной оценки кровотока влагалищной артерии [19], чрезвычайно полезно будет предоперационное дуплексное сканирование; тем более что известно о 4 анатомо-топографических вариантах маточной артерии, и это, скорее всего, также будет иметь прогностическое значение [20]. Необходимо подчеркнуть, что сложности в адекватной оценке кровотока маточной артерии вполне объяснимы и могут потребовать дополнительного обследования в виде проведения неинвазивной магнитно-резонансной ангиографии с 3D-реконструкцией с использованием контраста [21].
Параметры оценки эффективности кровоснабжения купола влагалища включают в себя определение скорости кровотока, индекса резистентности (RI), пульсового индекса (PI) в маточной артерии, наличия диастолических узлов (DN). Известно, что билатеральные изменения, равно как и присутствие определенной формы пульсовой волны (диастолический узел) в маточных артериях, являются маркерами повышенного риска осложнений [22].
Заключение
Таким образом, определение факторов риска НКВ после лапароскопической гистерэктомии позволяет оптимизировать периоперационный менеджмент: обоснованно выбирать оперативный доступ и способ ушивания купола влагалища, отказавшись, например, от эндоскопического вмешательства при наличии нескольких неблагоприятных факторов и склониться в пользу трансвагинального или лапаротомного доступа. В свою очередь, при лапароскопическом доступе в большей степени следует практиковать интракорпоральный способ ушивания купола влагалища. Кроме того, изучение факторов риска осложнений позволяет планировать сроки пребывания в стационаре после операции, исключая необоснованную раннюю выписку или, напротив, длительную задержку пациентки в стационаре без необходимости. После выписки из стационара такой подход делает персонифицированным наблюдение пациентки с высоким риском НКВ на амбулаторном этапе, снижая, тем самым, число повторных госпитализаций и связанных с этим финансовых затрат.



