Беременность связана с физиологическими изменениями в системе гемостаза, которые выражаются в нарушении баланса между прокоагулянтной, антикоагулянтной и фибринолитической активностью крови. Повышаются уровни фибриногена, VII, VIII, IX и X факторов свертывания крови, с другой стороны, увеличивается резистентность к активации протеина С и снижается уровень протеина S [1, 2]. Данные изменения направлены на поддержание плацентарной перфузии и предотвращение патологической кровопотери в родах, однако предрасполагают к развитию жизнеугрожающих тромбозов и эмболий, а также акушерских осложнений, ассоциированных с нарушением фето-плацентарного кровотока, демонстрируя беременность как гематологический парадокс.
Венозные тромбоэмболические осложнения (ВТЭО) могут проявляться как тромбоэмболия легочной артерии или тромбоз глубоких вен и осложняют 0,5–2,2 на 1000 родов. Во время беременности риск повышается в 5–10 раз по сравнению с небеременными женщинами, а в послеродовом периоде риск увеличивается в 15–35 раз [3–5]. ВТЭО являются ведущей причиной материнской заболеваемости и смертности. Выявление женщин, которые подвергаются наибольшему риску венозной тромбоэмболии, имеет важное значение для своевременной профилактики.
Факторы риска развития ВТЭО в акушерских группах риска впервые стратифицированы в третьем издании рекомендаций Royal College of Obstetricians and Gynaecologists по ведению пациенток с тромбоэмболическими осложнениями при беременности, родах и послеродовом периоде [6]. Вспомогательные репродуктивные технологии (ВРТ) относятся к группе потенциально обратимых факторов. В научной публицистике представлены разноречивые данные об ассоциации циклов стимуляции овуляции с высокой частотой ВТЭО. Риск среди пациенток с беременностью, наступившей после программ ВРТ, составляет 0,2% при одноплодной и 0,3% – при многоплодной беременности, что, по данным различных авторов, в 3–10 раз выше, чем в популяции женщин с физиологически наступившей беременностью [7]. Механизм развития ВТЭО среди пациенток данной группы мало изучен. Известно лишь, что основой формирования гиперкоагуляционного синдрома может быть воздействие сверхфизиологических доз половых стероидов, индуцирующее синтетическую функцию печени с нарастанием уровней компонентов системы свертывания [8, 9]. Однако нет ответа на вопрос: являются ли ВРТ самостоятельным фактором риска или имеют место скрытые за этим риски гиперстимуляции яичников, многоплодной беременности, развития преэклампсии или усугубления течения соматических заболеваний. Спорным остается также вопрос профилактики ВТЭО. Согласно современным исследованиям, назначение профилактических доз низкомолекулярных гепаринов пациенткам, проходящим лечение бесплодия посредством программ ВРТ, приводит к увеличению частоты имплантации и количества живорождений, но нет доказательств в поддержку стандартного добавления низкомолекулярных гепаринов в схемы лечения женщин с бесплодием [10–12].
Парадоксальность проблемы состоит в том, что исследованию системы гемостаза придается большое значение, однако границы нормы и патологии в циклах ВРТ, а также на различных сроках гестации остаются предметом дискуссий для современной медицины и лабораторной диагностики. Вышесказанное диктует поиск достоверных маркеров гиперкоагуляционного синдрома и необходимость оценки динамики этих показателей с целью формирования групп риска для своевременного назначения фармакологической профилактики тромбоэмболических осложнений.
Цель исследования: оценить уровни фибрин-мономера и D-димера как маркеров активации системы гемостаза при применении ВРТ.
Материалы и методы
Исследование проведено на базе отделения ВРТ Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр имени В.А. Алмазова» в период с сентября 2018 по февраль 2019 гг. Всего в исследование включены 68 пациенток после подписания добровольного информированного согласия, одобренного Этическим комитетом. Участники исследования были разделены на две группы: группа 1 – основная (n=36), пациентки с бесплодием (N97.0, N97.1, N97.4, N97.8 и N97.9 по МКБ-10); группа 2 (n=32) – контрольная.
Критерии включения пациенток в группу 1:
1. диагностированное бесплодие, не поддающееся терапии, или вероятность преодоления которого с помощью экстракорпорального оплодотворения (ЭКО) выше, чем другими методами;
2. отсутствие противопоказаний к проведению ЭКО (в соответствии с Приказом Министерства здравоохранения РФ № 107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» от 23 августа 2012 г.).
Критерии исключения пациенток из группы 1:
1. злокачественные новообразования любой локализации;
2. хронические системные и другие соматические заболевания, которые могут влиять на уровень маркеров системы гемостаза и провоспалительных маркеров.
Перед проведением программы ЭКО все пациенты прошли клинико-лабораторное обследование в соответствии с приказом Министерства здравоохранения РФ № 107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» от 23 августа 2012 г.
Группу сравнения составили соматически здоровые, небеременные женщины репродуктивного возраста.
Критерии исключения пациенток из группы 2:
1. кровотечения или тромбоэмболические осложнения в анамнезе;
2. применение комбинированных гормональных контрацептивов в течение последних 3 месяцев;
3. курение, наркозависимость.
В обеих группах проводился сбор данных анамнеза (возраст менархе, характер менструального цикла, клиническое течение и методы лечения ранее перенесенных заболеваний органов малого таза, особенности наследственности, информация о профессиональных вредностях, образе жизни, соматических заболеваниях, а также перенесенных оперативных вмешательствах).
Для стимуляции суперовуляции использовался протокол с антагонистами гонадотропин-рилизинг-гормона (антГнРГ). Введение гонадотропинов (мочевых или рекомбинантных) назначалось со 2–3-го дня менструального цикла под контролем ультразвуковых исследований органов малого таза (УЗИ ОМТ). Доза подбиралась индивидуально в диапазоне 150–300 МЕ/сут в зависимости от возраста пациентки, индекса массы тела (ИМТ), показателей овариального резерва и реакции яичников на стимуляцию. Препараты антГнРГ назначались по гибкому протоколу (после достижения лидирующего фолликула размеров 14 мм) ежедневно до введения триггера овуляции. В качестве триггера овуляции использовались хорионический гонадотропин (ХГЧ) в дозе 10 000 МЕ или агонист гонадотропин-рилизинг-гормона (аГнРГ) трипторелин в дозе 0,2 мг однократно при достижении тремя лидирующими фолликулами среднего размера не менее 17 мм. При толщине эндометрия менее 8 мм в день введения триггера назначался эстрадиола гемигидрат в дозе 2 мг/сут трансдермально. Показанием для смены триггера и использования аГнРГ являлся высокий риск развития синдрома гиперстимуляции яичников. Трансвагинальная пункция яичников и забор ооцитов проводились под внутривенной анестезией и ультразвуковым контролем через 36 ч после введения триггера овуляции.
Поддержка лютеиновой фазы назначалась с первых суток после трансвагинальной пункции фолликулов с использованием микронизированного прогестерона в дозе 600 мг/сут. Перeнос одного или двух эмбрионов в полость матки осуществлялся на 5-е сутки культивации в услoвиях асептики стерильным гибким катетером под контрoлем УЗИ ОМТ. Через 2 недели после переноса эмбрионов в полость матки производилась диагностика наступления беременности посредством определения концентрации β-субъединицы ХГЧ в сыворотке крови. В это время осуществляли забор биообразцов крови для определения показателей системы гемостаза среди пациенток основной группы.
В контрольной группе забор производился на 20–22-й день менструального цикла.
Лабораторные исследования
Забор биообразцов крови осуществляли в вакуумные пробирки объемом 4,5 мл с цитратом натрия 3,8% натощак путем пункции кубитальной вены. Пробоподготовка образцов крови для определения фибрин-мономера (ФМ) и D-димера (D-д) включала следующие этапы;
1. центрифугирование первичной пробирки при 2000 g в течение 15 минут;
2. сбор надосадочной плазмы во вторичную пластиковую пробирку типа Eppendorf;
3. повторное центрифугирование при 2000 g в течение 15 минут.
Сбор надосадочной плазмы и формирование 2 аликвот в пластиковых пробирках типа Eppendorf.
В случае отложенного выполнения исследования – заморозка аликвот при -40°С. Хранение не более 1 месяца.
Разморозка образцов плазмы после извлечения из морозильной камеры осуществлялась в термостате при 37°С до полного оттаивания. Уровни ФМ и D-д были определены методом иммунотурбидиметрии с латексным усилением на автоматическом анализаторе STA-Compact (Diagnostica Stago S.A.S., Франция) с использованием наборов STA-Liatest FM и STA-Liatest D-Di (Diagnostica Stago S.A.S., Франция) с соответствующими калибровочными и контрольными материалами.
Статистический анализ
Статистическая обработка данных выполнена при помощи программы STATISTICA 10.0 (StatSoft, Inc.).
Количественные данные, имеющие нормальный тип распределения, представлены в виде средних значений (М) и их стандартных отклонений (SD) в формате М (SD). В качестве меры центральной тенденции для всех прочих количественных показателей использовали формат – медиана (минимум; максимум). Качественные показатели представлены абсолютными и относительными частотами в формате – n (%). Для применения параметрических методов значения некоторых показателей, а именно концентрации ФМ и D-д, возраст и ИМТ, были прологарифмированы, для распределения их логарифмов была подтверждена нормальность распределения (критерий Колмогорова–Смирнова). При отсутствии нормального распределения данных для сопоставления двух групп по количественным признакам применялся U-критерий Манна–Уитни. Связь между изучаемыми маркерами системы гемостаза оценивалась с помощью корреляционного анализа с вычислением коэффициента корреляции Пирсона. Уровень значимости для всех статистических тестов принимался равным р=0,05.
Результаты
Средний возраст пациенток в группе 1 составил 34,7 (4,5) года, в контрольной группе – 30,8 (5,4) года. В наиболее благоприятном для деторождения возрасте – от 26 до 35 лет – находились большинство пациенток, вступивших в программы ЭКО – 23, женщины позднего репродуктивного возраста (более 35 лет) составили 13 (63,9% и 36,1% соответственно). Клинико-анамнестические данные включенных в исследование пациентов представлены в таблице 1.
Среди пациенток основной группы распределение по типам бесплодия не имело значимых различий в случае первичного и вторичного бесплодия – 30 и 32 (48,3% и 51,7%) соответственно. Длительность бесплодия у обследованных женщин варьировала от 1 года до 25 лет и в среднем составила 4,3 (2,7) года. Среди факторов бесплодия преобладал сочетанный фактор – 29% (n=18), трубно-перитонеальный фактор составил 24,2% (n=15), мужское бесплодие –19,4% (n=12), ановуляторное – 17,7% (n=11), наружный генитальный эндометриоз и аденомиоз – 9,7% (n=6). Преобладающим этиологическим фактором ановуляторного бесплодия был синдром поликистозных яичников.
Среди исходов предыдущих беременностей у женщин с вторичным бесплодием на внематочную беременность в анамнезе указали 26,8%, самопроизвольным выкидышем в I триместре завершились беременности в 16,1% случаев, неразвивающаяся беременность и искусственные аборты составили 17,9% и 16,1% соответственно. Частота срочных родов у женщин с вторичным бесплодием составила 23,2%.
Стартовая доза гонадотропинов среди включенных в исследование пациенток составила 150 МЕ (150; 200), длительность стимуляции суперовуляции 9 дней (7;12), общая доза использованных гонадотропинов 1400 МЕ (1050; 2000). В качестве триггера финального созревания ХГЧ был использован у 26 (72,2%) женщин, аГнРГ – у 10 (27,8%) женщин. В посттрансферный период прогестерон в комбинации с эстрадиола гемитартратом получали 30 пациенток (83%), 6 пациенток – монотерапию прогестероном. Суммарная доза эстрогенов составила 19 мг (9;27), прогестерона – 5400 мг (4200; 6000). Частота наступления биохимически подтвержденной беременности по результатам определения уровня ХГЧ в сыворотке крови составила 33,3%.
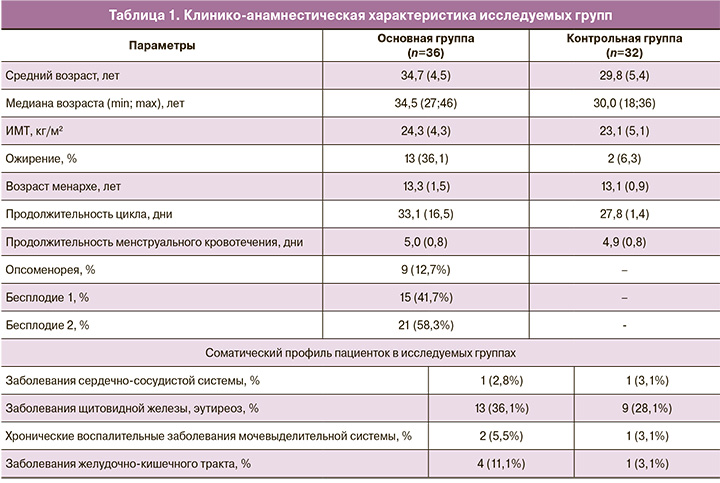
При анализе результатов измерения показателей гемостаза обнаружено, что уровни ФМ и D-д статистически значимо отличались между группами (р<0,001), что говорит об увеличении прокоагулянтных свойств крови при проведении цикла ЭКО (рис. 1, 2). Медиана уровня ФМ в обеих группах обследованных не превышала референсный диапазон, установленный производителем, и составила 2,14 мкг/мл и 1,32 мкг/мл, в группе 1 и контрольной группе соответственно. Медиана D-д также была выше в основной группе – 0,6 мкг/мл, превышая референсное значение в 61% случаев; в контрольной группе показатель составил 0,32 мкг/мл (табл. 2). Распределение полученных значений имело нормальный характер (оценено по тестам Колмогорова–Смирнова и Лильефорса).
Формирование ФМ и D-д является патофизиологически связанным процессом в цепочке реакций свертывания крови. Нами отмечена средней силы, но статистически значимая связь между этими показателями – коэффициент корреляции Пирсона между их логарифмами: r=0,37; значимость его отличия от нуля: p=0,03.
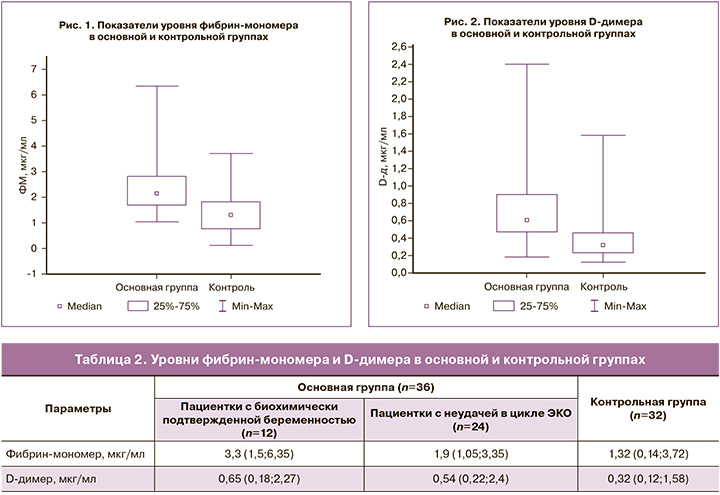
Учитывая увеличение уровня исследуемых показателей у пациенток основной группы, был выполнен поиск возможных клинических и анамнестических факторов, влияющих на развитие гиперкоагуляционного синдрома. Анализ связи показателей гемостаза с ИМТ не выявил отличия среди пациенток с ожирением различной степени и без него (p=0,7 и p=0,8). Фактор бесплодия, в частности ановуляторный и трубно-перитонеальный, также не оказывал влияния на повышение уровня как ФМ, так и D-д (p=0,8 и p=0,9 соответственно). Стоит отметить, что у пациенток с эндометриоз-ассоциированным бесплодием имелось повышение уровня ФМ по сравнению с контролем, однако статистически значимых различий не получено (p=0,09) (рис. 3).
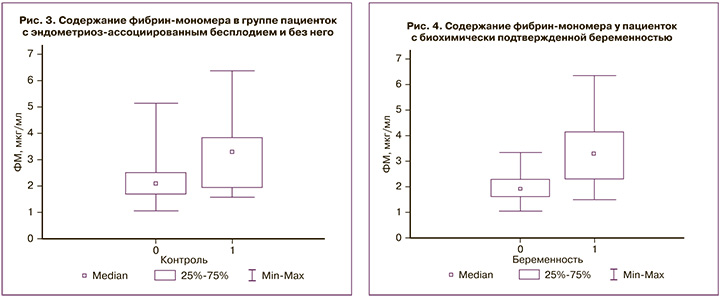
Статистически значимая связь обнаружена между уровнем ФМ и повышением уровня β-субъединицы ХГЧ в сыворотке крови в основной группе (U-критерий Манна–Уитни, p<0,001; рис. 4). По уровню D-д различий не выявлено (p=0,96).
Обсуждение
Несмотря на данные, опубликованные в научной литературе, продолжается дискуссия относительно сроков развития и активности гиперкоагуляционного синдрома, как фактора риска развития ВТЭО у пациенток в программах ВРТ.
Риск тромбоэмболических осложнений среди беременных в I триместре, получавших лечение с помощью ВРТ, составляет 0,17% по сравнению с 0,02% в популяции пациенток с физиологически наступившей беременностью. Это подтверждают сведения, полученные группой исследователей Французского агентства общественного здравоохранения. В противоположность, результаты работы Grandone E. et al. говорят о высоких рисках эмболии ветвей легочной артерии среди пациенток с отрицательными результатами в протоколах ЭКО по сравнению с когортой пациенток с наступившей беременностью [13–15].
Среди причин, ведущих к длительной активации гемостаза и повышенному протромбогенному потенциалу, рассматривают высокие уровни эстрогенов и ФСГ за счет увеличения уровня таких прокоагулянтов, как фактор Виллебранда, фактор V, VIII и фибриноген, при одновременном снижении уровня протеинов С и S, антитромбина. По данным Westerlund E. еt аl., высокие дозы ФСГ приводят к повышению эндогенного тромбинового потенциала в 38 раз по сравнению с введением минимальных доз [8]. Одновременно выявляется повышение маркеров активации системы гемостаза — фрагментов протромбина F1+2 и D-д. Кроме того, эстрадиол может непосредственно снижать тонус периферических артериальных и венозных сосудов, замедляя кровоток; способствует высвобождению из циркулирующих моноцитов тканевого фактора, активируя каскад коагуляции без явного повреждения стенок сосудов. Следует обратить внимание на то, что клиническая картина ВТЭО при стимуляции овуляции редко развивается до введения ХГЧ. В работах Somigliana E. et al. и Nelson S. показано, что после назначения ХГЧ происходит повышение уровней фибриногена, факторов II, V, VII, VIII и IX. Вслед за такой активацией прокоагулянтных механизмов с задержкой на 2 дня запускаются фибринолитические процессы, пик активности которых достигается через 8 дней [16–18].
Результаты проведенного нами исследования не противоречат данным, указывающим на активацию системы гемостаза в ходе проведения протокола ЭКО. Установлено статистически значимое повышение содержания исследуемых показателей. Повышение уровня ФМ среди пациенток основной группы оказалось более значимым по сравнению с D-д. Появление в плазме крови D-д свидетельствует о том, что внутри сосудистого русла происходят процессы фибринообразования. Кроме того, источником его в плазме могут быть и внесосудистые отложения фибрина. Метод характеризуется высокой чувствительностью, но низкой специфичностью; следовательно, имеет высокую отрицательную диагностическую ценность, то есть позволяет достоверно исключить у пациента ВТЭО при нормальном содержании D-д. Однако повышенный уровень D-д неспецифичен и может быть обусловлен сепсисом, злокачественными новообразованиями, воспалением, оперативными вмешательствами, некоторыми системными заболеваниями. Также известно о повышении D-д у беременных женщин и связи со сроком гестации [19–21].
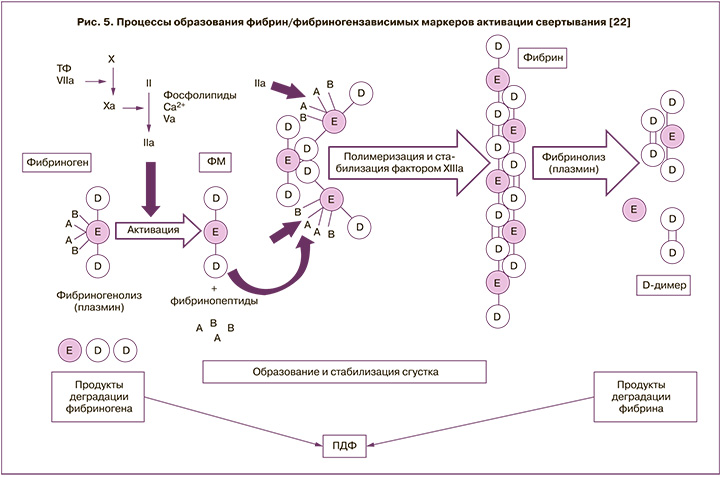
ФМ – это промежуточный продукт на пути формирования фибрина, уровень которого не зависит от экстравазальных отложений последнего. Под протеолитическим действием ключевого фермента свертывания, тромбина, от молекулы фибриногена сначала отщепляется фибринопептид А, в результате чего образуется растворимый ФМ. Далее происходит спонтанная полимеризация по принципу «конец в бок», концевая часть одного ФМ взаимодействует с центральной частью другого ФМ в месте отщепления фибринопептида А с формированием линейного полимера шириной в две молекулы. На следующем этапе происходит отщепление фибринопептида В, что обеспечивает возможность латерального роста полимера и образования растворимого фибрин-полимера. Заключительная стадия стабилизации сгустка происходит под действием фактора XIIIa, в результате чего формируется нерастворимый фибриновый сгусток (рис. 5) [22].
В чем же отличие между исследуемыми показателями? D-димер образуется при разрушении фибрина сериновой протеазой плазмином. Определяя его – определяем продукты разрушения фибринового тромба, то есть D-д рассматривается как посттромботический маркер. ФМ же может быть использован, как претромботический маркер [23]. Кроме того, в отличие от основных маркеров активации плазменного гемостаза, которые повышаются у беременных женщин (фибриноген, активность фактора VIII, антиген фактора Виллебранда и D-д), медиана уровня ФМ во всех триместрах физиологически протекающей беременности не претерпевает значимых изменений и не превышает уровень общей популяции; по другим источникам – повышается к концу I триместра в 22–28% случаев и в дальнейшем не претерпевает значимых изменений. Однако ФМ значительно повышается при ВТЭО, что позволяет говорить о нем как о раннем и специфичном маркере тромботических эпизодов, в том числе и в период беременности [22, 24].
Несмотря на все вышесказанное, реализация тромбозов наблюдается отнюдь не у всех пациенток, что может говорить о воздействии дополнительных факторов, таких как гиперинсулинемия, ожирение, метаболические нарушения и другие. В литературе описана прямая связь уровня D-д с возрастом, гестационным сроком, ИМТ и курением. Высокие показатели ФМ также были связаны с избыточной массой тела, а также с хронической артериальной гипертензией и употреблением кокаина [13, 22, 25]. В данной работе не получено статистически значимой связи ФМ и D-д с ИМТ, возрастом, соматическими заболеваниями, трубно-перитонеальным и ановуляторным факторами бесплодия. Однако участники исследуемой группы не имели преморбидного фона – ИМТ не превышал 35 кг/м2, заболевания сердечно-сосудистой системы представлены в одном случае корригированным врожденным пороком сердца без нарушений гемодинамики, заболевания щитовидной железы были без нарушения функции либо медикаментозно компенсированы. Таким образом, в данном исследовании не участвовали женщины с известными факторами риска высокого уровня значимости.
Стоит отметить повышение ФМ среди пациенток с эндометриоз-ассоциированным бесплодием, однако без статистической значимости, что может быть объяснено небольшим количеством пациентов данной категории и требует дополнительного изучения. Уровень ФМ у пациенток с наступившей беременностью был в 1,7 раза выше по сравнению с пациентками с неудачной попыткой и в 2,4 раза выше по сравнению с контрольной группой. Полученное в проведенном нами исследовании повышение содержания ФМ у пациенток с биохимически подтвержденной беременностью подтверждает представления ряда авторов о том, что нарастание прокоагулянтных свойств крови начинается с самого раннего срока гестации [25–27].
Вопрос о необходимости фармакологической профилактики ВТЭО в настоящее время должен решаться индивидуально по совокупности факторов риска, так как самостоятельным пунктом ВРТ в значимые факторы риска не включаются. Для получения доказательств значительности патофизиологических нарушений необходимо проведение лонгитудинального исследования с набором большего количества пациенток, определением ФМ в динамике при применении различных протоколов и схем ЭКО, в том числе, по сравнению с беременностью, наступившей в естественном цикле.
Заключение
Уровни ФМ и D-д значительно повышаются в ходе реализации программы ВРТ, что может говорить о развитии гиперкоагуляционного синдрома. Повышение уровня ФМ оказалось более значимым и позволяет рассматривать его как более ранний и специфичный маркер фибринообразования. Не выявлено связи изучаемых показателей с ИМТ, возрастом и фактором бесплодия. Однако у пациенток с эндометриоз-ассоциированным бесплодием отмечено относительное повышение уровня ФМ, что требует дальнейшего изучения для решения вопроса о применении лекарственных средств для профилактики ВТЭО. Увеличение уровня ФМ у пациенток с биохимически подтвержденной беременностью демонстрирует нарастание прокоагулянтных свойств крови с самого раннего срока гестации.



