Эндометрий – одна из наиболее сложных в структурно-функциональном отношении тканей женского организма, ее уникальность проявляется в реализации многочисленных функций, включающих защиту от инвазии инфекционных агентов, создание адекватных условий для имплантации и способность к отторжению при отсутствии наступления беременности. В обеспечении этих функций участвуют различные типы клеток (эпителиальные, стромальные, эндотелиальные), находящиеся под циклическим контролем яичниковых стероидов и паракринным влиянием биологически активных веществ [1]. Гормональный дисбаланс, проявляющийся длительным воздействием эстрогенов на фоне прогестерондефицитного состояния, продолжает рассматриваться в качестве одной из ведущих причин нарушений эпителиально-стромального взаимодействия структурных компонентов эндометрия. Это сопровождается формированием спектра морфологических изменений, лежащих в широком диапазоне – от пролиферации эндометрия при отсутствии его секреторной трансформации до возникновения различных типов гиперплазии (ГЭ) [2]. ГЭ клинически манифестируется непрогнозируемыми маточными кровотечениями, зачастую имеет рецидивирующее течение [3]. Однако многие вопросы терапии и профилактики ГЭ все еще далеки от окончательного решения, международные рекомендации тактики ведения пока не определены.
В настоящее время прогестагены рассматриваются как наиболее признанный вид гормонотерапии ГЭ [4,5]. Особенно эффективно локальное применение левоноргестрела (ЛНГ) в виде внутриматочной системы (ВМС) [6]. Этот вид терапии, очевидно, оптимален при сочетанных гиперпластических процессах эндо- и миометрия и предраковых состояниях. При ПГЭ не всегда есть необходимость в непрерывном режиме долгосрочной гормонотерапии ЛНГ. За рубежом накоплен достаточный положительный опыт перорального применения медроксипрогестерон ацетата (МПА) и мегестрол ацетата при ГЭ. Эффективность циклического приема оценивается в 60 – 70%, непрерывного – приближается к 100% [6, 7]. Надо признать, что эти препараты в Россию поступают только в высоких (онкологических) дозировках, не подходящих для лечения ГЭ. Практикующему врачу в нашей стране доступны другие прогестагены: дидрогестерон и натуральный микронизированный прогестерон (МП), который может применяться как перорально, так и вагинально. В клинической практике препарат используется с начала 1980-х годов, в основном для гормональной поддержки беременности [8]. В гинекологии, область применения его более скромная. МП в основном применяется при функциональной недостаточности желтого тела и для защиты эндометрия при проведении заместительной гормонотерапии. Научные публикации об эффективности МП при ГЭ в доступной литературе не встретились. В настоящее время есть возможность оценить эффект препарата не только морфологически, но и иммуногистохимически (ИГХ), определяя экспрессию рецепторов половых стероидов, маркеры пролиферации и апоптоза. Этому существенному вопросу посвящено настоящее сообщение.
Цель исследования – определить эффективность различных схем циклического применения МП при простой ГЭ (ПГЭ) и возможные механизмы реализации его лечебного воздействия.
Материал и методы исследования
В основу работы положены результаты комплексного клинико-лабораторного обследования и лечения 64 женщин в возрасте от 18 до 50 лет, (средний возраст − 40,8±7,02 года, средний ИМТ 27,3±2,1) с ПГЭ. Исследование одобрено этическим комитетом ФГБУ Научный центр акушерства, гинекологии и перинаталогии им. академика В.И. Кулакова Минздрава России.
Показаниями к проведению гистероскопии и кюретажа эндометрия являлись маточные кровотечения различного характера, редко случаи подозрения на патологию эндометрия по данным УЗИ. Более половины пациенток − 38 (59,4%) находились в репродуктивном возрасте, остальные 26 (40,6%) − в пременопаузе. У 56,2% пациенток, несмотря на проведение традиционной гормонотерапии (КОК, прогестагенами, аГнРГ), ГЭ имела рецидивирующий характер. Среднее число ранее произведенных диагностических выскабливаний составило 3,2.
 Для лечения ПГЭ был применен МП в суточной дозе 400 мг перорально или вагинально, по 14- и 21-дневной схемах. В соответствие с этим были выделены 2 группы: 1-я – 31 человека, 2-я – 33. Лечение МП сопровождалось появлением нежелательных эффектов. В течение первого месяца перорального приема МП 58 (90,6%) пациенток предъявили жалобы на головокружение и сонливость, снижающее работоспособность, в связи с этим им было рекомендовано локальное применение препарата. Терапию продолжили 58 пациенток (26 из 1-й группы и 32 – из 2-й), 2 выбыли из исследования из-за дискомфорта во влагалище при местном применении препарата, 4 – по причинам, не связанным с приемом МП. Применение 14- дневной схемы не сопровождалось нарушениями менструального цикла, 21-дневной схема вызвала межменструальные кровяные выделения из половых путей у 24 (75%) пациенток. В связи с этим 10 пациенток через 1 месяц были переведены на 14- дневную схему, 9 выбыли из исследования, 13 продолжили прием МП по 21-дневной схеме в течение 6 месяцев.
Для лечения ПГЭ был применен МП в суточной дозе 400 мг перорально или вагинально, по 14- и 21-дневной схемах. В соответствие с этим были выделены 2 группы: 1-я – 31 человека, 2-я – 33. Лечение МП сопровождалось появлением нежелательных эффектов. В течение первого месяца перорального приема МП 58 (90,6%) пациенток предъявили жалобы на головокружение и сонливость, снижающее работоспособность, в связи с этим им было рекомендовано локальное применение препарата. Терапию продолжили 58 пациенток (26 из 1-й группы и 32 – из 2-й), 2 выбыли из исследования из-за дискомфорта во влагалище при местном применении препарата, 4 – по причинам, не связанным с приемом МП. Применение 14- дневной схемы не сопровождалось нарушениями менструального цикла, 21-дневной схема вызвала межменструальные кровяные выделения из половых путей у 24 (75%) пациенток. В связи с этим 10 пациенток через 1 месяц были переведены на 14- дневную схему, 9 выбыли из исследования, 13 продолжили прием МП по 21-дневной схеме в течение 6 месяцев.
По данным исходного УЗИ органов малого таза наличие патологии эндометрия было заподозрено у 47 (73,4%) больных, из них у 10 (21,2%) был выявлен полип и/или полипы эндометрия. У остальных 17 пациенток (26,6%) − эндометрий соответствовал дню менструального цикла, в этих случаях гистероскопия и кюретаж эндометрия производились в связи с наличием аномальных маточных кровотечений. УЗИ проводили через 3 месяца от начала лечения в 1-ю фазу цикла и по окончании 6 месяцев терапии перед проведением пайпель-биопсии эндометрия. Исходно средняя толщина эндометрия в 1-й группе составила 10,2±0,6 мм, во 2-й – 10,8±0,3 мм (p>0,05), после 3 месяцев лечения эти показатели уменьшились до 6,7±0,8 см и 6,1±0,3 см (p>0,05), по окончанию терапии составили 5,4±0,6 см и 4,7±0,3 см (p>0,05) соответственно.
Морфологическая оценка эндометрия проводилась до начала гормонотерапии и после 6 месяцев ее применения. Во всех случаях взятие ткани эндометрия осуществлялось аспирационной кюреткой пайпель де корнье в последний день приема МП. Наряду с морфологическим проводилось ИГХ- исследование, оценивалось влияние терапии на уровень экспрессии эстрогеновых (ER-α) и прогестероновых рецепторов (PgR), регуляторов пролиферации (Ki67) и апоптоза (BIRC5). В качестве контроля исследованы образцы эндометрия фазы пролиферации (n=8) и секреции (n=7), полученные от здоровых женщин репродуктивного возраста без воспалительных заболеваний органов малого таза и внутриматочной патологии. Перед проведением ИГХ материал фиксировали в 10% растворе нейтрального формалина в течение 24 часов и заливали в парафин. Депарафинированные срезы ткани эндометрия помещали на высокоадгезивные предметные стекла, использовали моноклональные антитела (clone 1D5, Dako Denmark) к ER-α и PgR (clone PgR 636, Dako, Denmark), к Ki67 (clone MIB-1, Dako, Denmark), BIRC5 (clone EP2880Y, 1:250, Epitomics, USA). В качестве вторичных антител использовали пероксидазную систему выявления Dako REAL EnVision Detection System (Dako, Denmark). После проведения ИГХ- реакций срезы контрастировали гематоксилином и заключали в синтетическую среду «Shandon mount TM» (USA).
Применялись методы вариационной статистики в модификации алгоритмов пакета прикладных математических программ Statistica 10.0. Результаты были представлены в виде M±m, различия считались достоверными при р≤0,05. Достоверность межгрупповых различий количественных показателей определяли с помощью критерия Манна–Уитни для несвязанных совокупностей, качественных показателей – χ2- критерия с поправкой Йейтса для малых выборок.
Результаты
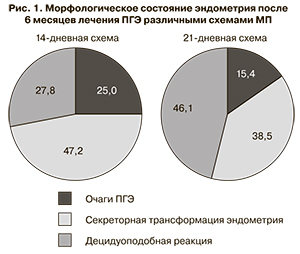
Морфологическими критериями эффективного воздействия МП на эндометрий явились: отсутствие признаков ПГЭ, наличие секреторной трансформации или децидуоподобной реакции. Применение МП у 27 (75%) пациенток из 1-й группы привело к регрессу ПГЭ, из 2-й группы – дало аналогичный эффект у 11 (84,6%) пациенток (p>0,05). У 17 (47,2%) больных 1-й группы и у 5 (38,5%) 2-й (p>0,05) изменения эндометрия характеризовались ремоделированием по секреторному типу с формированием желез, выстланных однорядным эпителием с округлыми, небольшими по размеру ядрами и скудной цитоплазмой. У 10 (27,8%) пациенток 1-й группы и у 6 (46,1%) 2-й группы (p<0,05) лечение МП сопровождалось ремоделированием эндометрия по децидуальному типу с гиперплазией стромального компонента и выраженными предецидуальными изменениями. В некоторых случаях отмечалась децидуоподобная реакция, характеризующаяся наличием большого числа стромальных клеток с обильной эозинофильной цитоплазмой и инфильтрацией лимфоцитами. В отдельных образцах эндометрия отмечалась перестройка сосудов с гиперплазией гладкомышечных и гипертрофией эндотелиальных клеток, приводящих к утолщению стенок сосудов.
Как видно из данных, представленных на рис. 1, после 6 месяцев терапии МП в 25% случаев из 1-й группы и в 15,4% из 2-й сохранялись участки ПГЭ (p>0,05). Эффект лечения в этих 11 случаях был оценен как неполный.
В связи с этим был проведен анализ клинико-анамнестических данных пациенток, не ответивших на терапию полным регрессом ГЭ. Все они находились в позднем репродуктивном возрасте или в периоде менопаузального перехода, 5 (45,4%) имели избыточную массу тела или ожирение. В 9 (81,8%) случаях ПГЭ сочеталась с миомой матки или аденомиозом. В 8 (72,6%) случаях ПГЭ имела рецидивирующее течение, несмотря на проведенную ранее гормонотерапию. В сравнение с группой пациенток с полным регрессом ПГЭ достоверных различий по указанным параметрам не выявлено (p>0,05).
Для оценки механизмов реализации лечебного воздействия МП на эндометрий определялась экспрессия ER-α и PgR, маркера пролиферации – Кi67 и ингибитора апоптоза – BIRC5. На (рис. 2cм на вклейке) показана иммуногистохимическая экспрессия маркеров до и после лечения.
Исходно при ПГЭ уровень экспрессии ER-α в эпителии желез составил 137,5±45,5%, в строме – 118,9±42,7%, экспрессия PgR соответствовала 139,3±44,3 и 118,9±40,8%. В стадию пролиферации уровень экспрессии рецепторов половых стероидов был достоверно выше, чем при ПГЭ (р<0,05). В железах экспрессия ER-α достигла 175,1±12,2%, PgR – 236,4±1,9%, в стромальном компоненте – 137,9±20,1 и 211,4±15,9% В стадию секреции уровень экспрессии ER-α был ниже в эпителии желез (55,1±23,6%) и в строме (20,1±12,3%) по сравнению с эндометрием стадии пролиферации и ПГЭ (р<0,05). Экспрессия PgR была ниже в железах (средний уровень 74,1±7,8%) и выше в строме (193,8±24,6%) в сравнении с ПГЭ (р<0,05).
Шестимесячная терапия МП повлекла за собой снижение экспрессии ER-α и PgR в железах и строме. Динамика показателей не зависела от длительности циклического применения МП, однако ассоциировалась с морфологическим состоянием эндометрия после лечения (рис. 3 А, Б). При достижении секреторной трансформации экспрессия ER-α в эпителии желез снизилась приблизительно в 2 раза (средний уровень – 65±10%), в строме – в 2,6 раза (средний уровень – 45,2±9,4%). При децидуоподобной реакции снижение было более существенным – в 3,5 – 4 раза, средний уровень составил 39,5±8,4 и 28,7±8,1% (р<0,05). Вне зависимости морфологического состояния эндометрия уровень экспрессии PgR в эпителии желез снизился приблизительно в 1,7 раза, при секреторной трансформации составил 79±7,4%, при децидуоподобной реакции – 80±7,1% (р<0,05). В строме прослеживалась иная ситуация: при секреторной трансформации экспрессия PgR возросла в среднем до 147,5±16,5% (p<0,05), при децидуоподобной реакции снизилась до 73,8±10,6% (р<0,05). При неполном ответе на терапию уровень экспрессии ER-α в очагах поражения существенно не изменился, в эпителии желез составил 122,4±20,1%, в строме – 110,2±8,7%, не претерпел изменений и уровень экспрессии PgR в железах – 115,2±7,4%, в строме – 103,1±10,7% (p>0,05). Стоит отметить, что эффективность терапии не зависела от исходного уровня экспрессии рецепторов половых стероидов, ни в одном образце не выявлено ее отсутствие, как до, так и после лечения.
Уровень экспрессии Ki67 при ПГЭ в эпителиальном компоненте эндометрия составил 25,6±10,5%, в строме – 15,7±8,1%. Это ниже, чем в стадию пролиферации (73,5±11,8%) (p<0,05) и выше, чем в стадию секреции (3,4±1,1%) (p<0,05). Существенных различий по уровню экспрессии Ki67 в строме эндометрия по отношению к стадии пролиферации (8,2±6,7%) и секреции (7,6±1,8%) не выявлено (p>0,05).
После шестимесячного воздействия МП экспрессия Ki67 снизилась (рис. 3В): при секреторной трансформации в эпителии желез в 3,3 раза, в строме – в 4,8 раза (p<0,05). Стоит отметить, что в контрольных образцах стадии секреции уровень экспрессии Ki67 был ниже в железистом компоненте, чем в стромальном. При гормональном ремоделировании с секреторной трансформацией наблюдалась обратная ситуация – в железах уровень экспрессии был выше (7,6±1,3%), чем в строме (3,2±1,1%). При формировании децидуоподобной реакции экспрессия Ki67 в железах уменьшилась в 9,4 раза (2,7±0,8%), строме в – 7,4 раза (2,1±0,2%) (p<0,05). При неполном ответе на терапию уровень экспрессии Ki67 был сравним с таковым при ПГЭ и в среднем составил в эпителии 18,2±2,5%, в строме – 12,1±3,4% (p>0,05).
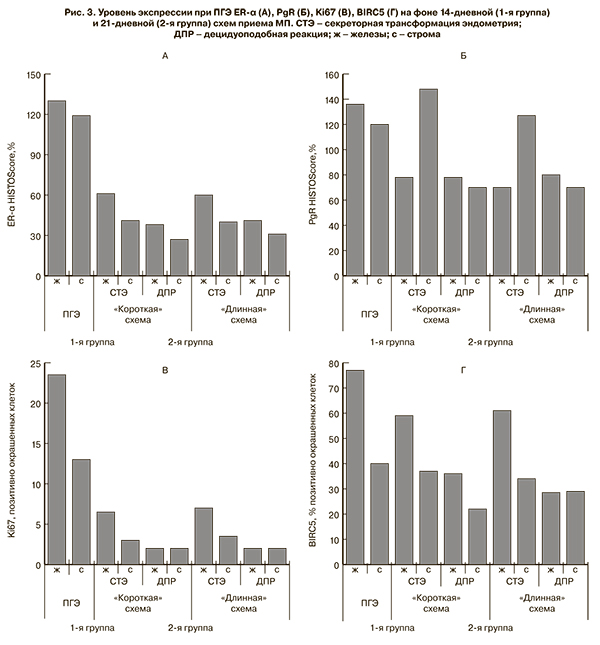
При ПГЭ экспрессия ингибитора апоптоза BIRC5 в эпителии желез составила 75,7±16,3%, в строме – 36,4±14,8%. В фазу пролиферации и секреции показатели были схожими – 77,5±21,2%, 32,5±15,6% и 75,9±17,8%, 42,5±16,5%, соответственно. Как видно из данных, представленных на рисунке 3Г, динамика уровня экспрессии BIRC5 не зависела от схемы приема МП. При достижении секреторной трансформации эндометрия статистически значимого снижения экспрессии белка BIRC5 не выявлено. Экспрессия в железах уменьшилась лишь в 1,2 раза (средний уровень 60±10%), в строме – в 1,1 раза (средний уровень – 38±7,2% (p>0,05). При децидуоподобной реакции эндометрия экспрессия BIRC5 в железах понизилась в 2,0 раза (средний уровень 37,2±4,5%) (p<0,05), в строме – в 1,5 раза (24,2±11,4%) (p>0,05). Уровень экспрессии BIRC5 в эндометрии пациенток с неполным ответом на терапию был сравним с уровнем экспрессии при ПГЭ, в эпителии желез составил 71,2±12,1%, в строме – 39,3±11,6% (p>0,05).
Обсуждение
В течение последнего десятилетия проведено много исследований, направленных на оптимизацию терапии ГЭ. Однако до настоящего времени подходы к тактике ведения пациенток с ГЭ не стандартизированы. Вероятно, это обусловлено отсутствием единого понимания патогенеза ГЭ, субъективностью подходов к постановке диагноза, несовершенcтвом классификации.
Для лечения ГЭ используются различные виды гормонотерапии [6, 7, 9, 10]. Наиболее признанным считается прием прогестагенов, первый опыт их применения относится к началу 60-х годов [11]. Представляется, что на сегодняшний день наиболее эффективным средством терапии ГЭ является ЛНГ-ВМС [5]. Ее применение, видимо, приемлемо не для всех пациенток . Это связано с риском нежелательных эффектов в виде возникновения метроррагий, функциональных кист в яичниках, роста миоматозных узлов [12, 13]. Не редко отказом от терапии ЛНГ-ВМС является нежелание женщины иметь «инородное тело» в организме. Результаты метаанализа 2010 года показали сравнимую эффективность ЛНГ-ВМС и пероральных форм прогестагенов в лечении ПГЭ [14]. За рубежом применяются пероральные формы МПА и мегестрол ацетата, в нашей стране они доступны лишь в высоких дозах, применяемых для лечения онкологических заболеваний. В связи с этим возникла необходимость оценки эффективности доступного на российском рынке МП. Выбор препарата был продиктован также возможностью его локального применения. Научные исследования изучения влияния МП при ГЭ крайне малочисленны. M. Signorelli и соавт. применяли МП в дозе 200 мг в сутки в циклическом режиме для лечения АГЭ, эффективность терапии составила 60% [15]. Стоить отметить, что «полный» ответ в виде регресса ГЭ был получен лишь в 10% случаев, «частичный» в виде сохранения фокусов ПГЭ или КГЭ достигнут в 50% случаев. Авторы обзора, опубликованного в 2012 году, представили данные о возможности лечения ПГЭ МП в дозах 100–200 мг в сутки [4]. По заключению FDA десятидневный курс МП в суточной дозе 400 мг является адекватным для секреторной трансформация эндометрия у 64% больных со вторичной аменореей [16]. Однозначных данных относительно оптимальной дозы и длительности приема МП при ПГЭ нет. Поэтому в настоящем исследовании были использованы две схемы: 14- и 21-дневная. Исходно МП был назначен системно и локально, при пероральном приеме у 90,6% больных отмечены головокружение и сонливость. Это может быть обусловлено действием метаболитов МП – прегненалона и аллопрегненалона, которые, проникая через гематоэнцефалический барьер, связываются с рецепторами ГАМК в головном мозге [16–18]. С целью устранения нежелательных эффектов больным было рекомендовано локальное применение МП. После лечения 21-дневной схемой отмечена низкая приверженность терапии из- за высокой частоты ациклических кровяных выделений из половых путей, так называемых «кровотечений прорыва». Это явилось причиной более широкого использования 14- дневной схемы, на которой подобных нарушений менструального цикла не отмечено.
По результатам проведенного исследования не выявлено зависимости эффективности локального применения МП от режима его назначения: в 1-й группе она составила 75%, во 2-й – 84,6%. Эти данные сопоставимы с результатами ряда исследований по применению циклического режима синтетических прогестагенов, в частности, МПА [19]. Эффективность лечения ПГЭ этим прогестагеном варьирует от 50 до 85% [6, 20]. Все изменения, происходящие под воздействием МП. можно назвать гормональным ремоделированием эндометрия с различной выраженностью ответа на терапию. Несмотря на схожую эффективность использованных схем терапии в виде регресса ПГЭ, у пациенток из 1-й группы почти в 2 раза чаще отмечалась секреторная трансформация эндометрия и в 1,5 раза реже децидуоподобная реакция по сравнении с 2-й группой.
Небольшая длительность наблюдений пока не позволяет ответить на вопрос, имеет ли это клиническое значение. Перспективно проведение долгосрочных исследований. Это, возможно, поможет оценить роль степени гормонального ремоделирования (секреция или децидуоподобная реакция) в восстановлении функциональной активности эндометрия и рецидивировании процесса. Как кажется, это наиболее важно для женщин репродуктивного возраста, заинтересованных в реализации генеративной функции.
Современный уровень знаний диктует необходимость исследования механизмов действия препарата на эндометрий. Это стало предметом наших исследований. Представления об уровне экспрессии половых стероидных гормонов при ГЭ не однозначны [21, 22]. Вполне возможно, что это связано с различными методологическими подходами, вариабельностью выборок (разные типы ГЭ, возраст, численность групп и др.). Проведенное нами исследование подтверждает результаты других работ, касающихся снижения экспрессии PgR, и в большей степени на ER-α под воздействием прогестагенов [23, 24]. Выявлено преимущественное воздействие МП не на железистый, а на стромальный компонент эндометрия.
Известны исследования, в которых показано, что рецепторный фенотип эндометрия определяет эффект терапии. Так, I.D. Gallos и соавт. выявили взаимосвязь между низкой экспрессией ER-α, PgR при ГЭ и отсутствием эффекта от локального воздействия ЛНГ [25]. Подобную взаимосвязь в нашем исследовании проследить не удалось, поскольку у пациенток с персистенцией ПГЭ экспрессия рецепторов исходно была на достаточно высоком уровне.
Согласно полученным результатам, более низкий уровень экспрессии маркера пролиферации Ki67 был выявлен в образцах гиперплазированного эндометрия по сравнению с эндометрием в стадии пролиферации. При ПГЭ пролиферация выше, чем в стадию секреции. Эти данные вполне согласуются с результатами других исследователей [21, 26]. Было отмечено более выраженное воздействие МП на строму, чем на эпителий. Это выразилось в тенденции к повышению уровня экспрессии Ki67 в железистом компоненте по сравнению со стромальным при гормональном ремоделировании с секреторной трансформацией эндометрия. При воздействии МП почти во всех случаях наряду со снижением пролиферации определена активация апоптоза, об этом удалось судить по снижению уровня экспрессии ингибитора BIRC5. Выявленные тенденции изменения маркеров, возможно, отражают молекулярные механизмы гормонального ремоделирования эндометрия по секреторному и децидуоподобному типам. Обращает внимание тот факт, что структурные перестройки эндометрия, связанные с шестимесячным приемом МП и гормональным ремоделированием, не идентичны секреторному эндометрию здоровых женщин по уровню экспрессии половых стероидных гормоном, изученных маркеров пролиферации и апоптоза.
Есть мнение, что высокая пролиферация эндометрия является неблагоприятным прогностическим признаком, указывающим на риск малигнизации эндометрия [27, 28]. В случае отсутствия эффекта от терапии МП не наблюдали снижения пролиферации и активации апоптоза. Возможно, это является предиктором как персистенции, так и прогрессирования ПГЭ. У больных с ПГЭ не выявлено существенных различий в исходном уровне экспрессии маркеров пролиферации и апоптоза. Из-за этого предсказать эффективность терапии на основании данных показателей оказалось затруднительным.
Понимание молекулярных механизмов успешного воздействия гормонотерапии на гиперплазированный эндометрий могло бы приблизить нас к решению проблемы профилактики онкологических заболеваний и сохранения репродуктивного здоровья женщин. Хотелось бы думать, что это станет возможным при установлении молекулярно-генетических предикторов чувствительности и резистентности к прогестагенам. Нельзя не согласиться с мнением известных ученых R.E. Scully, H. Fox, F.A. Langley: « Чем лучше мы понимаем истинную природу патологии, тем выше вероятность назначения адекватной терапии» [29– 31].
Заключение
Полученные результаты позволяют сделать вывод о сопоставимой эффективности 14- и 21-дневной схем вагинального применения 400 мг МП в лечении ПГЭ (регресс в 75 и 84,6%). Гормональное ремоделирование эндометрия характеризовалось как секреторной трансформацией, так и децидуоподобной реакцией, преимущественно на 21-дневной схеме.
Высокая частота ациклических кровяных выделений и низкая приверженность терапии МП по 21-дневной схеме едва ли оправдывают целесообразность ее применения.
Гормональное ремоделирование эндометрия под действием МП отличается от секреторной фазы и децидуальной трансформации неизмененного эндометрия, об этом свидетельствуют иммуногистохимические показатели пролиферативной активности, апоптоза и рецепторов половых стероидных гормонов.
Циклический режим локального воздействия МП опосредуется более выраженным влиянием на строму эндометрия и менее выраженным на паренхиму, это отражается на показателях пролиферативной активности и экспрессии PgR.
Значительное снижение экспрессии ER-α и PgR, понижение пролиферативной активности (уменьшение уровня экспрессии Ki-67), активацию апоптоза (снижение экспрессии BIRC5), вероятно, можно рассматривать в качестве патофизиологических механизмов действия МП. Выявлена взаимосвязь со степенью выраженности ответной реакции эндометрия на гормональное воздействие (секреторная трансформация или децидуоподобная реакция).



