Практика вспомогательной репродукции и проведения программ экстракорпорального оплодотворения (ЭКО) отчетливо показала, что только 40% полученных эмбрионов развиваются до стадии бластоцисты, остальные останавливаются на разных стадиях дробления [1]. Эти и ряд других аспектов, входящих в компетенцию вспомогательных репродуктивных технологий, заставляют специалистов расширять поиск исследований, способных решить эти спорные вопросы. В первую очередь становится очевидным, что большую роль в генезе бесплодия могут иметь генетические и эпигенетические факторы как самого эмбриона, так и ооцита, играющие ключевую роль в раннем преимплантационном развитии.
Качество ооцитов
Достижения в области репродуктивной медицины неоспоримо показали, что наиболее важным фактором, определяющим исход беременности и развития эмбриона, является качество ооцита. Известно, что даже при наличии большого числа полученных зрелых и, на первый взгляд, качественных ооцитов количество и качество получаемых эмбрионов могут широко варьировать. К тому же известно, что ооциты, полученные в программах ЭКО, имеют абсолютно различный потенциал дальнейшего развития. Так, только 5% ооцитов дают эмбрионы, перенос которых заканчивается живорождением [2]. Связь между качеством ооцитов и эмбрионов была подтверждена в нескольких исследованиях, которые показали, что ранние неудачи развития эмбрионов обусловлены материнскими факторами. Ряд дефектов созревания эмбрионов формируется еще до оплодотворения, в соответствующем ооците, и во многом зависит от внутриклеточных механизмов регуляции раннего фолликулогенеза.
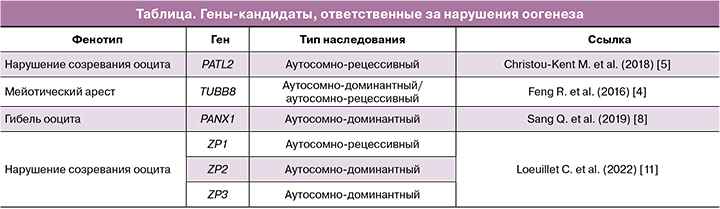
Примером предопределяющей роли ооцита в раннем развитии эмбриона является исследование Wu X. et al. (2003) [3], в котором были идентифицированы гены, названные zygote arrest 1 (Zar1 и ZAR1 у мыши и человека соответственно), специфичные для ооцитов. Они кодируют белки из 361 аминокислоты и 424 аминокислот соответственно, которые имеют 59% аминокислотную идентичность. В исследовании было показано, что, несмотря на то что Zar1-0 (Zar1(-/-)) мыши жизнеспособны и внешне нормальны, самки Zar1(-/-) бесплодны. Развитие яичников и оогенез на ранних стадиях оплодотворения, очевидно, не нарушены, но большинство эмбрионов от самок Zar1(-/-) не начинают дробиться после формирования зиготы. Сразу после оплодотворения формируются отдельные пронуклеусы, и начинается репликация ДНК; но материнский и отцовский геномы остаются раздельными в полученных зиготах. Менее 20% эмбрионов, полученных от самок Zar1(-/-), развиваются до двухклеточной стадии, и ни один эмбрион не развивается до стадии 4 клеток. Таким образом, Zar1 является первым идентифицированным геном, специфичным для ооцитов, который функционирует на стадии перехода от ооцитарного генома к эмбриональному и подтверждает значимость генетических и эпигенетических факторов в самом ооците. В работе Feng R. et al. (2016) [4] изучалась роль гена TUBB8, который может быть ответственен за остановку мейоза I в человеческих ооцитах. Экспрессия гена TUBB8 уникальна для ооцитов и раннего эмбриона тем, что на этот ген приходится большая часть экспрессируемого β-тубулина. Мутации в гене влияют на шаперон-зависимую модификацию и сборку гетеродимера α/β-тубулина, вызывают нарушения в структуре и работе микротрубочек при экспрессии в культивируемых клетках, изменяют работу микротрубочек in vivo, вызывают грубые дефекты сборки веретена деления и остановку созревания при экспрессии в ооцитах. Для идентификации механизмов формирования «поломок» в ооцитах и эмбрионах и для дальнейшего поиска методов их преодоления принципиально важным становится изучение влияния различных эпигенетических модификаций на развитие эмбриона. В работе Christou-Kent M. (2018) [5] с помощью полноэкзомного секвенирования была выявлена генетическая мутация в гене PATL2 у 26% пациенток с нарушениями созревания ооцитов. Patl2 имеет уникальный профиль экспрессии по сравнению с другими известными РНК-связывающими белками ооцитов, что указывает на специфическую функцию Patl2 в регуляции мРНК во время созревания яйцеклеток у млекопитающих. PANX1, который кодирует высокогликозилированный канальный белок, широко экспрессируется во многих тканях и органах человека, особенно в головном мозге и ооцитах [6, 7]. В 2019 г. был идентифицирован ранее не зарегистрированный фенотип под названием «гибель ооцитов» [8]. Во всех извлеченных ооцитах произошли сморщивание и потемнение цитоплазмы до или после оплодотворения, в результате чего было определено, что гетерозиготные мутации в PANX1 ответственны за данный фенотип. В случае наличия гетерозиготной мутации в гене PANX1 формируются аномальное гликозилирование и каналопатия, приводящие к женскому бесплодию. Белок ZP секретируется растущими ооцитами и играет важную роль во время размножения млекопитающих в таких механизмах, как акросомная реакция, предотвращение полиспермии и защита эмбриона [9]. Во время созревания ооцита ZP необходим для связи между ооцитом и клетками кумулюса [10]. В работе Loeuillet C. et al. (2022) был выявлен патогенный гомозиготный вариант ZP1. Все ооциты от пациентов, ассоциированных с ZP1, выглядели сморщенными и темными, что указывало на то, что аномальный белок ZP1 индуцировал гибель и дегенерацию ооцитов [11]. Информация о возможных генах-кандидатах, ответственных за нарушения оогенеза, суммирована в таблице.
Эффективные методы выявления качественных ооцитов необходимы для создания и/или отбора эмбрионов с высоким потенциалом развития, чтобы ограничить получение «избыточных» эмбрионов, внедрить процедуры контроля качества и, в конечном итоге, повысить клиническую эффективность, выраженную в повышении частоты имплантации, наступления беременности и сокращении числа многоплодных беременностей [12]. Однако критерии для отбора качественных ооцитов остаются теми же и основаны лишь на визуальной оценке зрелости ооцита, хотя с момента внедрения ЭКО для лечения бесплодия прошло уже более 20 лет. Исходя из этих данных, становится очевидна необходимость создания методов, позволяющих определить наиболее качественные и «перспективные» ооциты. На сегодняшний день принято отображать качество ооцита на основании морфологической оценки, базирующейся на определении степени их зрелости, соответствующей стадии профазы второго мейотического деления, степени зрелости кумулюсного комплекса, наличия полярного тела, отсутствия аномалий цитоплазмы и zona pellucida. Однако этих признаков недостаточно для того, чтобы наделить ооцит способностью дать полноценную беременность, что, по-видимому, делает их непригодными для установления надежных критериев отбора. Сегодня очевидно, что используемая в клинической практике морфологическая оценка качества эмбриона не может точно предсказать потенциал его развития, поскольку у большого числа эмбрионов с нормальной морфологией впоследствии либо выявляются хромосомные аномалии, и беременность прерывается, либо происходит «арест» раннего эмбриогенеза.
Приобретение потенциала ооцита – это все еще плохо изученный процесс, который разворачивается на протяжении всего оогенеза [13]. В частности, непосредственно перед овуляцией как ядерный, так и цитоплазматический компартменты вовлекаются в серию скоординированных изменений. Разрушение зародышевого пузырька, означающее возобновление мейоза, и экструзия полярного тела являются показателями такого мейоза. Полярные тела как раз и являются индикаторами таких мейотических процессов. Однако разрушение зародышевого пузырька и выделение первого полярного тела (PBI) не гарантируют, что мейотический аппарат ооцита правильно перешел в метафазу II (MII) в процессе подготовки к оплодотворению. Различные факторы, такие как неподходящие условия созревания in vitro, могут нарушить веретено и цитоскелетную организацию ооцита [14], в результате чего мейоз II, сегрегация и, возможно, иные механизмы, опосредованные веретеном деления, могут быть скомпрометированы. В то же время во время окончательного созревания в цитоплазматической среде происходят различные события, которые могут позволить ооциту поддерживать дальнейшее развитие. Ответы на эти вопросы кроются в изучении механизмов внутренних сигнальных путей, тонкой эпигенетической регуляции раннего созревания ооцитов, преимущественно в гонадотропин-независимую фазу.
Альтернативные методы определения качества ооцита
Известно, что хромосомы полярного тельца имеют такой же генетический потенциал, как и их сестринские хромосомы, остающиеся в ооците, и это подтверждается данными о том, что полярные тельца могут генерировать функциональные человеческие ооциты. Таким образом, биопсия 1-го полярного тельца может быть использована для определения генетического статуса соответствующего ооцита. В исследованиях Rienzi L. et al. (2003) [15]; Verlinsky Y. et al. (2003) [16]; Zhou W. et al. (2016) [17] в качестве параметра оценки потенциала развития соответствующих ооцитов и эмбрионов была изучена морфология первого полярного тела; однако полученные выводы были противоречивыми, что говорит о том, что эта оценка не является надежным предиктором развития. В работе, проведенной Yuan P. et al. (2021) [18], исследователями был оценен метилом PBI и соответствующего ооцита (MII) с целью определения влияния потенциальных эпигенетических аберраций на возможности развития ооцитов и эмбрионов. Исследователи предполагают, что исследование основных паттернов эпигенетических модификаций посредством анализа метилома полярного тела и сиблингового ооцита имеет потенциал для определения возможного вектора имплантационного развития.
В работе Zhou W. et al. (2016) [17] было высказано предположение, что морфология PBI отражает компетентность ооцитов, а именно, ооциты с интактным нормальным размером PBI были описаны, как дающие эмбрионы высокого качества, более высокий «выход» бластоцист, но не увеличивающие частоту наступления беременности и имплантации. В других исследованиях было установлено, что морфология PBI не связана с частотой оплодотворения, качеством эмбрионов и формированием бластоцисты. В проспективном анализе прогностическая ценность оценки морфологического качества PBI была исследована путем сравнения компетенции ооцитов, оплодотворенных методом интрацитоплазматической инъекции сперматозоида и демонстрирующих различную морфологию PBI, классифицированных в соответствии со следующими характеристиками: нормальный размер и гладкая поверхность (I), фрагментированные (II), с шероховатой поверхностью (III), или большой размер (IV). Не было обнаружено существенных различий между различными группами. Доля эмбрионов высокого качества (класс А) также была сопоставима между группами I–III (14, 12 и 17% соответственно), в то время как низкое количество эмбрионов класса А в группе IV (два эмбриона) не позволило провести сравнение с другими группами. Таким образом, полученные данные не позволяют предположить, что оценка PBI может способствовать выявлению эмбрионов с высокой способностью к развитию. На основании того, что экструзия PBI знаменует собой важный переход в приобретении мейотической компетентности, различные авторы рассматривали возможность того, что морфология этой структуры может выражать, по крайней мере частично, компетентность ооцита. Eichenlaub-Ritter U. et al. (1995) [19] впервые предположили, что высокая фрагментация PBI может отражать постовуляторное старение ооцита. Возможная связь между морфологией PBI и качеством ооцита также подтверждается исследованиями, проведенными на мышах, в которых генетически модифицированные бесплодные самки производят ооциты с аномально большими PBI [20]. В серии исследований Ebner T. et al. (2000) расширили гипотезу о корреляции между морфологией PBI и качеством ооцитов, описав, что PBI без признаков фрагментации, с гладкой поверхностью и нормального размера, представляет собой прогностический фактор для успешного оплодотворения и высокого качества эмбрионов [21], способности развиваться до бластоцисты [22] и увеличения числа имплантаций [22, 23]. Другие авторы оспаривают эти исследования. В частности, Verlinsky Y. et al. (2003) [16] не обнаружили никакой корреляции между морфологией PBI и частотой оплодотворения, средним числом бластомеров, количеством бластомеров у эмбрионов второго дня жизни и частотой бластоцист. В последнее время Ciotti P.N. et al. (2004) [24] подвергли дальнейшему сомнению доказательства, полученные Ebner T., сообщив, что качество эмбрионов и клинический исход лечения не связаны с фрагментацией PBI.
Еще одним альтернативным методом оценки качества ооцита является анализ веретена деления метафазы II (MII).
В исследовании Yao J. et al. (2022) [25], основываясь на факте значимости апоптоза в кумулюсных клетках, был проанализирован уровень экспрессии гена PTEN в клетках кумулюса для изучения его связи с компетентностью развития эмбриона в циклах ЭКО. PTEN (гомолог фосфатазы и тензина) – хорошо известный ген-супрессор опухоли, который функционирует как медиатор апоптоза и имеет решающее значение в репродукции млекопитающих. Данные показали, что уровень мРНК PTEN был значительно снижен в кумулюсных клетках, окружающих зрелые ооциты, по сравнению с незрелыми. Аналогичные изменения были обнаружены при анализе оплодотворения и формирования бластоцисты. Предположение о том, что измерение уровня мРНК PTEN в кумулюсных клетках человека может стать полезным инструментом для отбора ооцитов с большими шансами на имплантацию, как и проапоптотический механизм PTEN в репродукции человека, безусловно, нуждается в дальнейшем изучении.
Из вышеприведенных фактов следует, что основные существующие в настоящее время методы оценки качества ооцита и диагностики генетических аномалий не способны в полной мере определить качество и компетентность ооцита и описать дальнейшую траекторию развития эмбриона, из чего следует предполагать, что существует множество иных факторов, в первую очередь таких, как эпигенетические модификации, которые, несомненно, необходимо изучать и принимать во внимание при оценке возможностей развития эмбриона.
«Арест» раннего эмбриогенеза
Все большее внимание привлекает так называемый феномен «ареста раннего эмбриогенеза», при котором эмбрионы останавливаются в своем развитии на ранних стадиях. Ряд авторов считают, что это явление наиболее часто наблюдается при бесплодии неясного генеза [26]. В зависимости от стадии, на которой отмечается остановка эмбриона, можно наблюдать неспособность зиготы начать процесс дробления, остановку самого дробления на 2-й или 3-й день, т.е. на стадии от двух- до восьмиклеточного эмбриона, неспособность сформировать морулу и, впоследствии, бластоцисту. Было предложено несколько клеточных механизмов для объяснения этой остановки, в частности: неудачная активация зиготического генома (ZGA), задержка торможения экспрессии материнской РНК, оксидативный стресс, анеуплоидия [27]. Представленные публикации в основном анализируют возможные причины остановки развития эмбриона на разных стадиях дробления.
Так, в метаанализе 2021 г. Sfakianoudis K. et al. (2021) [28] было проанализировано 76 исследований, связанных с изучением генеза этого явления, а также обобщены данные о молекулярных факторах остановки развития эмбрионов на различных стадиях. Было показано, что остановка развития эмбриона – это многофакторное явление, зависящее от внутренних и внешних параметров. При исследовании причинно-следственных связей, определяющих остановку развития, оказалось, что ее причинами являются материнские и/или отцовские факторы, активность эмбрионального метаболизма, нарушение важнейших молекулярных путей, останавливающих процесс развития, генетические аномалии или лабораторные условия. Выявленные эмбриональные факторы, связанные с арестом, включали вариации генов, число копий митохондриальной ДНК, характер метилирования, хромосомные аномалии, метаболический профиль и морфологические особенности, а родительские факторы включали вариации генов, уровни экспрессии белков и этиологию бесплодия. Несмотря на обширный анализ данных литературы, проведенный авторами, не удалось установить какие-либо конкретные причины остановки развития эмбриона. Все перечисленные факторы потенциально могут участвовать в этом процессе, но каким образом и как, пока не ясно, учитывая разнообразие и гетерогенность причин остановки раннего эмбриогенеза, а также их неизбежные взаимосвязи.
Наиболее очевидный механизм формирования неоднократных остановок эмбрионов в дроблении ассоциирован с отрицательной естественной селекцией бластоцист с анеуплоидиями [29]. Анеуплоидии в первые сутки дробления имеют отчетливую связь с арестом эмбриогенеза в периоде активации эмбрионального генома (EGA) [29]. Сам процесс активации собственного генома эмбриона находится под контролем 2 основных генов, а именно DUX и LEUTX [30, 31]. Генетический анализ биоптатов эмбрионов методом FISH, остановившихся в развитии на 2–3-и сутки дробления, выявил аномальный кариотип у 2/3 из них. Хромосомные аномалии включали в себя анеуплоидии, полиплоидии, гаплоидии, мозаицизм и хаотичный хромосомный набор. Таким образом, исследователи считают наличие хромосомных аномалий ведущей причиной формирования нарушений ранних этапов эмбриогенеза [29]. Хромосомные аномалии эмбриона не всегда наследуются из ооцита или сперматозоида, но могут возникать и вследствие митотических ошибок при дроблении самого эмбриона, в том числе из-за негативного воздействия внешних факторов. [32]. Необходимо отметить, что частота формирования митотических ошибок не ассоциирована с материнским и отцовским возрастом [33]. Исследование, проводимое методом single cell анализа, показало наличие хромосомной нестабильности примерно у 70–80% человеческих эмбрионов, полученных в программах ЭКО на стадии дробления [34, 35]. Слияние бластомеров или дефекты цитокинеза являются возможным механизмом геномной нестабильности у значительного числа эмбрионов [34]. Более того, сохранение ДНК второго полярного тела до бластоцисты [36] – еще одна неоцененная причина геномной нестабильности. В целом анеуплоидия у преимплантационных эмбрионов может быть обусловлена как мейотическими, так и митотическими ошибками.
Оценка качества эмбрионов
На современном этапе методы оценки качества получаемых эмбрионов основываются на морфологических критериях и классифицируются в соответствии с общепринятыми критериями Гарднера. Однако морфологическая оценка, базирующаяся в основном на визуальном определении степени их компетентности, не всегда коррелирует с их способностью к имплантации и развитию полноценной беременности, поскольку у большого числа эмбрионов с нормальной морфологией впоследствии либо выявляются хромосомные аномалии и беременность прерывается, либо происходит остановка дробления эмбриона.
Метод преимплантационного генетического тестирования, широко используемый для определения качества эмбриона, основан на том, что наиболее распространенными причинами остановки эмбрионов в развитии и, как следствие, прерывания беременности являются анеуплоидии. В большинстве случаев они возникают в результате ошибок, происходящих в процессе мейоза I в материнской клетке. Несомненным плюсом выполнения преимплантационного генетического тестирования является возможность предотвращения рождения детей с генетическими заболеваниями, в том числе моногенными. Но единичная биопсия трофэктодермы на стадии бластоцисты по естественным биологическим причинам никогда не может определить окончательный хромосомный статус и судьбу эмбриона с достаточной клинической точностью. Также генетический скрининг только на наличие анеуплоидий не может полностью гарантировать хорошее качество развития эмбриона. Признавая несомненную значимость преимплантационного генетического тестирования на анеуплоидии для клинической практики, некоторые специалисты призывают применять его с осторожностью в случаях отсутствия весомых показаний. Инвазивность метода, а также способность эмбриона корректировать имеющиеся и приобретать новые ошибки в течение первых суток преимплантационного развития могут приводить к недостоверности полученных результатов, что, в свою очередь, создает проблему для клиницистов, вынужденных определять судьбу мозаичных эмбрионов.
Молекулярные пути, вовлеченные в формирование анеуплоидных эмбрионов
В поддержании целостности генома участвуют несколько молекулярных путей, среди которых путь ответа на повреждение ДНК и пути, контролирующие эмбриональное развитие, такие как Wnt MAPK и Hippo [37]. Дизрегуляция этих путей может быть причастна к формированию анеуплоидии и, следовательно, к остановкам эмбрионального развития. Среди дифференциально экспрессируемых генов у анеуплоидных эмбрионов отмечают гены, контролирующие процесс митоза, такие как BUB1, BUB3, PTTG1 и TP53 [38]. Эти данные указывают на наличие сходных путей индукции анеуплоидии в эмбрионе и в раковых клетках. Тем не менее наличие у эмбриона отличного от соматических клеток механизма обработки повреждений ДНК требует проведения исследований для раскрытия эффектов индукции ответа на повреждения ДНК в раннем эмбриогенезе [37]. Также существует ряд работ, подтверждающих ключевую роль генов пути Wnt в регуляции раннего оо- и эмбриогенеза. Так, подавление активности гена GSK-3 приводит к аномальной сегрегации хроматина [39].
Axin-1, негативный регулятор пути Wnt, играет решающую роль в организации веретена деления и регуляции клеточного цикла во время мейотического созревания ооцитов, что доказано на животных моделях. ERK-MAPK играет важную роль в раннем дроблении эмбриональных клеток до стадии компактизации [40].
Пластичность эмбрионов на ранних этапах преимплантационного развития
Известно, что эмбрионы на ранних стадиях своего преимплантационного развития проявляют удивительную пластичность и способность адаптироваться к факторам окружающей среды. Однако, как отмечают некоторые исследователи, именно эти приспособительные механизмы могут привести к остановке развития или к значительному снижению качества эмбрионов. На стадиях постимплантационного развития также происходит ряд эпигенетических изменений, которые впоследствии могут иметь отголоски уже в зрелом возрасте потомства. Именно на данном факте основана теория происхождения здоровья и болезней (DOHaD) [41].
Согласно данной теории, негативные факторы окружающей среды при воздействии на ранних эмбриональных этапах способствуют формированию предрасположенности организма к развитию множества заболеваний, манифестирующих в зрелом возрасте [42].
Greco E. et al. показали возможность достижения нормальной прогрессирующей беременности после переноса мозаичных эмбрионов [43]. Исследователи в дальнейших работах пришли к выводу, что ключевым моментом является наличие минимального достаточного количества эуплоидных клеток в эпибласте [44]. Перечисленные сведения подчеркивают необходимость исследования более тонких механизмов эмбрионального развития, которые остаются вне компетенции широко используемой преимплантационной генетической диагностики.
Активация генома эмбрионов
В работе Eckersley-Maslin M.A. et al. (2018) [45] приведены данные о том, что вскоре после оплодотворения происходит процесс эпигенетического ремоделирования, восстанавливающий тотипотентность зиготы и включающий в себя вышеописанные изменения. Ключевым моментом этих изменений является переход от материнской программы ооцита к управляемой эмбрионом программе развития – процесс, называемый переходом от матери к зиготе (MZT). Активация генома зиготы происходит преимущественно на двухклеточной стадии у мышей и на восьмиклеточной стадии у человека, однако динамика ее контроля до сих пор остается неясной. Экспрессия генов зиготы во время MZT обеспечивает эмбрион теми факторами, которых ему недостает от материнского генома. В определенной степени эти гены кодируют транскрипционные факторы и компоненты сигнальных путей, которые готовят эмбрион к гаструляции, спецификации и дифференцировке. В ходе MZT развивающийся эмбрион получает часть эпигенома от материнской гаметы, а следовательно, получает и часть его поломок в ходе дальнейшего развития, количество которых определяется качеством ооцита. Предположительно, по причине минимальных накоплений эпигенетических поломок в процессе MZT, а также более высокой пластичности эмбриона частота наступления беременности в группе пар с так называемым бесплодием «неясного генеза» выше при осуществлении переноса эмбриона на стадии зиготы. Из этого следует вывод о том, что именно качество генома и эпигенома ооцита определяет возможность развития эмбриона и наступление беременности, а это означает, что необходимо изучать и отыскивать новые методики определения характеристик ооцита опосредованно через его эпигенетические паттерны. Не вполне ясными являются процессы, обеспечивающие развитие зиготы после оплодотворения, определение внутренних факторов, а именно способности самого эмбриона развиваться и возможного влияния внешних факторов, когда его развитие происходит вне организма.
После этапа оплодотворения следует сложный этап перепрограммирования, обеспечивающего переход дифференцированной половой клетки в тотипотентное состояние. Теоретически, любое критическое воздействие на этапах от оплодотворения до имплантации может привести к остановке эмбриогенеза. В течение этого периода ооцит проходит несколько этапов митотического деления. Данный процесс сопровождается 3 ключевыми транскрипционными и морфогенетическими изменениями, которые являются основополагающими для обеспечения дальнейшего развития эмбриона и имплантации. Этими процессами являются активация зиготического генома, компактизация эмбриона и формирование бластомеров.
Транскриптомный анализ преимплантационного эмбриона показал снижение уровня транскрипционной активности при остановке дробления эмбрионов. В дальнейшем была сформирована математическая модель на основании оценки трех неинвазивных методов визуализации, показавшая, что судьба эмбриона предрешается до активации его собственного генома [46]. Успешность дробления эмбриона на данном этапе зависит от многочисленных факторов соответствующего ооцита, таких как микро-РНК, белки, участвующие в регуляции апоптоза, и факторы транскрипции белков теплового шока. Для идентификации этих механизмов формирования «поломок» в ооцитах и эмбрионах и для дальнейшего поиска их преодоления принципиально важным становится изучение влияния различных эпигенетических модификаций на развитие эмбриона.
Заключение
Наше понимание различных уровней регуляции раннего гаметогенеза и эмбриогенеза крайне недостаточно. Распространенное в жизни, в практической медицине, понятие причины как чего-то отдельного является абсолютно неприменимым к таким сложным комплексным процессам, как преимплантационное развитие эмбриона. При этом поиск возможных механизмов развития такого явления, как остановка раннего эмбриогенеза, представляет собой одну из самых интересных задач репродуктивной медицины.



