По данным Всемирной организации здравоохранения (ВОЗ) ежегодно во всем мире регистрируется около 15 млн преждевременных родов, что составляет более 10% детей, рожденных во всех странах мира [1]. В течение последних десятилетий отмечается стойкая тенденция к увеличению выживаемости глубоконедоношенных детей с экстремально низкой массой тела (ЭНМТ) и очень низкой массой тела (ОНМТ) при рождении (85 и 100% соответственно), что в первую очередь связано с совершенствованием всех этапов неонатальной медицинской помощи, улучшением работы медицинского персонала в отделениях реанимации и интенсивной терапии [2–4].
Неонатальные судороги являются наиболее распространенным неврологическим нарушением у новорожденных, причем у недоношенных детей они встречаются чаще, чем у доношенных [5, 6]. Частота неонатальных судорог у недоношенных детей широко варьирует и по данным разных авторов составляет от 5,7 до 14,7% [7].
Неонатальные судороги достоверно связаны с формированием неблагоприятного неврологического исхода у недоношенных детей [8, 9]. Согласно данным ряда исследований, эпилепсия в первые три года жизни развивается у 1,7% детей, рожденных с ОНМТ [5]. Сходные результаты были получены и в других исследованиях [6, 10, 11]. При рождении детей с ЭНМТ риск возникновения эпилепсии в возрасте до 7 лет возрастает до 8,6% [12].
Согласно данным литературы, более 65% неонатальных судорог могут быть пропущены в виду их субклинического течения, в связи с чем необходимо проведение длительного электроэнцефалографического (ЭЭГ) мониторинга всем детям с подозрением на наличие судорожных пароксизмов; однако в настоящее время данный метод не получил широкого распространения в неонатальных отделениях в России и странах Европы [13, 14].
По данным ряда авторов, недоношенность является одним из ведущих факторов риска развития структурной эпилепсии, однако это утверждение остается недостаточно изученным и требует проведения дальнейших клинических исследований [15].
Цель исследования: Оценка частоты неонатальных судорог и их трансформации в структурную эпилепсию у детей с ЭНМТ и ОНМТ при рождении.
Материалы и методы
На базе Института неонатологии и педиатрии ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России был проведен ретроспективный анализ медицинской документации 297 пациентов, родившихся на сроке гестации от 25 до 32 недель, с массой тела менее 1499 г (450–1499 г), длиной тела 31–41 см, с оценкой по шкале Апгар 2–7 баллов на 1-й минуте и 4–7 баллов – на 5-й минуте.
Критериями исключения являлись масса тела при рождении 1500 и более г, гестационный возраст более 32 недель, врожденные пороки развития головного мозга, верифицированная синдромальная патология, наличие судорожного синдрома, обусловленного метаболическими нарушениями.
Исследование было одобрено Этическим комитетом ФГБУ НМИЦ АГП им. В.И. Кулакова (Протокол №5, 27.05.2021).
Состояние всех детей при рождении было тяжелым, лечение проводилось в отделении реанимации и интенсивной терапии новорожденных (ОРИТН) и в отделении патологии новорожденных и недоношенных детей (ОПНиНД).
Основные патологические состояния, диагностированные в неонатальном периоде, представлены в таблице 1.
В ОРИТН и ОПНиНД в динамике всем детям проводилась оценка неврологического статуса и нейросонография (НСГ). По показаниям проводились: амплитудно-интегрированная электроэнцефалография (аЭЭГ) (n=246), многоканальная электроэнцефалография (ЭЭГ) (n=246), магнитно-резонансная томография (МРТ) головного мозга (n=167). Показанием для проведения ЭЭГ-исследований являлось подозрение на неонатальные судороги, апноэ недоношенных, тяжелая асфиксия при рождении, острое нарушение мозгового кровообращения, срок гестации 28 и менее недель; МРТ назначалась при выявлении по данным НСГ внутрижелудочковых кровоизлияний 2б и 3 степени, острого нарушения мозгового кровообращения и подозрения на порок развития головного мозга, тяжелая асфиксия при рождении.
Оценка неврологического статуса в неонатальном периоде включала в себя стандартный неврологический осмотр с оценкой общемозговой, менингеальной, очаговой симптоматики и безусловно-рефлекторной деятельности.
аЭЭГ проводилась в динамике на аппаратах Olympic CFM 6000, Natus Olympic Brainz Monitor c использованием 5-канальной записи, с наложением электродов на центральные и теменные области с двух сторон; длительность исследования составила не менее 12 часов.
Многоканальная ЭЭГ проводилась всем пациентам в динамике на аппарате «Энцефалан-ЭЭГР-19/26» с использованием модифицированной международной схемы «10–20» с уменьшенным количеством электродов (Gibs F., Gibs E., 1950). Электроды располагали в отведениях Fp1, Fp2, F3, F4, C3, C4, P3, P4, O1, O2, T5, T6, Fz, Cz. Регистрация проводилась в монополярном отведении с референтными ушными электродами, параллельно регистрировали ЭКГ во 2 стандартном отведении. Качество наложения электродов контролировали импедансметрией, сопротивление не превышало 10 кОм. Продолжительность исследования составляла не менее 1 ч. Оценка ЭЭГ проводилась по следующим критериям: соответствие биоэлектрической активности головного мозга возрастной норме согласно гестационному возрасту, наличие или отсутствие эпилептиформной активности иктальной и/или интериктальной.
После выписки из стационара пациенты с неонатальными судорогами находились под дальнейшим динамическим амбулаторным наблюдением. Все дети осмотрены неврологом в скорректированном возрасте 2, 4, 6, 9, 12, 18, 24 и 36 месяцев, ЭЭГ в динамике проведена в скорректированном возрасте 2, 6, 9, 12, 18, 24 и 36 месяцев. Контрольной точкой для оценки раннего неврологического исхода выбран возраст 36 скорректированных месяцев, проанализированы данные ЭЭГ, наличие или отсутствие клинических приступов судорожного синдрома, потребность в противоэпилептической терапии.
Статистический анализ
Для статистического анализа использован пакет статистических программ GraphPad Prism (GraphPad Software, США).
Результаты
При обследовании в неонатальном периоде у большей части пациентов диагностированы нарушения неврологического статуса, наиболее часто выявляемыми были синдром угнетения и синдром двигательных нарушений (табл. 2).
Среди всех обследованных детей у 29 пациентов (9,8%) были диагностированы неонатальные судороги (возраст дебюта составил 3–13 суток жизни). Диагноз неонатальные судороги устанавливался на основании наличия клинических проявлений эпилептических пароксизмов вне зависимости от полученных по данным ЭЭГ-исследований результатов. Морфология неонатальных судорог представлена в таблице 3. У большинства детей отмечалось сочетание различных видов судорожных пароксизмов, чаще выявлялись клонические фокальные и субтильные приступы.
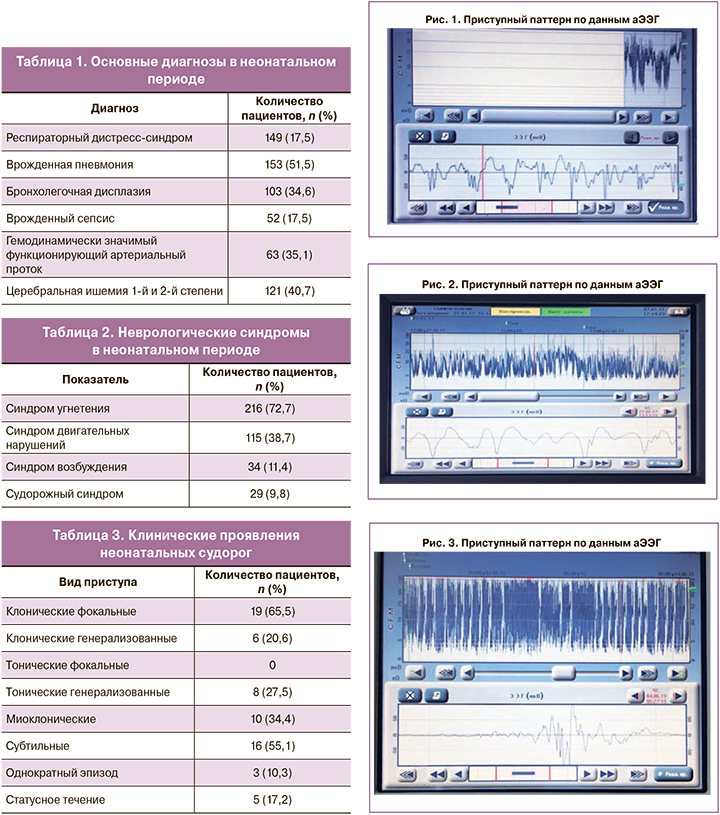
аЭЭГ в неонатальном периоде по показаниям проведена 246 пациентам (82,8%), из них у 230 пациентов (93,5%) не зарегистрированы паттерны, соответствующие иктальной эпилептиформной активности. Среди всех пациентов (n=29) с клиническими проявлениями судорожного синдрома приступный паттерн по данным аЭЭГ зарегистрирован у 16 пациентов (55%) (рис. 1–3).
Многоканальная ЭЭГ в неонатальном периоде проведена по показаниям 246 пациентам (82,8%). Среди обследованных пациентов по результатам ЭЭГ эпилептиформная активность зарегистрирована у 20 пациентов (8,1%), у 226 пациентов (91,9%) биоэлектрическая активность головного мозга соответствовала возрастной норме согласно сроку гестации. Среди всех пациентов с неонатальными судорогами (n=29) эпилептиформная активность зарегистрирована у 20 пациентов (68,9%), у 9 детей (31,1%) по данным ЭЭГ-исследований эпилептиформная активность не выявлена (табл. 4)
Таким образом, при анализе результатов аЭЭГ и многоканальной ЭЭГ нами было установлено, что у 4 детей с клиническими проявлениями неонатальных судорог, сопровождавшимися эпилептиформной активностью по данным ЭЭГ, по результатам аЭЭГ патологические виды активности не регистрировались.
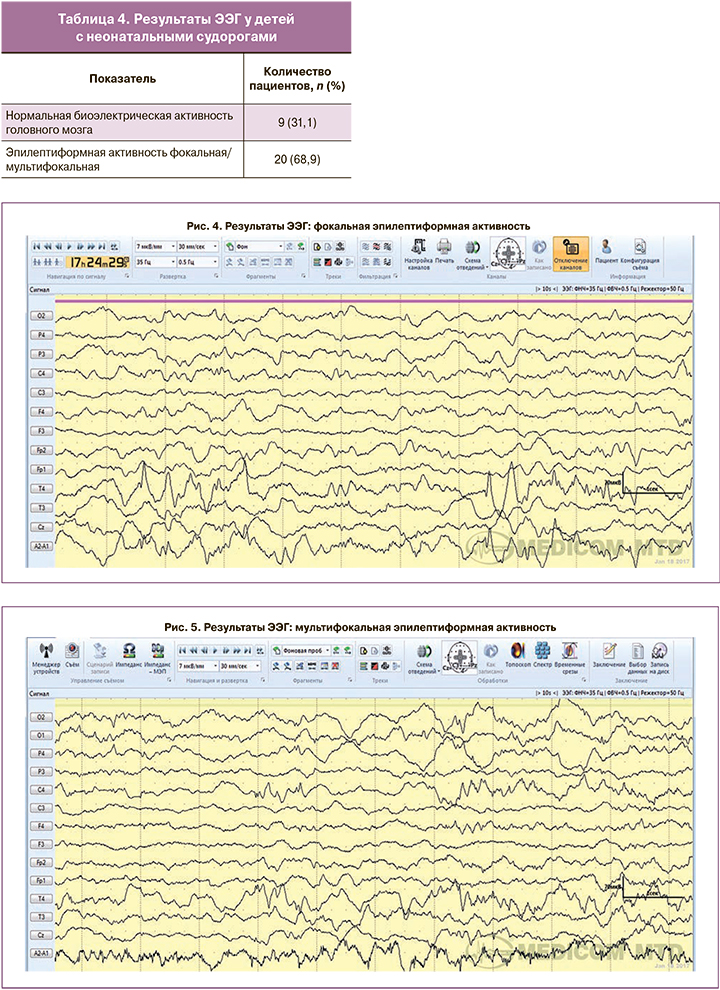
Эпилептиформная активность, выявленная по результатам ЭЭГ, была представлена преимущественно фокальной (рис. 4) и мультифокальной эпилептиформной активностью (рис. 5, 6).
Среди всех детей с клиническими проявлениями неонатальных судорог (n=29) противоэпилептическая терапия проводилась 26 пациентам (89,7%). Показаниями для назначения терапии являлись повторные эпизоды неонатальных судорог и наличие эпилептиформной активности по данным ЭЭГ у детей с однократным судорожным эпизодом. Противоэпилептическая терапия не проводилась 3 пациентам (10,3%) с однократными эпизодами неонатальных судорог, не сопровождавшимися патологическими изменениями по данным ЭЭГ (табл. 5).
По результатам динамического наблюдения установлено, что на фоне проводимой терапии у всех пациентов с неонатальными судорогами отмечалось купирование клинических проявлений судорожного синдрома в неонатальном периоде. По результатам повторных ЭЭГ в неонатальном периоде на фоне проводимой терапии у 18 пациентов с неонатальными судорогами (62%) зарегистрирована нормальная биоэлектрическая активность головного мозга, что позволило отменить противосудорожную терапию в стационаре; у 11 пациентов (38%) сохранялась патологическая активность в виде фокальной/мультифокальной эпилептиформной активности, в связи с чем назначенная противоэпилептическая терапия была продолжена.
После выписки из стационара дети с неонатальными судорогами продолжали динамически наблюдаться неврологом, проводились повторные ЭЭГ. На фоне проводимой противоэпилептической терапии у 6 пациентов с неонатальными судорогами отмечалась нормализация биоэлектрической активности головного мозга по результатам повторных ЭЭГ-исследований к 6 скорректированным месяцам, что в совокупности с отсутствием клинических проявлений судорожных пароксизмов явилось показанием для отмены противоэпилептической терапии. У 4 детей, несмотря на проводимую терапию, по данным ЭЭГ сохранялась фокальная эпилептиформная активность без клинических проявлений судорожного синдрома; у 1 ребенка отмечалось развитие повторных эпилептических пароксизмов в скорректированном возрасте 9 месяцев, сопровождавшееся появлением по данным ЭЭГ мультифокальной эпилептиформной активности, что потребовало коррекции противоэпилептической терапии. Данным 5 пациентам был выставлен диагноз: Структурная эпилепсия; противоэпилептическая терапия была продолжена под динамическим наблюдением невролога и контролем ЭЭГ. Установлено, что у всех пациентов с диагностированной структурной эпилепсией в неонатальном периоде имело место статусное течение судорог.
В возрасте 3 лет из 29 детей с неонатальными судорогами у 24 пациентов (82,7%) клинические и ЭЭГ-признаки судорожного синдрома отсутствовали, противоэпилептическая терапия не проводилась. У 5 пациентов (17,3%) по данным ЭЭГ сохранялись изменения в виде задержки формирования корковых ритмов, эпилептиформной активности с низким индексом представленности, что явилось показанием для продолжения проводимой противоэпилептической терапии.
Обсуждение
В нашем исследовании, включавшем глубоко недоношенных детей с ЭНМТ и ОНМТ при рождении, неонатальные судороги диагностированы у 9,8% обследованных детей, что сопоставимо с данными современных научных исследований, согласно которым частота выявляемости неонатальных судорог у недоношенных детей составляет 5,7–14,7% [7]. Она увеличивается по мере снижения гестационного возраста и массы тела при рождении и составляет 3,4–12,7% среди недоношенных, рожденных с массой тела менее 1500 г и 5,5–8,5% среди недоношенных, рожденных на сроке гестации 30 и менее недель [7].
В нашем исследовании возраст дебюта неонатальных судорог составил 3–13 суток жизни, что совпадает с результатами зарубежных авторов. Так, по данным Pisani F., до 90% неонатальных судорог у доношенных детей дебютируют в первые сутки жизни, тогда как для глубоконедоношенных детей, рожденных на сроке гестации 28 и менее недель, характерен относительно более поздний дебют неонатальных судорог, что, вероятнее всего, является отражением нейрофизиологического созревания головного мозга недоношенного ребенка [16]. Особенности течения неонатальных судорог у глубоко недоношенных детей, вероятнее всего, связаны с такими физиологическими особенностями головного мозга, как незавершенность синаптогенеза и формирования нейронального слоя коры, незавершенность и недостаточность миелинизации церебральных структур, недостаточное развитие межполушарных связей, относительно сформированная лимбическая система и ее связи со стволовыми структурами [17, 18].
Из-за нейрофизиологической незрелости все новорожденные дети, особенно недоношенные, составляют группу риска по возникновению субклинических эпилептических приступов и неправильному трактованию лечащим врачом клинических пароксизмов в связи с фрагментарностью и атипичностью судорог [19–21]. Эквивалентами судорожных пароксизмов в неонатальном периоде могут быть такие двигательные феномены, как: сосание, жевание, высовывание языка, движения глазных яблок, педалирующие движения ногами, гребущие движения руками, сокращение диафрагмы, апноэ и др. В нашем наблюдении субклинические эпилептические приступы у пациентов не зарегистрированы, однако у 55,1% детей отмечались пароксизмы субтильных приступов, эпилептический генез которых был подтвержден результатами аЭЭГ и ЭЭГ.
Морфология приступов у обследованных нами детей была представлена следующими видами приступов: клонические фокальные и генерализованные, тонические генерализованные, миоклонические, субтильные; у 17,2% детей течение судорожных приступов носило статусный характер. Полученные результаты совпадают с данными Международной противоэпилептической лиги о виде неонатальных приступов [22].
Всем детям с подозрением на неонатальные судороги рекомендовано проведение ЭЭГ, так как, помимо подтверждения диагноза, результаты ЭЭГ могут указать на возможную этиологию пароксизмов, оценить эффективность терапии и быть прогностическим предиктором возможных исходов заболевания [23, 24]. Выявление эпилептиформной активности по данным ЭЭГ у новорожденных является непростой задачей в связи с тем, что в некоторых случаях очень сложно отличить физиологические транзиторные острые волны от патологических видов активности [25]. В настоящее время аЭЭГ является рутинным методом нейрофизиологической диагностики, используемым в ОРИТН и обладающим высокой чувствительностью и специфичностью в диагностике пароксизмальных состояний у новорожденных детей [26]. Однако, несмотря на широкое использование аЭЭГ, во всех случаях выявления неонатальных судорог требуется проведение длительной ЭЭГ для подтверждения диагноза. В нашем исследовании эпилептиформная активность по данным аЭЭГ была зарегистрирована у 6,5% обследованных детей, по данным ЭЭГ – у 8,1% обследованных пациентов, что, на наш взгляд, является проявлением большей чувствительности ЭЭГ в диагностике патологических видов активности в сравнении с аЭЭГ.
В нашем наблюдении структурная эпилепсия диагностирована у 17,3% детей с неонатальными судорогами, что совпадает с данными отечественных авторов, согласно которым частота развития структурной эпилепсии у детей с неонатальными судорогами в группах различного гестационного возраста составляет 18–25% [27]. У всех детей со структурной эпилепсией в неонатальном периоде отмечалось статусное течение судорог, что, на наш взгляд, является отражением повреждающего воздействия длительных и повторных эпилептических приступов на незрелый мозг недоношенного новорожденного.
Заключение
Неонатальные судороги диагностированы у 9,8% детей с ЭНМТ и ОНМТ при рождении.
Морфология приступов представлена клоническими фокальными, клоническими генерализованными, тоническими генерализованными, миоклоническими и субтильными судорогами.
На фоне проводимой противоэпилептической терапии у большинства детей отмечалось купирование судорожных приступов в неонатальном периоде.
ЭЭГ обладает большей чувствительностью в выявлении эпилептиформной активности в сравнении с аЭЭГ.
У детей со статусным течением неонатальных судорог диагностирована структурная эпилепсия, потребовавшая проведения противосудорожной терапии длительностью более 3 лет.
Представленные данные показывают важность комплексного неврологического обследования и динамического наблюдения в неонатальном периоде с целью своевременного выявления неонатальных судорог и коррекции проводимой противоэпилептической терапии.



