Нарушения ритма и проводимости сердца плода выявляются в 1–5% беременностей [1]. Более чем в 90% случаев аритмии являются кратковременными и изолированными событиями, не имеющими большого клинического значения. Однако около 10% всех аритмий являются потенциально опасными для жизни плода [2]. Cтойкие фетальные аритмии способствуют замедлению роста и развития плода, являются причиной развития сердечной недостаточности и водянки плода, могут иметь плохой прогноз и даже привести к гибели плода [1, 3]. Для таких аритмий дородовая диагностика с возможностью пренатального, перинатального и неонатального вмешательства может иметь решающее значение для постнатального прогноза.
Механизмы аритмий
Механизмы нарушения ритма сердца можно в широком смысле разделить на аномалии генерации и аномалии распространении электрических импульсов.
Нарушения ритма, источником которых является синусовый узел (СА-узел), – это аритмии, при которых СА-узел срабатывает с необычно быстрой или медленной скоростью, – синусовые тахи- или брадиаритмии.
Эктопические сердечные ритмы (экстрасистолы) возникают, когда доминирующий водитель ритма смещается от СА-узла к скрытому водителю ритма. Это может произойти при условии, если частота сокращений клеток СА-узла уменьшается до уровня, меньшего, чем внутренняя частота клеток-пейсмекеров вне синусового узла; либо внутренняя частота водителя ритма второго уровня увеличивается до уровня, превышающего нормальную частоту синусовых сокращений (предсердная эктопическая тахикардия, желудочковая тахикардия); либо синусовый ритм не проходит через атриовентрикулярный (АВ) узел, и тогда частота сокращений желудочков будет обусловлена особенностями центров автоматизма 2-го порядка (клетки АВ-узла) и/или 3-го порядка (ножки и ветви пучка Гиса), способных работать в более медленном ритме.
Аномальное повторное распространение импульса – это распространение импульса через ткань миокарда, уже активированную тем же импульсом в круговом движении. Повторный вход (re-entry) является основным механизмом большинства типов фетальных тахиаритмий, включая трепетание предсердий и AВ реципрокную (re-entry) тахикардию. Трепетание предсердий поддерживается макро-re-entry цепью, которая ограничена только миокардом предсердий. При микро-re-entry циркуляция импульса происходит по функциональным путям, включающим в себя дополнительные пути проведения, по типу «ведущего круга», в котором импульс продолжает циркулировать, возбуждая ткани, находящиеся в относительном рефрактерном периоде [4, 5].
С другой стороны, непроводимость импульса возникает, когда он поступает в невозбуждаемую ткань. Это может быть ткань, которая все еще рефрактерна после недавней деполяризации, например, заблокированное преждевременное сокращение предсердий, либо аномальная ткань, которая не может проводить импульс, например, фиброз АВ-узла при блокаде сердца [6].
Классификация аритмий
Существует 3 основных категории аритмий плода [7]:
- нерегулярный ритм с нормальной частотой сердечных сокращений плода (ЧСС) как следствие преждевременных сокращений или аномалий проводимости;
- тахиаритмии, определяемые как ЧСС>180 уд./мин в течение более 10 минут;
- брадиаритмии, определяемые как ЧСС<110 уд./мин в течение более 10 минут.
Нерегулярные ритмы
Нерегулярные ритмы из-за эктопических сокращений являются наиболее распространенным типом аритмий плода и чаще наблюдаются в III триместре. Примерно 90% всех аритмий составляют экстрасистолы предсердного, узлового или желудочкового происхождения [8] (рис. 1).
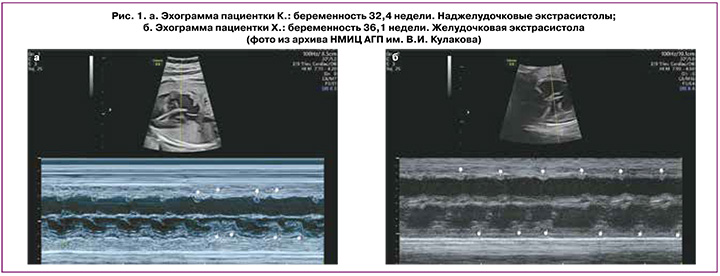
Экстрасистолия (эктопические сокращения) – это опережающее по времени, преждевременное по отношению к основному ритму сокращение всего сердца или какого-либо его отдела (предсердий или желудочков), вызванное эктопическим импульсом, возникающим вне СА-узла.
Предсердные экстрасистолы вызываются ранней активацией предсердного миокарда импульсом, генерируемым эктопическим очагом. Желудочковые экстрасистолы запускаются желудочковым миокардом [9, 10].
Экстрасистолы считаются доброкачественными, хотя в небольшом числе случаев они сосуществуют с врожденными пороками сердца и примерно в 2–3% случаев приводят к опасным для жизни тахиаритмиям [8]. Истинная частота встречаемости предсердных экстрасистол у плода неизвестна, но данный вид аритмии достаточно распространен. По данным Nagashima M. et al. (1987), предсердные экстрасистолы были зарегистрированы у 51% здоровых новорожденных детей в течение 24-часового наблюдения за ЭКГ [11]. Преждевременные сокращения желудочков являются редким явлением у плода. Пренатально желудочковые экстрасистолы встречаются в 10 раз реже, чем предсердные экстрасистолы, но большая их часть сохраняется на протяжении всей беременности [8, 11].
Предрасполагающим к возникновению экстрасистолии у плодов фактором считается незрелость проводящей системы сердца в связи с незаконченностью формирования ее структурных компонентов. Чаще эктопические преждевременные сокращения являются идиопатическими, но были предложены гипотетические объяснения их возникновения. Наиболее частыми причинами преждевременной экстрасистолии являются: прием матерью стимуляторов, включая кофеин, заболевание щитовидной железы у матери, секреция катехоламинов у плода или у матери, метаболические нарушения и инфекции в организме беременной; со стороны плода – наличие сердечной аномалии и воспалительные заболевания миокарда [10–13].
Предсердные экстрасистолы трудно отличить от желудочковых экстрасистол. Предсердные экстрасистолы чаще проводятся на желудочки и сопровождаются преждевременными сокращениями желудочков с формированием последующей компенсаторной паузы. После предсердной экстрасистолы ритм СА-узла сбивается, и дополнительные электрические импульсы восстанавливают его. Так что сокращения предсердий и желудочков, следующие за предсердными экстрасистолами, возникают раньше, чем ожидаемая синусовая активность (рис. 1а) [14, 15].
Преждевременные желудочковые сокращения не связаны с сокращениями предсердий. Ритм СА-узла обычно не сбрасывается – синусовый узел продолжает работать в своем ритме, в результате сокращения предсердий и желудочков, следующие за желудочковыми экстрасистолами, совпадают с исходным синусовым ритмом (рис. 1б) [15].
В результате при желудочковых экстрасистолах интервалы между двумя нормальными сердечными сокращениями (2V) и между двумя сердечными сокращениями, одно из которых преждевременное (XV), будут почти одинаковыми, поскольку активность СА-узла не будет нарушена: V+V=V+X (рис. 2а и 2б) [15].
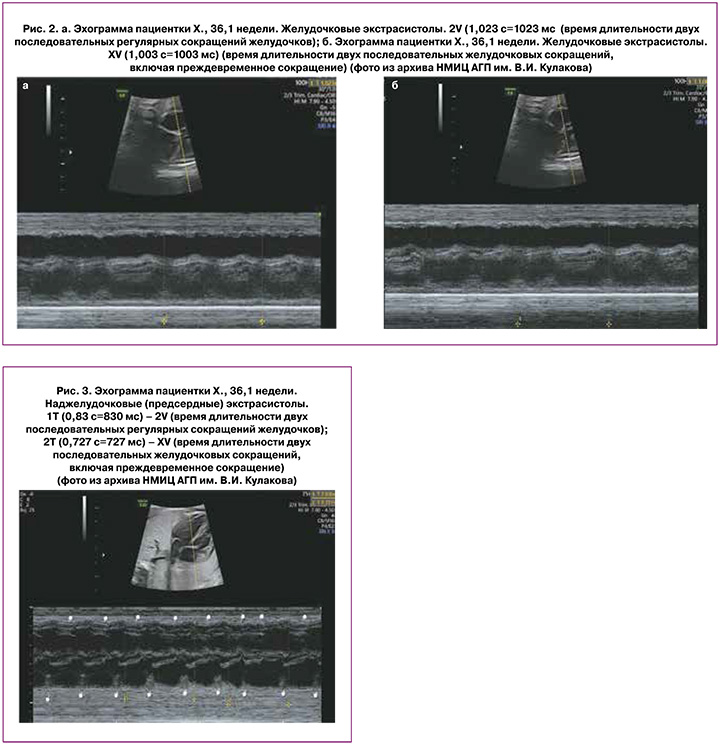
Тогда как при предсердных экстрасистолах время двух сокращений сердца, одно из которых преждевременное (XV), будет короче длительности двух нормальных сокращений сердца (2V), так как активность СА-узла будет сброшена, и следующее за экстрасистолой сокращение появится раньше: V+X<V+V, где V – время регулярного сокращения сердца, Х – время преждевременного сокращения (рис. 3) [15].
Teramachi Y. et al. (2021) рассчитали, что при желудочковых экстрасистолах разница по времени между интервалом 2V (время длительности двух последовательных регулярных сокращений) и интервалом XV (время длительности допплеровских волн, включая преждевременное сокращение) составляет менее 33 мс. В то время как при предсердных экстрасистолах разница между интервалом 2V и интервалом XV превышает 33 мс у всех плодов. Для плодов с разницей менее 33 мс распознавание желудочковых экстрасистол плода имело чувствительность и специфичность 100% [15].
Изолированная экстрасистолия предсердий и желудочков, как правило, доброкачественна, самостоятельно исчезает и никакого лечения не требует [14]. Согласно рекомендациям Американской кардиологической ассоциации, при данных состояниях ЧСС плода должна контролироваться еженедельно до тех пор, пока предсердные или желудочковые экстрасистолы не исчезнут. Цель мониторирования экстрасистолии – своевременное выявление наджелудочковой тахиаритмии (НЖТ), которая может возникать в 0,5–2% случаев предсердных экстрасистолий, а преждевременные сокращения желудочков могут привести к желудочковой тахикардии [16].
Особую форму предсердной аритмии представляют блокированные предсердные экстрасистолы – это вид предсердной тахикардии с АВ-блокадой, когда на фоне синусовых сокращений предсердий регистрируются регулярные предсердные экстрасистолы, которые блокируются в АВ-узле с частотой проведения импульса 2:1 (бигеминия), 3:1 (тригеминия) и т.п. [9, 10].
При нормальной проводимости АВ-узла за преждевременным предсердным сокращением следует своевременное, связанное с ним преждевременное желудочковое сокращение. Но если сокращение предсердий слишком преждевременно и попадает на рефрактерный период в АВ-узле, то желудочкового сокращения не происходит, что проявляется в виде пропущенного сердцебиения. Таким образом, если частота предсердий выше, чем способность АВ-узла проводить импульсы, некоторые из импульсов блокируются [9]. Стойкая предсердная блокированная экстрасистолия с функциональной АВ-блокадой преждевременных сокращений может снизить среднюю ЧСС плода до 70–100 уд./мин и иногда привести к длительным эпизодам стойкой брадикардии [14].
Блокированная предсердная бигеминия и АВ-блокада II степени с блокадой проведения 2:1 проявляются как желудочковая брадикардия и могут быть трудно различимы с помощью эхокардиографии [14]. Поскольку прогноз и клиническое лечение этих ритмов различны, очень важен точный диагноз. При АВ-блокаде все сокращения предсердий генерируются в СА-узле, ритм регулярный, и, следовательно, временные интервалы между предсердными сокращениями равны. В случаях блокированной бигеминии за каждым синусовым сокращением предсердий следует предсердная экстрасистола. И поэтому временной интервал от синусового до преждевременного сокращения предсердий заметно более короткий, чем от преждевременного до синусового сокращения [14, 17, 18] (рис. 4а и 4б).

Как правило, брадикардия на фоне блокированной бигеминии с функциональной АВ-блокадой является доброкачественной прерывистой, не требует лечения, разрешается спонтанно по мере развития беременности или после рождения и обычно не связана с сердечной недостаточностью [8]. Однако у 1–5% плодов развивается тахикардия; при этом риск наиболее высокий у плодов с множественными блокированными предсердными эктопическими сокращениями [19, 20].
Фетальные тахиаритмии
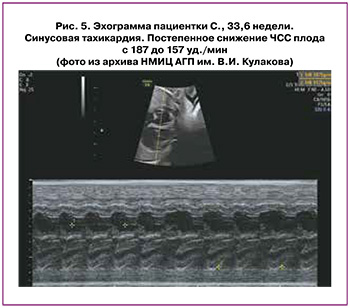
Синусовая тахикардия (СТ) характеризуется частотой предсердий 180–200 уд./мин, AВ-проводимостью 1:1, нормальной продолжительностью AВ-интервала. Источником нарушения ритма является CA-узел, который срабатывает с необычно высокой скоростью [9, 21].
Частыми причинами СТ являются: дистресс и анемия плода, инфекционные процессы (хориоамнионит, цитомегаловирусная инфекция), материнская гипертермия, тиреотоксикоз, прием беременной лекарственных препаратов – β-миметиков или тиреоидных препаратов [21, 22].
Для СТ характерны постепенное увеличение или уменьшение ЧСС плода, отсутствие резкого начала или разрывов между периодами нормального ЧСС и эпизодами синусовой тахикардии (рис. 5), вариабельность ЧСС в условиях АВ-проводимости 1:1, нормальное время АВ-проводимости [21].
Специфическая антиаритмическая терапия СТ не показана. Лечение должно быть направлено на устранение причины аритмии.
Наджелудочковая (суправентрикулярная) тахиаритмия (НЖТ) определяется несинусовым механизмом ускоренного сердечного ритма с ЧСС>180 уд./мин. Эта большая группа нарушений ритма сердца включает любой эктопический быстрый ритм, возникающий из структур проводящей системы выше ветвей пучка Гиса [21, 22].
НЖТ – наиболее распространенная форма тахиаритмий у плодов. Частота возникновения 1:5000–10 000 плодов [21]. НЖТ диагностируется с 19-й по 40-ю неделю беременности, но в большинстве случаев – на 30–32-й неделе. Длительные тахиаритмии без лечения часто вызывают сердечную недостаточность и водянку плода [19, 21].
НЖТ возникают в большинстве случаев на фоне структурно нормальных сердец. При этом в 10% случаев при внутриутробно диагностируемой НЖТ после рождения выявляются дополнительные пути проведения импульса (пучки Кента, Махейма, Джеймса) [23]. Функционирование таких проводящих путей является результатом нарушения внутриутробного развития фиброзных колец митрального и трикуспидального клапана, в результате чего сохраняется одно или несколько мышечных соединений между предсердным и желудочковым миокардом. Наличие в сердце помимо нормальной предсердно-желудочковой проводящей системы дополнительного аномального пути проведения импульса является электрофизиологической основой для циркуляции электрических импульсов по механизму повторного входа (re-entry).
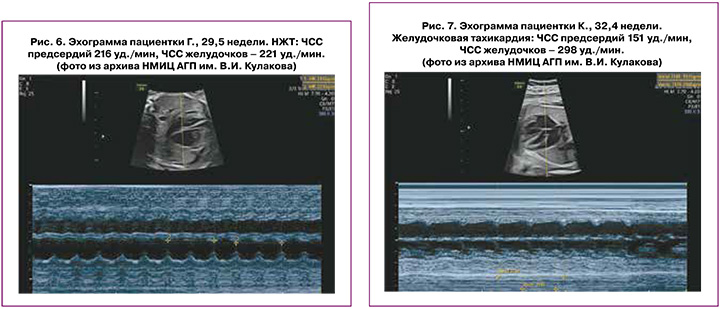
Атриовентрикулярная тахикардия с повторным входом (Atrioventricular Re-entry Tachycardia, AVRT) – это тахикардия, на долю которой приходится более 90% НЖТ, встречающихся у плодов и новорожденных [2, 7].
Этот тип тахикардии обычно развивается на сроке от 24 до 32 недель беременности. Проявляется как прерывистая или стойкая тахикардия с ЧСС 190–300 уд./мин. На каждое сокращение желудочков приходится одно сокращение предсердий. AVRT внезапно начинается с предсердной экстрасистолы и заканчивается паузой ритма (АВ-блоком) [1, 2] (рис. 6).
Обычная схема круга re-entry при AVRT включает AВ-узел для антеградной проводимости и быстрый ретроградный проводящий вспомогательный путь, по которому электрический импульс возвращается из желудочков в предсердия («быстрые» пучки Кента), замыкая тем самым цепь re-entry. AVRT представляет собой устойчивую циркуляцию импульса по описанному пути [1, 9].
Из-за почти одновременного сокращения желудочков и предсердий АВ-клапаны закрываются во время систолы предсердий; в результате кровь из предсердий не может попасть в желудочки в полном объеме и возвращается в прекардиальные вены, на допплерометрии регистрируется ретроградный кровоток в полых венах, легочных венах и в венозном протоке, что является причиной развития застойной сердечной недостаточности и формирования водянки плода [1, 2, 10].
Выявление НЖТ у плода требует экстренного направления к детскому кардиологу для специального лечения. Задержка с оценкой и лечением НЖТ плода может привести к развитию водянки плода. Более чем в 50% случаев НЖТ поддается трансплацентарной терапии дигоксином. Кардиоверсия в синусовый ритм достигается в 65–95%. После кардиоверсии долгосрочный прогноз обычно благоприятный [8].
Желудочковая тахикардия (ЖТ) – очень редкая аритмия плода, составляющая менее 2% всех нарушений ритма сердца плода [24–27]. ЖТ характеризуется полной диссоциацией сокращений предсердий и желудочков, при этом частота желудочков выше, чем частота предсердий.
Критерием для пренатальной диагностики ЖТ, как правило, является превышение частоты сокращений желудочков над частотой сокращений предсердий в дополнение к высокой частоте сокращений желудочков в диапазоне от 170 до 400 уд./мин [24–26] (рис. 7). Однако, может иметь место ретроградная проводимость 1:1, приводящая к одинаковой частоте сокращений предсердий и желудочков, поэтому эта аритмия может быть ошибочно диагностирована как НЖТ [24, 25].
Электрофизиологическим механизмом этой тахикардии является возникновение эктопического водителя ритма с патологическим автоматизмом внутри миокарда желудочков. Источник электрических импульсов может находиться в ножках или разветвлениях пучка Гиса, в волокнах Пуркинье или рабочем миокарде желудочков.
Условием для развития ЖТ является наличие в миокарде зон замедленного проведения возбуждения, участков мышцы сердца с разными по величине рефрактерными периодами, что обычно связано с патологическими изменениями в миокарде. Внутри желудочков формируется электрическая цепь с круговым движением импульса (феномен re-entry) вокруг электрически инертной области мышцы. У плодов ЖТ обычно связаны с формированием патологических изменений в миокарде при нарушении его кровоснабжения. Так, пренатальная ЖТ в подавляющем большинстве случаев является вторичной по отношению к миокардиту, опухолям сердца, аневризмам желудочков [16, 28, 29]. ЖТ у плодов может развиться при тяжелой гипертрофии желудочков на фоне стеноза полулунного клапана, при гипертрофической кардиомиопатии диабетического происхождения, при ишемии миокарда плода на фоне врожденного порока сердца с нарушением коронарного кровоснабжения [10].
Врожденные миокардиты – это последствия в первую очередь вирусной инфекции (вирус Коксаки А и В, ECHO, грипп, краснуха, ветряная оспа, герпес) и являются результатом непосредственного кардиотоксического действия возбудителя с формированием воспалительных и деструктивных изменений в тканях сердца (преимущественно в миокарде) [12, 13, 29, 30].
В настоящее время в литературе активно обсуждается взаимосвязь развития ЖТ у плодов с перенесенной матерью COVID-инфекцией. Доказано наличие интенсивного системного воспаления с развитием острого миокардита, обусловленного SARS-CoV [12, 13, 29]. Сердечные осложнения описаны как в острой фазе инфекции, так и в постострой фазе, где они встречаются чаще [29]. Возможно, что не прямое вирусное поражение органов, а новый спектр васкулитов и воспалительных процессов после инфекции SARS-CoV, может быть вовлечен в патофизиологию дисфункции миокарда [12].
ЖТ может быть проявлением наследственных заболеваний: синдром Бругада, катехоламинергическая полиморфная ЖТ, синдром Барта, некомпактный миокард [31].
Однако, наиболее частой причиной ЖТ, согласно обзору Simpson J.M. (2009), является синдром удлинения интервала QT [25]. Данное заболевание относят к группе каналопатий – генетически гетерогенное наследственное состояние, характеризующееся нарушением структуры и функциональности некоторых ионных каналов кардиомиоцитов. В результате этого процессы реполяризации миокарда происходят неравномерно и неодновременно в различных частях желудочков, что становится причиной удлинения интервала QT. Часто у таких пациентов из-за чрезмерного удлинения интервала QT имеется функциональная АВ-блокада II степени, на фоне которой развивается ЖТ, в основном проявляющаяся как тахикардия типа «пируэт» [32].
Пренатально ультразвуковые методы не позволяют измерить интервал QT, поэтому диагноз не может быть подтвержден [32]. Однако, это состояние следует заподозрить, если ЖТ плода сочетается с периодами синусовой брадикардии и АВ-блокады II степени. При этом, такая ЖТ имеет тенденцию быть устойчивой и относительно регулярной [24].
Трепетание предсердий – это первично предсердная тахикардия, при которой схема повторного входа импульса (re-entry) включает пути, расположенные только в стенке предсердия. АV-узел не является частью внутрипредсердного возвратного контура [10].
Трепетание предсердий у плода определяется, как быстрая регулярная частота предсердных сокращений 300–600 уд./мин, которая сопровождается различной степенью блокады атриовентрикулярного проведения, что приводит к более медленной частоте сокращения желудочков [33] (рис. 8). Это вторая по частоте тахикардия плода и встречается с частотой 25–30% среди всех типов тахиаритмии [5, 21, 34].

Из-за высокой частоты предсердной импульсации, которая, как правило, превышает уровень «точки Венкебаха» АВ-узла, трепетание предсердий практически всегда протекает с АВ-блокадой II степени [10]. Степени AВ-блокады могут быть различными: 2:1; 3:1; 4:1 или может быть переменной частота проведения импульса через АВ-узел, что приводит к различной частоте желудочковой реакции и ритмам.
Трепетание предсердий наблюдается только в III триместре, что, вероятно, связано с большим размером предсердий, достигнутым на 27–30-й неделе беременности и с высокой уязвимостью миокарда предсердий к экстрасистолии [33].
Трепетание предсердий может возникать при структурно нормальном сердце или при врожденных пороках сердца. Основной субстрат развития трепетания предсердий у плода связан с расширением предсердий, как это происходит у пациентов с расширением правого предсердия при дисплазии трехстворчатого клапана, или при обструкции выходного отдела правого желудочка с трикуспидальной регургитацией, или у плодов с расширением левого предсердия, вторичным по отношению к митральной регургитации [10].
Одним из вариантов запуска трепетания предсердий рассматривается исходное наличие атриовентрикулярной реципрокной тахикардии у плода, которое часто ухудшает сердечную функцию и может вызвать заметное расширение предсердий, что создает условия для инициации и сохранения трепетаний предсердий, которое в дальнейшем становится доминирующим ритмом [21]. Подавляющее большинство случаев трепетания предсердий инициируется предсердными экстрасистолами. Также трепетания предсердий могут развиваться сразу после паузы при прекращении атриовентрикулярной реципрокной тахикардии [21]. При окончании пароксизма трепетания предсердий происходит восстановление регулярного синусового ритма или устанавливается ритм НЖТ. При спонтанном прекращении трепетания предсердий до синусового ритма наблюдаются колебания продолжительности периода трепетания предсердий.
Трепетание предсердий может иметь пароксизмальное (приступообразное), непрерывно рецидивирующее и хроническое течение. Клинические проявления трепетания предсердий зависят от частоты ритма желудочков и от тяжести основной сердечной патологии. Гемодинамические эффекты тахиаритмии плода включают низкий сердечный выброс, повышенное центральное венозное давление, регургитацию на АВ-клапанах. Эти факторы способствуют формированию водянки плода, прогрессирующей фетоплацентарной недостаточности и гибели плода [33, 35, 36]. Водянка плода присутствует, по данным разных авторов, у 15–45% всех плодов с трепетанием предсердий [35, 37]. Общая смертность плодов от трепетания предсердий, по данным исследований, составляет 8–10%, при этом 20% смертей происходит внутриутробно [3, 35, 37].
Заключение
Нарушения сердечного ритма плода представляют собой серьезные состояния, требующие лечения для предотвращения сердечной недостаточности и гибели плода.
Ультразвуковое исследование сердца плода необходимо для понимания основного механизма аритмии, для изучения влияния аритмии на работу сердца, для исключения структурной патологии сердца или опухолей, также для наблюдения за состоянием плода во время антиаритмического лечения.



