Современные тенденции в лечении рака молочной железы (РМЖ) стремятся к сокращению объема хирургического вмешательства, как на молочной железе, так и на регионарных лимфатических коллекторах у пациенток с ранними стадиями. С одной стороны, это продиктовано высоким процентом послеоперационных осложнений (5–50%), сопровождающих аксиллярную лимфодиссекцию [1, 2]; с другой – отсутствием метастатического поражения подмышечных лимфатических узлов (ЛУ) у 70% пациенток с РМЖ по результатам проведенного патоморфологического исследования [3]. Одновременно с этим, данные ряда крупных исследований показывают, что отказ от подмышечной лимфодиссекции не влияет ни на общую, ни на безрецидивную выживаемость больных РМЖ [4–7]. В такой ситуации возникает вопрос о необходимости максимально достоверной неинвазивной оценки состояния подмышечных ЛУ на дооперационном этапе. В настоящее время изучение молекулярного «портрета» опухоли выходит на ведущую позицию в понимании опухолевой прогрессии, что делает актуальным выявление молекулярно-генетических маркеров, коррелирующих со статусом регионарных ЛУ [8–10].
Целью нашего исследования стал поиск генов-предикторов лимфогенной диссеминации первичной опухоли, способных стать дополнительным диагностическим инструментом в планировании объема аксиллярной лимфодиссекции у пациенток с РМЖ.
Материалы и методы
В исследование включены 200 пациенток с морфологически верифицированным уницентрическим инвазивным РМЖ Т1-4N0-3M0. Всем пациенткам выполнено хирургическое вмешательство в ГУЗ «Областной клинический онкологический диспансер» (ГУЗ ОКОД) г. Ульяновска в период с 2012 по 2015 г. Критериями исключения определены неоадъювантная терапия и наличие злокачественных новообразований других локализаций до постановки диагноза РМЖ. В основную группу исследования включены 100 пациенток с морфологически подтвержденным метастатическим поражением регионарных ЛУ (группа N+), в контрольную группу – 100 пациенток без метастазов (группа N0). Средний период наблюдения составил 45 месяцев (от 30 до 60 месяцев).
Для анализа профиля экспрессии генов в опухолевой ткани применяли полимеразную цепную реакцию с обратной транскрипцией (ОТ-ПЦР), диагностическая панель включала 31 ген – 28 функциональных и 3 референсных. В состав панели включены гены, контролирующие процесс клеточной пролиферации: EGFR, HER2, KI67, STK15, MYC, CCNB1, CCND1, PTEN, P16INK4A, MYBL2, TMEM45B, SFRP1; гены, контролирующие апоптоз: BIRC5, BCL2, BAG1, TERT, MIA, NDRG; гены клеточной дифференцировки: ESR, PGR, MGB1, FOXA1, NAT; гены межклеточных взаимодействий, межклеточные протеазы: MMP11, CTSL2; а также СD45 и CD68. В качестве референсных использовали гены GUSB, HPRT1 и B2M.
Процедура молекулярно-генетического анализа состояла из следующих этапов: выделение мРНК из образца опухолевой ткани, проведение обратной транскрипции и собственно РВ-ПЦР (ПЦР в «реальном времени» или количественная ПЦР). На этапе выделения мРНК использовали коммерческие наборы RNeasy (Qiagen, США). Обработку исследуемого материала проводили в соответствии с протоколом компании-производителя. Объем конечного раствора составлял 60 мкл со средней концентрацией РНК в нем 35–40 мкг/мл. После получения РНК немедленно проводили этап обратной транскрипции. Постановку реакции осуществляли с использованием наборов НПФ «ДНК Технология» согласно технической инструкции при температуре 40 °С в течение 30 мин, с последующей инактивацией обратной транскриптазы при 95 °С в течение 5 мин. Для увеличения объемов образцов после ОТ кДНК подвергали 10-кратному разведению в ТЕ-буфере. Полученный раствор кДНК использовался для ОТ-ПЦР либо хранился при температуре -20 °С с учетом максимально допустимого срока.
Для постановки ПЦР применяли реактивы «НПФ ДНК-Технология». Контроль отсутствия реакции на геномной ДНК проводили с образцами, не прошедшими реакцию обратной транскрипции, которые подвергались разведению в ТЕ-буфере в конечной концентрации, эквивалентной конечной концентрации кДНК. ДНК-зонды, используемые для детекции продуктов амплификации исследуемых и нормировочных генов, помечались FAM. Постановка реакции амплификации генов проводилась в разных пробирках в двух повторах. Амплификацию осуществляли в режиме «реального времени» в объеме 35 мкл по следующей программе: 1 цикл – 80 °С 30 с, 94 °С 1 мин; 50 циклов – 94 °С 10 с, 64 °С 20 с с использованием приборов «ДТ-322» и «ДТ-964» производства ЗАО «НПФ ДНК-Технология». Измерение уровня флуоресценции проводили на каждом цикле при температуре 64 °С.
Относительную экспрессию исследованных генов определяли согласно методике, предложенной Vandesompele и соавт., используя в качестве нормировочных гены GUSB, HPRT1 и B2M [11, 12].
Полученные данные обрабатывали с помощью пакета прикладных программ Microsoft Excel 2010 и Statistica for Windows 8.0. (StatSoft Inc., USA). Распределение большинства количественных признаков соответствовало закону нормального распределения (критерий Колмогорова–Смирнова, р>0,05). Для сравнения двух независимых групп по количественным признакам применяли t-критерий Стьюдента и критерий Манна–Уитни.
Расчет достаточности размера выборки оценивали по формуле, используемой при неизвестной численности генеральной совокупности для количественных признаков: n = (s2×Z2)/ ∆2; где s – дисперсия признака, Z=1,96 – критическое значение нормального распределения при уровне значимости 0,05 и двустороннем тесте, ∆=10%.
Различия считали статистически значимыми при р<0,05. Для построения модели прогноза метастазирования на основании анализа экспрессии генов в первичной опухоли применен дискриминантный многофакторный анализ. На наш взгляд, среди различных методов классификации, таких как кластерный, факторный анализ, деревья классификации, нейронные сети, именно дискриминантный анализ дает наилучшие результаты при анализе лабораторных показателей.
Результаты
Пролиферативная активность первичной опухоли, определяемая на основании экспрессии гена Ki67, статистически значимо различалась в двух сравниваемых группах. В группе пациенток с метастатическим поражением регионарных ЛУ среднее значение мРНК данного гена оказалось в 1,3 раза выше, чем в группе пациенток без метастазов (р=0,03).
Вместе с тем, отмечалась обратная зависимость уровня экспрессии PTEN (гена-онкосупрессора). При сравнении данных групп было выявлено, что уровень экспрессии гена PTEN меньше в группе пациенток с метастатическим поражением ЛУ по сравнению с группой, в которую вошли пациентки без метастазов (р<0,001).
Экспрессия гена ESR1, кодирующего рецептор эстрогена-α, оказалась значимо выше (в 2,1 раза) в группе пациенток «N0» по сравнению с группой пациенток «N+» (р=0,04). Аналогичная зависимость с тенденцией к статистической значимости выявлена и для экспрессии гена PGR (р=0,06).
Повышенный уровень экспрессии гена NAT был зафиксирован в ткани первичной опухоли пациенток с метастатическим поражением регионарных ЛУ по сравнению с уровнем экспрессии в опухолевой ткани из группы пациенток без метастазов (р=0,04).
Среднее значение мРНК гена CD68, являющегося маркером макрофагов, также значимо различалось в двух сравниваемых группах. Установлено, что уровень экспрессии гена CD68 в группе пациенток «N+» выше, чем в группе «N0» (р<0,001).
Детальное сравнение групп по экспрессии генов, включенных в исследование, представлено в табл. 1.
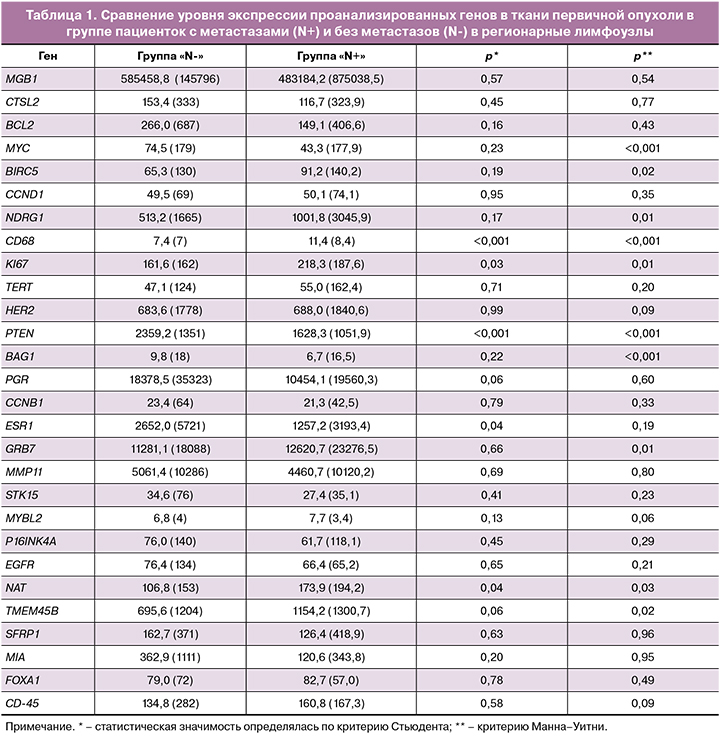
Таким образом, первичная опухоль молочной железы в группе пациенток с метастатическим поражением регионарных ЛУ по сравнению с контрольной группой характеризуется более высокой пролиферативной активностью (с учетом анализа экспрессии гена Ki-67), а также повышенным уровнем мРНК генов NAT и CD68 на фоне снижения активности ингибитора пролиферации PTEN. По результатам молекулярно-генетического экспрессионного анализа также установлено, что опухоли из группы «N+» характеризуются более низкими показателями экспрессии гена ESR1.
Для построения прогностической модели в отношении наличия или отсутствия метастатического поражения регионарных ЛУ на основании экспрессии генов в первичной опухоли молочной железы нами был применен дискриминантный анализ (табл. 2).
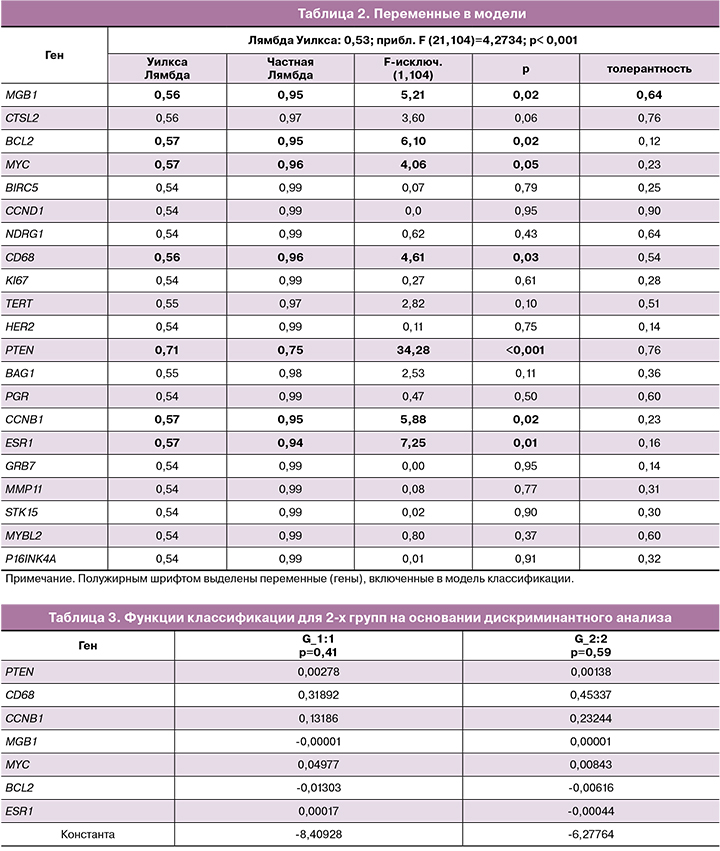
Включение переменной в модель проводили на основании величины Лямбды Уилкса, Частной Лямбды Уилкса и величины F-исключения. При этом значение Лямбды Уилкса напротив каждой из переменных показывает, какой вклад данная переменная вносит в дискриминацию групп (после исключения ее из анализа), чем выше значение параметра, тем важнее признак. Статистика Частная Лямбда Уилкса показывает отношение Лямбды Уилкса после добавления данной переменной к Лямбде Уилкса до добавления переменной. Если переменная вносит хотя бы какой-то вклад в разделение групп, после ее добавления Лямбда Уилкса должна уменьшиться. В связи с этим, чем меньшим оказывается значение Частной Лямбды, тем ценнее данный признак. F-критерий, связанный с исключением данного признака из анализа, а p-level – это уровень его статистической значимости. Если исключение признака приводит к статистически значимому изменению соотношения дисперсий, значит, этот признак вносит важный вклад в дискриминацию групп. На основании результатов, приведенных в табл. 2, и были выбраны значимые переменные.
В табл. 3 приводятся значения функции классификации (коэффициенты линейных дискриминантных функций), которые могут быть использованы для вычисления вероятности метастатического поражения лимфоузлов. При этом модель работает следующим образом: в образце первичной опухоли определяется экспрессия генов, перечисленных в табл. 3, далее на основе уровня экспрессии генов-предикторов, вычисляются две линейные дискриминаннтные функции (ЛДФ) «0» и «+» с коэффициентами из табл. 3 (для групп N«0» и N«+» соответственно). Пациент классифицируется в ту группу, для которой значение ЛДФ является наибольшим.
Матрица классификации как результат применения линейной дискриминантной функции. составленная на основании полученного решения, представлена в табл. 4.
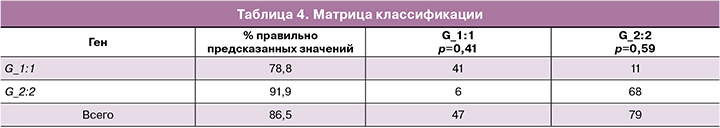
Разработанная нами модель прогноза метастатического поражения регионарных лимфатических узлов показала высокую точность отнесения пациентов к той или иной группе. По данным исследования чувствительность предсказания наличия метастазов в регионарных ЛУ у пациенток с РМЖ составила 91,9%. Специфичность предсказания отсутствия метастатического поражения составила 78,8%. В целом, эффективность метода классификации составил 86,5%.
Заключение
Первичная опухоль молочной железы в группе пациенток с метастатическим поражением регионарных ЛУ характеризуется повышенной пролиферативной активностью с учетом экспрессии гена Ki-67 (р=0,03), а также повышенным уровнем мРНК генов NAT (р=0,04) и CD68 (р<0,001) на фоне снижения экспрессии ингибитора пролиферации PTEN (р<0,001) и пониженной экспрессии гена ESR1 (р=0,04). По результатам дискриминантного анализа точность предсказания наличия или отсутствия метастатического поражения регионарных ЛУ на основании молекулярно-генетического исследования первичной опухоли с применением экспрессионной панели из 7 генов составила 91,9 и 78,8% соответственно.
Таким образом, молекулярно-генетическое исследование ткани первичной опухоли молочной железы с включением необходимого набора генов (PTEN, CD68, CCNB1, MGB1, MYC, BCL2, ESR1) и применением формулы для вычисления дискриминантной функции может стать дополнительным диагностическим инструментом для прогнозирования риска метастатического поражения регионарных лимфатических узлов при планировании объема аксиллярной лимфодиссекции у пациенток с РМЖ.



