Гестационный процесс, роды и кормление грудью – это физиологические функции организма женщины. Необходимость адаптации к новым условиям требует значительных перестроек всех органов и систем женского организма, и адекватность этих приспособительных реакций крайне важна для внутриутробной жизни плода, адаптации в родах и здоровья новорожденного. Реабилитационный период для матери после родов занимает в среднем 1 год. Существует понятие «поздняя материнская заболеваемость» – это болезни женщины, связанные с беременностью, родами, диагностированные в течение 1 года после рождения ребенка. В современных условиях, имея груз экстрагенитальной патологии, проблемы репродуктивной функции, дисбаланс макро- и микронутриентов, не каждая женщина легко справляется с восстановлением здоровья после родов.
Избыточной массой тела в России страдает каждая вторая пациентка репродуктивного возраста, а каждая четвертая имеет ожирение [1]. По экспертным оценкам, ожирение приводит к увеличению риска сердечно-сосудистой смертности в 4 раза и смертности в результате онкологических заболеваний в 2 раза [2]. Согласно данным ВОЗ, идентифицированы 82 фактора окружающей среды и образа жизни, способствующие развитию ожирения [3]. При ожирении, существовавшем до беременности, пациентка часто имеет хроническую патологию: гипертензию, диабет, болезни суставов, поражение печени, варикоз, психоэмоциональные расстройства [4–7]. Разработаны и применяются программы прегравидарной подготовки для женщин с ожирением [8]. Однако после реализации репродуктивных планов эта патология усугубляется, а также наслаиваются акушерско-гинекологические осложнения: невынашивание, преэклампсия, гнойно-септическая инфекция, материнский травматизм, пролапсы гениталий, послеродовая депрессия и др. [2, 9]. Персистенция факторов риска на любой стадии заболевания, в том числе и после родов, определяет скорость прогрессирования болезни и тяжесть осложнений, именно поэтому необходима коррекция ожирения в различные периоды жизни женщины. Пациентки с ожирением, став матерями, зачастую не обращаются к специалистам для лечения имеющейся патологии. Хотя для них остро встает вопрос реабилитации, которую обязаны предложить и провести врачи акушеры-гинекологи. В настоящее время отсутствует четкая система послеродовой реабилитации для данной категории пациентов. При изучении литературных источников нам встретились разрозненные единичные мероприятия, связанные только с вербальными рекомендациями по питанию и снижению веса.
Цель исследования: оценить эффективность комплексной программы послеродовой реабилитации у пациенток с ожирением.
Материалы и методы
Исследование проведено на кафедре акушерства и гинекологии ФГБОУ ВО «Пермский государственный медицинский университет им. академика Е.А. Вагнера» Минздрава России, городской клинической больницы им. М.А. Тверье. Для формирования необходимых групп проводили отбор пациенток в раннем послеродовом периоде по антропометрическим данным, рассчитывая индекс массы тела (ИМТ) как отношение веса (кг) к росту (м) в квадрате. Выборка составила 64 женщины.
Критерии включения в основную группу (n=36) и группу сравнения (n=28): андроидный тип ожирения (расчет проводили с помощью индекса К – отношение окружности талии (см) к окружности бедер (см), при К, равном или более 0,85, определялся андроидный тип ожирения), ИМТ 30–45 кг/м2, отсутствие инфекции в острой форме, отсутствие противопоказаний к назначению медикаментозного лечения ожирения, применение барьерной контрацепции в течение 12 месяцев после родов. Дополнительный критерий включения в основную группу – наличие информированного согласия на использование комплексной программы послеродовой реабилитации.
 Критерии невключения в основную группу и группу сравнения: тиреотоксикоз, артериальная гипертензия без достижения целевого уровня, другая экстрагенитальная патология в стадии декомпенсации, противопоказания к назначению препарата «Редуксин Форте» (в соответствии с инструкцией по применению препарата), употребление алкоголя в гепатотоксичных дозах, отказ от участия в исследовании.
Критерии невключения в основную группу и группу сравнения: тиреотоксикоз, артериальная гипертензия без достижения целевого уровня, другая экстрагенитальная патология в стадии декомпенсации, противопоказания к назначению препарата «Редуксин Форте» (в соответствии с инструкцией по применению препарата), употребление алкоголя в гепатотоксичных дозах, отказ от участия в исследовании.
Три родильницы основной группы за период исследования отказались от участия в связи с изменением места жительства, по семейным обстоятельствам, таким образом общая выборка составила 61 человек.
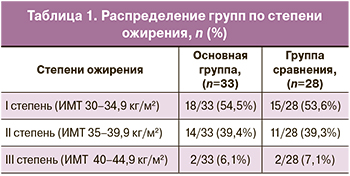
В группах пациентки были сопоставимы по степени ожирения (табл. 1).
Разработана программа послеродовой реабилитации, которую применяли после родов только для пациенток основной группы в течение 12 месяцев. Программа включала следующее.
Консультации по питанию проводились врачом-диетологом в групповом режиме в рамках «Школы правильного питания», начиная с раннего послеродового периода.
Консультации врача лечебной физкультуры и спортивной медицины в групповом режиме с рекомендациями по оптимальному режиму физической нагрузки (не менее 10 000 шагов в сутки или не менее 30 минут аэробной нагрузки в день) с учетом лишнего веса, упражнения Кегеля ежедневно в течение 15–20 минут, начиная с 10–14-го дня после родов. Каждой женщине была выдана на руки Памятка.
Консультации врача акушера-гинеколога с назначением холекальциферола 1500 МЕ в сутки, начиная с раннего послеродового периода.
Консультации психотерапевта в групповом и индивидуальном режиме через 1, 3 и 6 месяцев после родов.
Индивидуально, после прекращения грудного вскармливания (не ранее 6 месяцев после родов), добавлялась медикаментозная терапия ожирения комплексным препаратом «Редуксин Форте»: сибутрамин (10,0 мг) + метформин (850,0 мг) однократно утром, ежедневно в течение 3 месяцев с учетом противопоказаний. На фоне проводимой лекарственной терапии нежелательных эффектов не обнаружено.
Женщинам группы сравнения реабилитационную программу не проводили.
Для оценки риска послеродовой депрессии использовали Эдинбургскую шкалу (ESPD), которая относится к субъективным шкалам и применяется для скрининга. Шкала состояла из 10 вопросов (балльный ответ от 0 до 3 в каждом вопросе). Итоговый результат вычислялся путем сложения по всем 10 пунктам, анкетирование проводили по завершении 6 и 12 месяца после родов [10].
У всех пациенток определяли индекс женской сексуальной функции – Female Sexual Function Index (FSFI) через 6 и 12 месяцев наблюдения путем самоконтролируемого анкетного опроса, включающего 19 пунктов. Полученная сумма в баллах позволяла оценить особенности желания, возбуждения, любрикации, оргазма, достижения сексуального удовлетворения, наличие диспареунии [11]. Оптимальным считали максимально большее количество баллов при ответе на каждый вопрос анкеты.
Соматическую патологию устанавливали врачи-специалисты (терапевт, эндокринолог) на основании результатов клинических, лабораторных и инструментальных методов диагностики.
Ультразвуковое исследование печени проводили сразу после родов (2–3-и сутки) и через 12 месяцев на сканере SonoScape-S30 (США). Основными критериями постановки диагноза неалкогольной жировой болезни печени на стадии стеатоза по данным УЗИ явились: увеличение размеров печени, повышение ее эхогенности, относительное снижение плотности печени, уменьшение звукопроводимости, ухудшение визуализации вен печени [12].
Всем пациенткам определяли содержание 25-гидроксихолекальциферола (25-(OH)-D) в сыворотке крови иммуноэлектрохемилюминесцентным методом (CMIA) на анализаторе Abbott Architect 2000 в раннем послеродовом периоде, в 6 и 12 месяцев после родов. За нормальное содержание 25-(OH)-D принимали уровень от 32 до 50 нг/мл, при его содержании от 31 до 20 нг/мл диагностировали недостаток, менее 20 нг/мл – дефицит [13]. Исследование одобрено решением этического комитета ФГБОУ ВО «Пермский ГМУ им. академика Е.А. Вагнера» Минздрава России №2 от 27.02.2017.
Статистический анализ
Статистический анализ данных выполнен в Центре «Биостатистика» с помощью пакета прикладных программ Statistica 10 (StatSoft Inc., США) и Microsoft Excel. Использовали проверку нормальности распределения количественных признаков с помощью критерия Колмогорова–Смирнова. Для описания количественных данных, имеющих нормальное распределение, использовали среднее арифметическое (M) и стандартное отклонение (SD). Распределение признаков, отличающихся от нормального, описывали в виде медианы (Me) и интерквартильного размаха (Q1;Q3). В нашем исследовании только один показатель – возраст имел отличное от нормального распределение. Выборки были независимыми, для оценки статистически значимых различий использовали критерий Стьюдента в модификации Уэлча. При величине p≤0,05 отличие принимали за статистически значимое.
Результаты и обсуждение
Группы были сопоставимы по возрасту и паритету (табл. 2). Нужно отметить, что в данных родах акушерский анамнез у женщин был отягощен как в основной группе, так и в группе сравнения развитием плацентарных нарушений у каждой четвертой женщины, гестационного сахарного диабета и гипертензионных расстройств – у каждой третьей (табл. 2). Такие серьезные акушерские осложнения, как гипертензионные расстройства при беременности, преэклампсия тяжелой степени, встречались с одинаковой частотой в группах, что является закономерным ввиду того, что высокий индекс массы тела – признанный фактор риска по развитию этих осложнений [14]. Показатели антенатальных и послеродовых кровотечений в группах не различались (табл. 2).

 Большинство женщин в основной группе 31/33 (90,9%) и в группе сравнения 25/28 (89,3%) прекратили грудное вскармливание к 6 месяцам после родов (рис. 1). Это объясняется наличием факторов, способствующих лактационной дисфункции у женщин с ожирением: гормональные сдвиги, в том числе гипопролактинемия, анатомические особенности молочных желез (большие молочные железы, крупные ареолы, плоские соски – это препятствует прикладыванию младенца к груди), снижение двигательной активности женщины с большой массой тела, особенно при оперативном родоразрешении, в первую неделю, когда необходимо приложить целый ряд усилий матери, чтобы запустить лактацию.
Большинство женщин в основной группе 31/33 (90,9%) и в группе сравнения 25/28 (89,3%) прекратили грудное вскармливание к 6 месяцам после родов (рис. 1). Это объясняется наличием факторов, способствующих лактационной дисфункции у женщин с ожирением: гормональные сдвиги, в том числе гипопролактинемия, анатомические особенности молочных желез (большие молочные железы, крупные ареолы, плоские соски – это препятствует прикладыванию младенца к груди), снижение двигательной активности женщины с большой массой тела, особенно при оперативном родоразрешении, в первую неделю, когда необходимо приложить целый ряд усилий матери, чтобы запустить лактацию.
Выделяют и такой фактор, как нарушение лактогенеза при отсутствии формирования родовой доминанты, что часто возникает у женщин с ожирением [9, 15] и приводит не только к дискоординации родового акта, но и к гипогалактии. Пациентки с ожирением требуют пристального внимания со стороны акушеров- гинекологов, в том числе для подготовки к естественному вскармливанию как на этапе прегравидарной подготовки, так и после родов.
 В результате применения комплексной программы послеродовой реабилитации в основной группе произошло снижение массы тела через 12 месяцев после родов в среднем на 7,68 кг (ДИ 4,1–12,6). Результаты достигались активным снижением массы тела в течение второго полугодия (рис. 2). Вероятно, это связано с дополнительной медикаментозной коррекцией ожирения у женщин комплексным препаратом сибутрамин+метформин, который был назначен после прекращения грудного вскармливания во втором полугодии после родов. Сибутрамин ускоряет чувство насыщения, снижает объем потребляемой пищи, нормализует пищевое поведение, активирует термогенез, увеличивает энергозатраты организма и способствует отрицательному балансу энергии, что, в свою очередь, приводит к потере массы тела. Метформин способствует снижению инсулинорезистентности, ускорению окисления жирных кислот, увеличению использования глюкозы мышцами, уменьшению абсорбции углеводов и жира из желудочно-кишечного тракта, предотвращению отложения жира в печени, повышению гликогенеза, снижению аппетита [16]. Ввиду этих эффектов комплексный препарат широко используется в терапии ожирения, особенно висцерального, метаболически нездорового фенотипа [17, 18]. Побочных эффектов при приеме комплексного препарата сибутрамин+метформин нами не выявлено, однако у 2/33 (6,0%) пациенток отмечалось чувство жажды в первую неделю приема препарата, которое нивелировалось назначением дополнительного приема жидкости (чистой негазированной воды).
В результате применения комплексной программы послеродовой реабилитации в основной группе произошло снижение массы тела через 12 месяцев после родов в среднем на 7,68 кг (ДИ 4,1–12,6). Результаты достигались активным снижением массы тела в течение второго полугодия (рис. 2). Вероятно, это связано с дополнительной медикаментозной коррекцией ожирения у женщин комплексным препаратом сибутрамин+метформин, который был назначен после прекращения грудного вскармливания во втором полугодии после родов. Сибутрамин ускоряет чувство насыщения, снижает объем потребляемой пищи, нормализует пищевое поведение, активирует термогенез, увеличивает энергозатраты организма и способствует отрицательному балансу энергии, что, в свою очередь, приводит к потере массы тела. Метформин способствует снижению инсулинорезистентности, ускорению окисления жирных кислот, увеличению использования глюкозы мышцами, уменьшению абсорбции углеводов и жира из желудочно-кишечного тракта, предотвращению отложения жира в печени, повышению гликогенеза, снижению аппетита [16]. Ввиду этих эффектов комплексный препарат широко используется в терапии ожирения, особенно висцерального, метаболически нездорового фенотипа [17, 18]. Побочных эффектов при приеме комплексного препарата сибутрамин+метформин нами не выявлено, однако у 2/33 (6,0%) пациенток отмечалось чувство жажды в первую неделю приема препарата, которое нивелировалось назначением дополнительного приема жидкости (чистой негазированной воды).
Изучение психологического статуса родильниц явилось одним из основных этапов исследования, т.к. регистрация предвестников и возможность снижения риска реализации послеродовой депрессии является важным компонентом послеродовой реабилитации. По результатам анкетирования ESPD к концу 6 месяца после родов у 6/28 (21,4%) женщин группы сравнения обнаружена вероятность послеродовой депрессии, в основной группе только в 4/33 (12,1%) случаев (р=0,124). Нужно отметить, что консультация психиатра наблюдаемым пациенткам не потребовалась. При повторном анкетировании через 12 месяцев после родов риски депрессии сохранились только в группе женщин с ожирением без реабилитации у 5/28 (17,8%) человек. Участницы, прошедшие программу реабилитации, куда входила консультация психотерапевта, полностью справились с психологическими расстройствами.
Дополнительно выявляли симптомы так называемой «материнской хандры» или «беби-блюза» – предвестники послеродовой депрессии: нарушение сна, раздражительность, подавленное настроение. К концу 3-го месяца после родов нарушения сна и симптомы раздражительности фиксировали у каждой третьей женщины (30,4% и 33,3%), а подавленное настроение – у каждой седьмой (14,6% и 14,3%), различий в группах не обнаружено (рис. 3). Первые месяцы после родов являются тяжелым эмоциональным испытанием для новоявленной матери. Этому есть несколько причин: гормональный дисбаланс, «новая» социальная роль женщины, несущая много тревог и беспокойств, усиление физической усталости, недосыпание, связанное с изменением режима дня, наслоением домашних обязанностей, недостаточная поддержка и помощь близких. Все это усугубляет психологический дискомфорт родильницы. При наличии сопутствующих акушерских и терапевтических осложнений психологический статус еще больше страдает. В обеих группах каждая вторая пациентка была родоразрешена оперативным путем (16/33 (48,5%) и 15/28 (53,6%) соответственно). Операция и последующее восстановление связаны с изменением образа жизни, различными ограничениями. Родильница, кроме беспокойства за здоровье новорожденного, вынуждена тревожиться за свое здоровье, связанное с оперативным вмешательством. Роды путем кесарева сечения могут явиться фактором риска развития постнатального стресса.
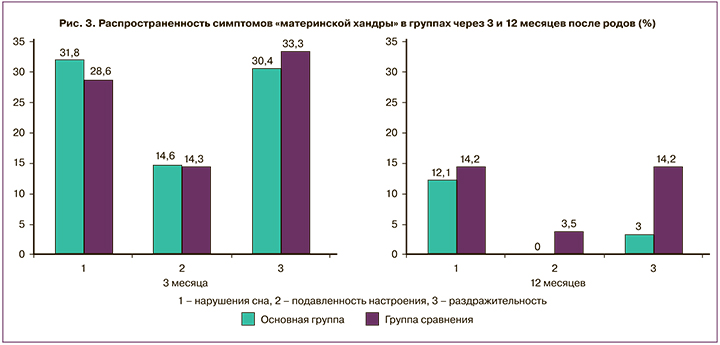
При повторном анкетировании по истечении 12 месяцев после родов в группе женщин, прошедших реабилитацию, симптомов подавленности настроения не выявлено, симптом раздражительности отмечался только в 1/33 (3,0%) случае, в отличие от группы сравнения – в 4/28 (14,2%) при p=0,032 (рис. 3). Однако нарушения сна сохранялись с одинаковой частотой в обеих группах – у каждой десятой пациентки (p=0,896).
Известно, что низкий уровень холекальциферола значимо влияет на состояние психики. Витамин D влияет на функцию гена ключевого фермента биосинтеза нейромедиаторов (адреналина, норадреналина, дофамина, серотонина и альфа-аминомасляной кислоты), которые активно участвуют в эмоциональных реакциях человека. Холекальциферол воздействует на нейроны на всех стадиях их развития, участвует в делении, дифференцировке клеток, кальциевых сигнальных каскадах. Витамин D проявляет нейротрофное и нейропротекторное действие. Известно, что рецепторы витамина расположены в зонах головного мозга, отвечающих за планирование, обработку информации, – нарушение активации этих рецепторов может запускать механизмы формирования депрессии [13].
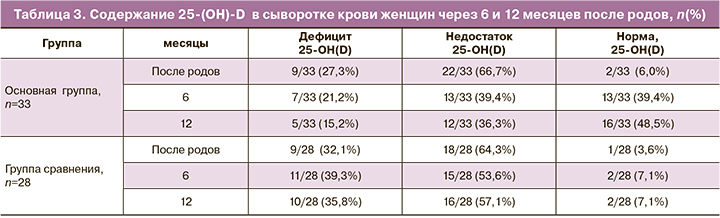
При изучении содержания 25(OH)D в сыворотке крови женщин выявлено снижение этого вещества меньше референсных значений в основной группе в 31/33 (94%) случаев, в группе сравнения – у 27/28 (96,4%) пациенток (табл. 3). Связь ожирения и гиповитаминоза D обусловлена перераспределением холекальциферола в большом объеме жировой ткани, что приводит к снижению его содержания в сыворотке крови женщины. Во-вторых, можно предположить, что при ожирении снижается эндогенная выработка гормона-витамина D в эпидермисе под влиянием инсоляции, поскольку полные люди чаще носят закрытую одежду и меньше времени проводят на солнце. Ранее нами была установлена обратная корреляционная зависимость между ИМТ и содержанием 25(ОН)D в сыворотке крови женщин с ожирением [9]. Программа реабилитации пациенток с ожирением включала дотацию холекальциферола, что позволило уменьшить количество женщин с дефицитом холекальциферола (менее 20 нг/мл) к году до 5/33(15,2%) случаев, тогда как в группе сравнения дефицит этого вещества остался у каждой третьей женщины – 10/28 (35,8%). Нужно отметить, что нормативных значений содержания холекальциферола в сыворотке крови не удалось достичь в 17/33 (51,5%) случаев у женщин основной группы, что требует дальнейшего пересмотра рекомендуемой дотации витамина D пациенткам с ожирением.
Дополнительный прием витамина D, возможно, способствовал снижению риска развития послеродовой депрессии у женщин основной группы. Дисбаланс стероидных гормонов в значительной мере связан с недостаточностью функции стресс-лимитирующих систем, что приводит не только к нарушению реакции организма на стресс, но и к возникновению заболеваний обмена веществ [10]. Ожирение после родов само по себе может рассматриваться как один из стрессорных факторов: женщины переживают за состояние фигуры, болезненно реагируют на появление обвисшего живота, огорчаются, что не удается восстановить прежнюю форму и т.п. [15].
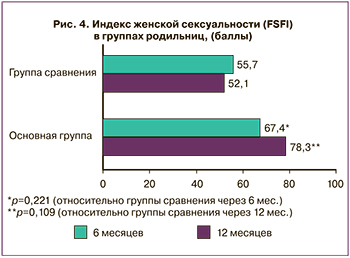 У всех пациенток был определен индекс женской сексуальной функции – Female Sexual Function Index (FSFI) через 6 месяцев и через год после родов. Оценивали либидо, возбуждение, любрикацию, достижение сексуального удовлетворения, наличие диспареунии. Женщины после прохождения программы реабилитации отмечали улучшение качества сексуальной жизни, оцениваемой путем расчета индекса женской сексуальности (рис. 4). Некоторые авторы отмечали, что у женщин с тяжелым ожирением (ИМТ> 35 кг/м2) ниже показатели желания, возбуждения, частоты оргазма [11]. Среди причин снижения сексуальности при ожирении можно выделить следующие: ухудшение внешнего вида (особенно после родов при оперативном родоразрешении), дисгормональные гипоталамо-гипофизарные нарушения, нарушение кровообращения, сосудистая патология (гипертония, варикоз), снижение или ограничение двигательной активности при лишнем весе, ограничение разнообразия поз в интимной жизни.
У всех пациенток был определен индекс женской сексуальной функции – Female Sexual Function Index (FSFI) через 6 месяцев и через год после родов. Оценивали либидо, возбуждение, любрикацию, достижение сексуального удовлетворения, наличие диспареунии. Женщины после прохождения программы реабилитации отмечали улучшение качества сексуальной жизни, оцениваемой путем расчета индекса женской сексуальности (рис. 4). Некоторые авторы отмечали, что у женщин с тяжелым ожирением (ИМТ> 35 кг/м2) ниже показатели желания, возбуждения, частоты оргазма [11]. Среди причин снижения сексуальности при ожирении можно выделить следующие: ухудшение внешнего вида (особенно после родов при оперативном родоразрешении), дисгормональные гипоталамо-гипофизарные нарушения, нарушение кровообращения, сосудистая патология (гипертония, варикоз), снижение или ограничение двигательной активности при лишнем весе, ограничение разнообразия поз в интимной жизни.
В программе реабилитации родильниц с ожирением заложена не только посильная физическая активность (не менее 10 000 шагов ежедневно), но и упражнения Кегеля для мышц тазового дна, которые, безусловно, оказали положительное влияние на улучшение тонуса и кровоснабжение мышц тазовой диафрагмы. Все это способствовало увеличению FSFI до 78,3 (0,92) балла у женщин основной группы (при р=0,221 через 6 месяцев; р=0,109 через 12 месяцев относительно группы сравнения в эти же сроки). Значимых отличий нами не выявлено, проблема требует дальнейшего изучения, так как интимная жизнь женщины значимо влияет на ее психологический комфорт и общее самочувствие.
Устранение избыточного веса – это не только улучшение внешнего вида пациентки, а еще и благоприятное влияние на изменение самочувствия и уменьшение выраженности неблагоприятных для здоровья факторов риска и заболеваний, коморбидных ожирению. По истечении года после родов нами выявлено снижение числа родильниц, страдающих неалкогольной жировой болезнью печени (по данным ультразвукового сканирования) в основной группе с 13/33 (39,4%) случаев сразу после родов до 7/33 (21,2%) случаев. В группе сравнения этот показатель остался прежним и составил 15/28 (53,6%). Известно, что даже при потере всего лишь 5% лишнего веса сокращаются затраты на медицинское обеспечение пациентов, обусловленное улучшением течения патологии, ассоциированной с ожирением [19]. В программе послеродовой реабилитации для снижения веса был назначен комплексный (сибутрамин+метформин) препарат «Редуксин Форте». Входящее в состав гипогликемическое средство способствовало повышению чувствительности рецепторов к инсулину и активизации углеводного обмена, что, вероятно, профилактировало развитие сахарного диабета у женщин основной группы, тогда как в группе сравнения эта патология развилась в 2/28 (7,1%) случаях (табл. 1). Предложенная нами программа послеродовой реабилитации позитивно воздействует на организм, улучшая физическое, психическое, соматическое и сексуальное здоровье женщины, что в целом свидетельствует об изменении качества жизни.
Заключение
Женщины, прошедшие послеродовую реабилитацию в течение 12 месяцев, снизили массу тела (в среднем на 7,68 кг), улучшили психологический статус (отсутствовал риск развития послеродовой депрессии и минимизировались проявления «материнской хандры»), каждая вторая пациентка (48,5%) достигла нормативных значений уровня витамина D в сыворотке крови. Программа реабилитации позволила улучшить соматическое здоровье родильниц: в 2 раза реже выявлялась неалкогольная жировая болезнь печени, не зарегистрировано случаев сахарного диабета. Особое внимание в послеродовом периоде всем специалистам, в большей степени акушерам-гинекологам, необходимо уделять пациенткам с ожирением после оперативного родоразрешения, т.к. они относятся к группе риска по развитию постнатального стресса. Предложенная комплексная программа послеродовой реабилитации для женщин с ожирением показала свою эффективность и может быть рекомендована к использованию в практическом здравоохранении. Результаты исследования позволяют говорить об улучшении качества жизни пациентов, прошедших реабилитацию, и открывают новые перспективы для дальнейших научных разработок.



