Вульвовагинальная атрофия (ВВА) – один из наиболее известных и широко распространенных физиологических процессов репродуктивного старения. Дефицит эстрогенов, возникающий в менопаузальном периоде, может привести к уменьшению и потере эластичности влагалищной стенки вместе с уменьшением выделений и истончением вагинального эпителия [1]. Урогенитальные симптомы – сухость влагалища, зуд, раздражение, жжение – усугубляются по мере снижения уровня эстрогенов [2]. ВВА сопровождается болезненными половыми контактами и провоцирует такие симптомы и состояния, как недержание мочи, ургентные позывы к мочеиспусканию, атрофический цистоуретрит. Среди пациенток с ВВА чаще встречаются урогенитальные инфекции [3], диспареуния, контактные кровянистые выделения, что существенным образом снижает качество жизни социально-активной категории женщин.
Наиболее часто ВВА встречается у женщин в постменопаузальном периоде. Учитывая неуклонно возрастающее количество женщин данного возраста в современном обществе, особенно в развитых странах, есть все основания предположить, что проблематика терапии ВВА с течением времени будет становиться все более актуальной.
По данным исследования в Северной Америке, большинство женщин проводит около 30% своей жизни в состоянии менопаузы [4], но до сих пор среди пациенток нет четкой осведомленности о целесообразности и возможностях лечения данного состояния.
Известно, что эстрогены являются основными регуляторами физиологических процессов во влагалище. Считается, что недостаток эстрогенов индуцирует пролиферацию соединительной ткани, фрагментацию эластических волокон, гиалинизацию коллагеновых волокон, что приводит к проявлению симптомов ВВА [5].
Таким образом, уровень коллагена, входящего в состав соединительной ткани влагалищной стенки и являющегося эстроген-чувствительной структурой, снижается по мере прогрессирования эстрогенного дефицита.
В исследовании Vicariotto et al. (2016) радиочастотную терапию получали 25 пациенток в двух группах (пациентки с синдромом релаксации влагалища и пациентки с ВВА/генитоуринарным менопаузальным синдромом (ГУМС)) соответственно, по 5 и 4 сеансов RF-лифтинга каждые 14 дней. Рабочая температура в тканях-мишенях влагалища во время процедуры: при синдроме релаксированного влагалища 42°C (диапазон 40–43°C); ВВА/ГУМС, 40°C (диапазон 40–42°C) [6]. В обеих группах у пациенток уменьшались беспокоящие их симптомы, в том числе дизурия/недержание мочи, и повышалось качество сексуальной жизни; при этом полученные результаты сохранялись в течение 12 месяцев наблюдения [7].
В 2020 г. Североамериканским сообществом по менопаузе (NAMS) опубликованы рекомендации по лечению ГУМС, в которых впервые указаны энергетические методы лечения, в том числе радиочастотное воздействие с уровнем доказательности С [5].
Одним из перспективных методов аппаратной коррекции ВВА/ГУМС является радиочастотная терапия (RF-лифтинг), которая довольно давно и весьма успешно применяется в эстетической хирургии и косметологии для устранения дефектов кожи лица и тела [8].
Радиочастотное устройство подает электромагнитные волны, конвертированные в тепло, вызывающие опосредованный нагрев тканей в соответствующей области. Терапевтическое воздействие обусловлено реактивацией функции фибробластов и соединительной ткани с развитием новых сетей коллагеновых и эластиновых волокон в субэпителиальных слоях преддверия и стенок влагалища [9]. Электромагнитное излучение воздействует, в основном, на дерму и подслизистый слой, которые состоят из клеток и матрикса, содержащего 60–70% воды. У взрослых около 70% внеклеточной воды связано с белками соединительной ткани (коллагеном, эластином и др.). Одной из фундаментальных особенностей коллагена является то, что в его составе содержится большое количество воды. Являясь весьма гидратированным белком, коллаген обладает электрическими и пьезоэлектрическими свойствами. Установлено, что вода играет существенную роль в механизме самосборки молекул коллагена, образовании фибрилл, а также в механизмах биохимической активности и функционирования коллагена во внеклеточном пространстве. Достижение биологического эффекта электромагнитных волн происходит за счет молекул воды в молекулах коллагена и эластина, при котором белки из функционально пассивного переходят в функционально активное состояние. В результате внутримолекулярных изменений происходит активизация гидратной воды, что, в свою очередь, вызывает конформационные структурные изменения в молекулах коллагена, который становится еще более гидратированным. И все эти молекулярные процессы приводят к повышению уровня метаболизма в клетках кожи и слизистых, в том числе и в фибробластах [10].
Радиочастотная терапия довольно давно применяется у женщин с синдромом стрессового недержания мочи и позволяет достигать хороших устойчивых клинических результатов [11]. Купирование синдрома недержания мочи сопровождалось положительными гистологическими изменениями и исчезновением симптомов ВВА/ГУМС у 70% пациенток [12].
В исследовании, проведенном в Бразилии в 2019 г., 55 женщин получали радиочастотную терапию по поводу ВВА/ГУМС. Средний возраст составил 59,8 ± 4,2 года, а средняя продолжительность менопаузы – 15,4±4,5 года. После лечения наблюдалось увеличение процентного содержания Lactobacillus spp., также наблюдалось постепенное снижение pH влагалища и улучшение индекса вагинального здоровья (ИВЗ): средние значения ИВЗ до и после лечения составили 13,2±5,6 и 22,5±3,7 соответственно [13].
Процедуры радиоволнового воздействия проводились при помощи устройства динамической квадриполярной радиочастоты (ДКРЧ) EVA (Novavision, Италия). Частота радиоволнового излучения в устройстве EVA составляет 1–1,3 МГц. Для лечения ВВА использовались два датчика – для вагинального воздействия и наружного воздействия на вульву.
Радиоволновое излучение подается в ткань посредством 4 электродов в виде колец, которые конфигурируются автоматически для обеспечения циркуляции радиочастотного потока между электродами. Они попеременно испускают и принимают волну, динамически меняя свою конфигурацию каждые 5 секунд в зависимости от выбранной программы на аппарате EVA.
Особый интерес в современной медицине имеет возможность таргетной доставки лекарственных препаратов в очаг поражения. Встроенная система ультраимпульсной радиопорации (UPR), представляющая собой функцию адаптации частоты радиоволн для открытия водных каналов клеток, облегчает трансслизистое и трансдермальное проникновение лекарственных веществ. UPR применяется для усиления терапевтического эффекта от процедуры с использованием лекарственных средств (например, крема с эстриолом при ВВА/ГУМС, крема с глюкокортикостероидами при склерозирующем лихене и др.) [14].
Благодаря использованию специального программного обеспечения для контроля подачи температуры при воздействии ДКРЧ процедура не вызывает ожогов и других нежелательных явлений.
В данном исследовании мы предположили, что воздействие ДКРЧ на слизистую влагалища и вульвы при ВВА может изменять метаболомный состав влагалища у женщин в менопаузе.
Целью данного исследования являлось изучение особенностей липидома цервико-вагинальной жидкости (ЦВЖ) у пациенток с ВВА в менопаузе при воздействии ДКРЧ.
Материалы и методы
В проспективное интервенционное исследование были включены 60 женщин.
Критерии включения в исследование: возраст от 45 до 65 лет (средний возраст 54±4,2 лет), длительность менопаузы более 1 года. Критерии исключения: неудовлетворительное состояние кожи и слизистых после ранее проведенных процедур лазерными, импульсными и низкочастотными RF-аппаратами (фиброз, истонченная «пергаментная» кожа), системные заболевания соединительной ткани, урогенитальные инфекции, травмы кожи и слизистых в области воздействия, онкологические заболевания в настоящее время и в анамнезе, предраковые заболевания вульвы, наличие кардиостимулятора, прием обезболивающих препаратов в день проведения процедуры.
Набор пациентов осуществлялся по обращаемости в отделение эстетической гинекологии и реабилитации ФГБУ «НМИЦ АГП им. В.И. Кулакова» с симптомами ВВА за период с сентября 2019 г. по август 2021 г. Все пациентки подписали информированное согласие для участия в исследовании. Проведение данного исследования было одобрено решением Комиссии по этике биомедицинских исследований ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Женщины были разделены на 3 группы с помощью электронных таблиц случайных чисел:
- 1-я группа – лечение с помощью воздействия ДКРЧ на область вульвы и влагалища, 4 процедуры с интервалом 2 недели;
- 2-я группа – лечение с помощью воздействия ДКРЧ на область вульвы и влагалища в режиме ультраимпульсной радиопорации с кремом, содержащим эстриола 0,5 мг, 4 процедуры с интервалом 2 недели;
- 3-я группа – локальная гормонотерапия кремом, содержащим эстриол 1 мг/1 г, по схеме: 0,5 мг интравагинально через день – 2 недели, далее 0,5 мг интравагинально 2 раза в неделю – до 8 недель.
Пациенткам, включенным в исследование, было проведено полное клинико-лабораторное обследование.
Взятие образцов ЦВЖ проводилось всем пациенткам до начала исследования и через 1 месяц после окончания лечения.
Экстракция липидов из ЦВЖ осуществлялось модифицированным методом Фолча: к 200 мкл ЦВЖ добавляли 1000 мкл CHCl3/MeOH 2/1 v/v и выдерживали в ультразвуковой ванне 10 минут. После выдержки в Vortex 10 секунд образец помещали в центрифугу на 5 минут при 15000 об/мин. Нижний органический слой 100 мкл перемещали в отдельную виалу. К оставшейся смеси добавляли 500 мкл CHCl3/MeOH 2/1 и центрифугировали в течение 5 минут при 15000 об/мин. Нижний органический слой 100 мкл перемещали к ранее отобранному и высушивали в потоке азота, после чего перерастворяли в 200 мкл IPA/ACN 1/1 о/о. Химические препараты, задействованные в экстракции, обладали чистотой LC-MS, производство Sigma Aldrich, США.
Липидные экстракты анализировали на жидкостном хроматографе Dionex UltiMate 3000 (Thermo Scientific, Германия), соединенном с масс-анализатором Maxis Impact qTOF с ЭРИ источником ионов (Bruker Daltonics, Германия). Разделение образцов осуществлялось методом обращенно-фазовой хроматографии на колонке Zorbax C18 (150×2,1 мм, 5 мкм, Agilent, США) с линейным градиентом от 30 до 90% элюента В (раствор ацетонитрил/изопропанол/вода, 90/8/2 о/о/о, с добавлением 0,1% муравьиной кислоты и 10 ммоль/л формиата аммония) за 20 минут. В качестве элюента А использовали раствор ацетонитрил/вода (60/40, о/о) с добавлением 0,1% муравьиной кислоты и 10 ммоль/л формиата аммония. Скорость потока элюирования была 40 мкл/мин, объем инжектируемого образца – 3 мкл. Масс-спектры получали в режиме положительных ионов в диапазоне m/z 100–1700 со следующими установками: напряжение на капилляре 4,1 кВ для режима положительных ионов, давление распыляющего газа 0,7 бар, скорость потока осушающего газа 6 л/мин, температура осушающего газа 200°C.
Статистический анализ
Обработка данных осуществлялась средствами свободно распространяемой программы MzMine 3.1 с выполнением идентификации липидов по базам LipidMaps (LMSD: LIPID MAPS structure database). Сравнение липидных профилей в первой и второй точке осуществлялось на основе критерия Вилкоксона. Сравнительный анализ изменения уровня липидов после лечения в каждой из групп осуществлялся на основе критерия Манна–Уитни. Граничным значением статистической значимости принималось 0,05. Описание уровней липидов осуществлялось в формате Me (Q1;Q3), где Ме – медианное значение, Q1 – значение первого квартиля, Q3 – значение третьего квартиля. Статистическая обработка данных осуществлялась средствами языка R 4.3.1 (R: A Language and Environment for Statistical Computing) в среде Rstudio (R Studio: Integrated Development for R).
Результаты
Возраст пациенток, включенных в исследование, варьировал от 46 до 65 лет и в среднем составил 54,8 (5,1) года. Продолжительность менопаузы у пациенток колебалась от 1 года до 18 лет и в среднем составила 5,4 (3,3) года. Клинико-анамнестические данные пациенток, включенных в исследование, представлены в таблице 1.
При радиочастотном воздействии ДКРЧ (группа 1) наблюдали различия в уровне одного соединения PG 12:0/18:4(6Z,9Z,12Z,15Z) в режиме положительных ионов (табл. 2).
При комбинации радиочастотного воздействия ДКРЧ в режиме ультраимпульсной радиопорации (далее УРП) с эстрогенами (группа 2) наблюдали различия в уровне четырех соединений (Анандамид (18:2, n-6), LTB4 диметиламид, N-гидрокси арахидоноиламин, Виродамин) в режиме положительных ионов (табл. 3) и для одного соединения (13E,15E,18Z,20Z-пентакозатетраен-11-инил ацетат) в режиме отрицательных ионов (табл. 4).
При этом в 3-й группе, на которую воздействовали только эстрогенами, различия были в уровне LTB4-диметиламида, уровень которого также уменьшался в группе 2 (табл. 5).
При сравнении результатов после лечения у женщин 1-й группы (ДКРЧ) и 3-й группы (локальные эстрогены) в режиме положительных ионов было выделено 3 соединения (DG 18:0/16:0/0:0; LTB4-диметиламид; PC 12:0/14:1(9Z)), уровни которых статистически значимо меньше изменялись в группе 3 (табл. 6); при этом для PC 12:0/14:1(9Z) было характерно противоположное изменение уровня в группе 3 относительно группы 1.
При сравнении результатов после лечения среди женщин 1-й и 2-й групп в режиме положительных ионов было выделено 1 соединение – Анандамид (18:2, n-6) (табл. 7), уровень которого повышался после лечения в группе 1.
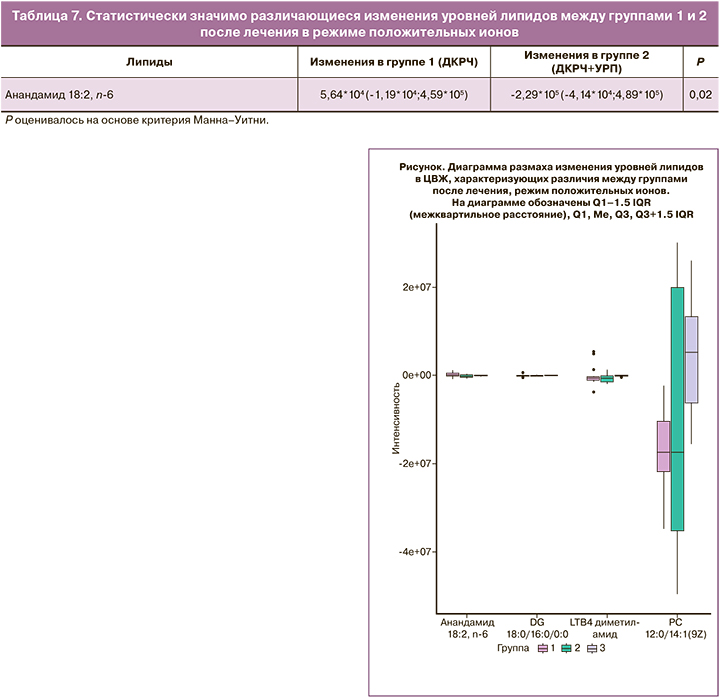
На диаграмме размаха (рисунок) видно, что метаболомный профиль после проведенного лечения 1-й группы отличается от профилей 2-й и 3-й групп.
Обсуждение
В данной работе нами были впервые обнаружены и описаны различия в липидомном составе ЦВЖ у женщин с ВВА, получавших лечение с помощью ДКРЧ.
Особое внимание в липидном профиле привлекают липиды анандамид и виродамин, значимое увеличение которых было обнаружено в 1-й группе, получавшей монотерапию с помощью ДКРЧ. Данные вещества являются производными арахидоновой кислоты, эндогенными каннабиноидными нейротрансмиттерами, биологически активными липидами, которые активируют каннабиноидные рецепторы CB1, СВ2.
Каннабиноидный рецептор 1 (CB1) был идентифицирован в 1990 г., за ним следует каннабиноидный рецептор 2 (CB2) – в 1993 г. Первым выделенным эндоканнабиноидом стал этаноламид арахидоновой кислоты, также называемый анандамидом (AEA) (от санскр. «ананда», что означает «блаженство»). Современные данные показывают, что каннабиноидные рецепторы экспрессируются в клетках репродуктивной системы, включая стромальные клетки эндометрия, эпителия влагалища, яичники и сперматозоиды [15]. Внутриклеточные сигналы, возникающие из взаимодействия с каннабиноидными рецепторами CB1 и CB2, впоследствии приводят к регуляции роста клеток, пролиферации и/или дифференцировки тканей. Таким образом, мы предполагаем, что улучшение трофики тканей влагалища и повышение удовлетворенности сексуальной жизнью у пролеченных женщин на фоне нивелирования симптомов ВВА, в том числе, связаны с активацией рецепторов СВ1 и СВ2. Интересным является тот факт, что в группах с применением локальных эстрогенов (эстриола) данный эффект был ниже.
С развитием доказательной медицины стало очевидно, что эффективность и безопасность системной гормональной терапии при ВВА/ГУМС переоценена. Прежде всего, такая терапия не показана ряду категорий пациенток, например, при гормонозависимом раке репродуктивной системы и молочных желез (в том числе в анамнезе), пациенткам с нормальным уровнем эстрогенов, при высоком риске тромбозов, острой или хронической печеночной недостаточности, инфаркте миокарда в анамнезе и др. [16].
Заключение
Терапия ГУМС/ВВА путем воздействия ДРКЧ является эффективным и безопасным методом лечения для женщин, которые по тем или иным причинам не могут использовать гормональную терапию.
В настоящее время исследование продолжается с целью оценки продолжительности достигнутого клинического эффекта.



