Как известно, преэклампсия (ПЭ) является мультисистемным патологическим состоянием, возникающим во второй половине беременности (после 20-й недели), характеризующимся артериальной гипертензией в сочетании с протеинурией (≥0,3 г/л в суточной моче), нередко, отеками и проявлениями полиорганной/полисистемной дисфункции/недостаточности [1, 2].
Несмотря на активное изучение патофизиологических процессов, связанных с ПЭ, до сих нет однозначных представлений об этиологии этого заболевания. Неизвестно, что в патогенезе ПЭ является причиной, а что – следствием. Существуют различные версии того, какие факторы могут связывать первую и вторую стадию патогенеза заболевания. Не исключено, что в разных случаях, действительно имеют место различные механизмы [3, 4].
Важным компонентом антиоксидантной защиты является система детоксикации ксенобиотиков. Она включает метаболические каскады, осуществляющие реакции модификации, конъюгации и экскреции потенциально опасных для организма веществ [5]. Данные об экспрессии генов GPX в плаценте при ПЭ различаются. В исследовании, проведенном в НЦАГиП им. В.И. Кулакова Минздрава России в 2014 году. Было выявлено значимое увеличение экспрессии GPX в плацентах женщин с ПЭ в 36,4% случаев [6]. По данным других авторов, экспрессия GPX-1, GPX-3, GPX4 в плаценте при ПЭ значимо снижена по сравнению с нормой [7, 8].
Цель исследования: изучить значимость полиморфизмов генов системы детоксикации в развитии ПЭ с созданием модели прогнозирования.
Материал и методы исследования
В исследование была включена 241 пациентка, каждая из которых поступила и была родоразрешена в ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России. Все женщины были разделены на 3 группы: группа 1А – пациентки с ранней ПЭ (наступившей до 34 недели беременности), 1Б – пациентки с поздней ПЭ (наступившей начиная с 34 недели беременности), 2 – контрольная группа. Численность групп составила, соответственно, 43, 49 и 149 женщин. Диагноз ПЭ устанавливался в соответствии с критериями, обозначенными в Федеральных клинических рекомендациях «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия» [1].
Контрольная (2) группа была сформирована методом подбора пар по 2 показателям: месту проживания (городская/сельская местность) и социальному статусу (уровень дохода). Это было обусловлено необходимостью уменьшить влияние средовых вмешивающихся факторов и приблизить выборку к условиям генеральной совокупности российских женщин, поскольку поступающие в федеральный центр пациентки приезжают из разных регионов и не являются репрезентативным отображением популяции женщин Российской Федерации.
Критериями включения в исследование были одноплодная беременность, отсутствие резус-конфликта в текущей беременности, отсутствие использования донорской яйцеклетки, отсутствие онкологических заболеваний, трансплантации внутренних органов в анамнезе, а также подписание женщиной информированного согласия на включение в исследование.
Критериями исключения из исследования были наличие острых или обострение хронических воспалительных заболеваний в момент родов (хориоамнионит, генитальный герпес, ОРВИ, кольпит и др.) в связи с влиянием этих заболеваний на результаты лабораторных методов исследования. Кроме того, из анализа были исключены женщины, не предоставившие полной информации о данных анамнеза.
Все женщины были обследованы в соответствии с приказом Минздрава России от 12 ноября 2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология» (за исключением использования вспомогательных репродуктивных технологий)».
Проведено одномоментное исследование в параллельных группах: генетический анализ (полимеразная цепная реакция (ПЦР) с анализом кривых плавления) у пациенток с ПЭ и у женщин с физиологически протекающей беременностью.
Были исследованы полиморфизмы следующих генов: GSTP1, rs8191450; GSTP1, rs1138272; GPX1, rs1050450; EPHX1, rs1051740; EPHX1, rs2234922; SOD2, rs4880; CYP1A1, rs1799814; CYP1A1, rs1048943; CYP1A1, rs4646903; SULT1A1, rs9282861; NAT2, rs1801280; NAT2, rs1799930; NAT2, rs1799931; NAT2, rs1801279; а также делеция генов GSTT1 и GSTM1.
Генотипирование проводили методом ПЦР с анализом кривых плавления модифицированным методом «примыкающих проб» (adjacent probes, kissing probes) в лаборатории молекулярно-генетических методов с помощью коммерческих тест-систем ООО «НПО ДНК-Технология», Россия. При идентификации замен одиночных нуклеотидов вначале проводили ПЦР с праймерами, общими для обоих вариантов нуклеотидной последовательности, затем понижали температуру реакционной смеси для гибридизации полученной матрицы с олигонуклеотидными пробами. Для определения варианта последовательности использовали два типа олигонуклеотидов, гибридизующихся на матрицу рядом. Первый тип олигонуклеотидов метили флуорофором, второй – гасителем флуоресценции. Для предотвращения неспецифического отжига праймеров и повышения чувствительности тест-систем использовали Taq-полимеразу, блокированную специфическими антителами.
В ходе генотипирования использовался 1 общий олигонуклеотид с гасителем флуоресценции, а также 2 сиквенс-специфичных олигонуклеотида, несущих различные флуорофоры. Олигонуклеотидные пробы, соответствующие тому или иному варианту последовательности, метили различными флуорофорами, что позволило определять оба варианта в одной пробирке. После проведения ПЦР и гибридизации измеряли уровень флуоресценции в ходе температурной денатурации дуплексов олигонуклеотидов и полученных матриц в режиме реального времени. Определение генотипа проводилось путем анализа кривых плавления. Если анализируемый образец содержал только один вариант нуклеотидной последовательности гена, то есть был гомозиготен по данному полиморфизму, температура плавления для пробы, образующей совершенный дуплекс, была существенно выше, нежели для пробы, образующей несовершенный дуплекс. Если же анализировали гетерозиготный образец, содержащий оба варианта нуклеотидной последовательности, каждый из вариантов проб мог образовать совершенный дуплекс, поэтому температуры их плавления были практически одинаковы.
Дезоксирибонуклеиновую кислоту (ДНК) для генотипирования выделяли из образцов периферической крови взятой с этилендиаминтетрауксусной кислотой (ЭДТА) в качестве антикоагулянта с помощью комплекта реагентов «Проба-ГС-генетика» ООО «НПО ДНК-Технология», Россия. Метод основан на использовании для лизиса клеток сильного хаотропного агента с последующей сорбцией нуклеиновых кислот на твердом носителе, последовательных отмывках сорбента и элюции ДНК с сорбента. Объем образцов после выделения составил 100 мкл. Концентрация ДНК определенная на ДНК-минифлуориметре («Ноеfer», США), составляла, в среднем 50–100 мкг/мл.
ПЦР и определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора ДТ-964 (ООО «НПО ДНК-Технология», Россия).
Для качественных данных производился расчет отношения шансов (ОШ) в связи с намерением установления причинно-следственной связи. Сравнение качественных данных между двумя и более группами производилось с помощью теста χ2, а в случае небольших выборок – точный критерий Фишера.
Результаты исследования и обсуждение
Средний возраст включенных в исследование женщин составил 32,6±5,3; 31,9±5,9; 30,5±5,6 года (р=0,0198) в группах соответственно. Анализ антропометрических данных не выявил статистически значимых различий между группами. Изучение менструальной функции (возраст менархе, длительность менструального цикла, продолжительность менструального кровотечения) также не установило статистически значимых различий (ANOVA, p>0,05). Анализ гинекологической заболеваемости и данных о частоте оперативных вмешательств на органах малого таза (сальпингоовариолизис, тубэктомия, диатермокоагуляция яичников, цистэктомия, миомэктомия, полипэктомия) не выявил статистически значимых различий. Аналогичные результаты были получены при оценке акушерского анамнеза, структуры сопутствующих экстрагенитальных заболеваний (кроме хронической артериальной гипертонии (ХАГ)) также значимо не отличалась между группами.
При сравнении пациенток с ПЭ с контрольной группой при проведении однофакторного анализа было выявлено лишь 2 фактора риска, считающихся доказанными, а именно ХАГ и возраст женщины. При этом возраст был представлен в виде бинарной переменной с нахождением порога отсечки (>36 лет), при которой созданная модель была максимально достоверной (ROC анализ, площадь под кривой (AUC=64,6%)). Погранично значимой оказалась корреляция ПЭ с беременностью, наступившей после применения вспомогательных репродуктивных технологий [9].
Вместе с тем, нам не удалось обнаружить связь с такими принятыми факторами риска ПЭ, как первые роды, ожирение и заболевания почек. Невозможность получить статистически значимые данные о связи ПЭ с многоплодием, семейным анамнезом ПЭ, наличием тромбофилии в анамнезе, сахарным диабетом, системной красной волчанкой, по-видимому, объясняется небольшим количеством пациентов с наличием данных факторов риска в выборке.
Изучение распределения полиморфизмов установило, что при сравнении группы 1 (ПЭ) и группы 2 (контрольной группы) значимо отличались частоты аллелей полиморфизма rs4646903 гена CYP1A1: у женщин, больных ПЭ, чаще встречался аллель С, чем у женщин контрольной группы (p<0,05). Интересным является тот факт, что такие результаты были получены впервые. Следует отметить, что в работах других авторов связи между данным полиморфизмом и ПЭ выявлено не было [10–12]. На основании распределения генотипов этого полиморфного локуса можно предположить аутосомно-доминантное наследование предрасположенности к ПЭ, ассоциированное с аллелем С (ОШ=2,1 (1,1–3,9), p=0,024).
Также погранично значимыми оказались данные о связи между ПЭ и генотипом CC полиморфного локуса rs1051740 гена EPHX1 (p=0,061), а также аллелем G полиморфного локуса rs8191450 гена GSTP1 (р=0,083). Примечательно, что ген EPHX1 в большей степени ассоциирован с ранней, чем с поздней ПЭ (табл. 1). Cвязи ПЭ с полиморфизмами, описываемыми другими исследователями [13, 14], в нашей работе выявлено не было.
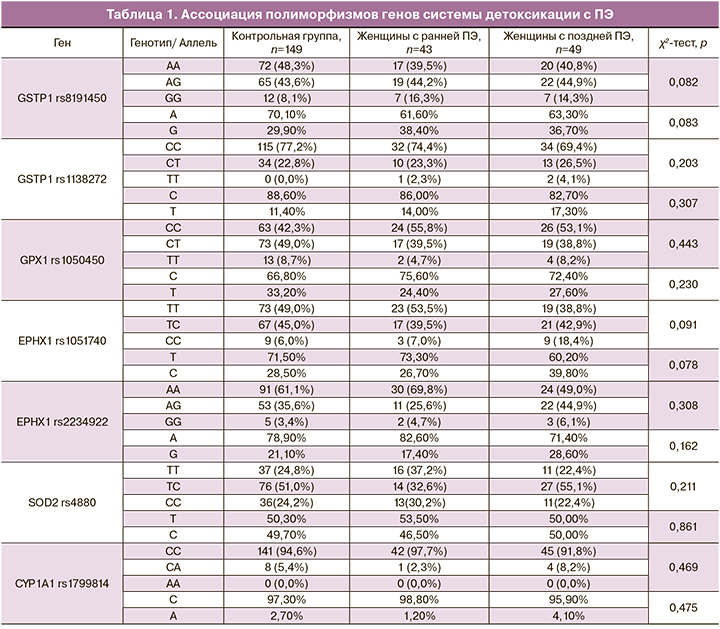
Полученные ассоциации были в дальнейшем оценены с помощью многофакторного анализа. Анализ частоты делеций генов GSTM1 и GSTT1 не привел к получению статистически данных различий между группами (табл. 2).

Мы предполагаем, что небольшое количество полученных значимых ассоциаций может быть связано с небольшим объемом выборки.
С целью уменьшения ошибки, вызванной действием вмешивающихся факторов (конфаундеров), был проведен многофакторный анализ с помощью логистической регрессии.
На основании данных многофакторного анализа была построена формула (формула 1) для расчета индивидуального риска ПЭ на основании генетических и клинико-анамнестических факторов риска. На увеличение вероятности ранней ПЭ оказывали влияние старший возраст пациенток, больший индекс массы тела (ИМТ), наличие ПЭ и воспалительных заболеваний органов малого таза в анамнезе и полиморфизм rs4646903 гена CYP1A1 (формула 1). Возраст и ИМТ рассматривались как бинарные переменные, принимающие значение 1 при превышении порога отсечки и 0 в остальных случаях. В качестве порогов отсечки для возраста было выбрано значение 30 лет, для ИМТ – 27 кг/м2.
Формула 1. Вероятность развития ПЭ в зависимости от выявленных факторов риска.
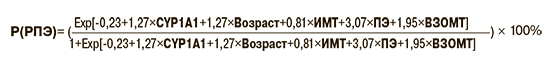
где: CYP1A1 – наличие аллеля С в локуса rs4646903 у пациентки, Возраст – возраст ≥30 лет, ИМТ – ИМТ>27, ПЭ – наличие преэклампсии в анамнезе, ВЗОМТ – наличие хронических воспалительных заболеваний органов малого таза, Exp – экспонента.
Например, пациентка в возрасте 35 лет с ИМТ=30, ПЭ в анамнезе, наличием ВЗОМТ и генотипом CYP1A1_CC имеет вероятность развития ПЭ:

А пациентка в возрасте 25 лет с ИМТ=25, без ПЭ и ВЗОМТ в анамнезе и генотипом CYP1A1 ТТ имеет вероятность развития ПЭ:

ОШкор развития ранней ПЭ под влиянием полиморфизма EPHX1 с учетом возраста, ИМТ, наличия ПЭ и ВЗОМТ в анамнезе составило 3,6 (95% ДИ=1,3; 9,7).
Заключение
Таким образом, полиморфизм генов системы детоксикации относится к возможным патогенетическим факторам развития ПЭ, что обосновывает возможность использования генотипирования для предикции развития данного осложнения. В данной работе на основании изучения 16 однонуклеотидных полиморфизмов генов системы детоксикации были выявлены значимые ассоциации с ранней и поздней ПЭ, часть из которых подтвердили свою значимость в многофакторном анализе и были включены в модель для расчета индивидуального риска развития ПЭ.



