По данным разных авторов, эндометриоз встречается у 10–16% женщин раннего репродуктивного возраста, проявляется хронической тазовой болью, дисменореей и бесплодием в дальнейшем [1, 2]. Точная распространенность эндометриоза у подростков неизвестна, но как минимум у двух третей девочек с хронической тазовой болью, устойчивой к нестероидным противовоспалительным препаратам (НПВП) или комбинированным оральным контрацептивам (КОК), при диагностической лапароскопии выявляется эндометриоз в малом тазу [2]. В настоящее время наблюдается омоложение тяжелых форм распространенного эндометриоза, значимо снижающего качество жизни пациенток и требующих зачастую повторных серьезных оперативных вмешательств, в том числе в раннем репродуктивном возрасте. Распространенность эндометриоза среди подростков была оценена в систематическом обзоре Janssen E. et al. на основании 15 исследований, проведенных с 1980 по 2011 гг., в которые вошли 880 девочек-подростков с дисменореей или тазовой болью; эндометриоз был подтвержден в 62% случаях при лапароскопии [3].
В связи с растущей распространённостью и прогрессирующим характером заболевания особенно актуальна его ранняя диагностика. В среднем от момента появления первых симптомов до постановки диагноза проходит 5–10 лет; при этом подростки ожидают помощи в три раза дольше взрослых женщин (6,0±0,2 против 2,0±0,3 лет, p<0,0001) [1, 2, 4]. Трудность диагностики эндометриоза у подростков обусловлена неспецифичной клинической картиной, отсутствием неинвазивных тестов, сложностью обнаружения начальных форм заболевания с помощью инструментальных методов. Ballweg M. et al., проанализировав данные пациенток с эндометриозом в раннем репродуктивном возрасте, пришли к выводу, что задержка постановки диагноза во многом связана с тем, что врачи не готовы ставить диагноз «эндометриоз» в раннем возрасте; и прежде, чем был установлен правильный диагноз, пациентки проходили обследование четырьмя и более врачами [5]. Наличие воспалительных, нейроэндокринных, хронических коморбидных состояний, что также зачастую характерно для пациенток подросткового возраста, еще более затрудняет диагностику [6].
Эндометриоз у взрослых женщин в основном характеризуется циклической тазовой болью, однако, у девочек боль может иметь как циклический, так и ациклический характер [5]. В раннем репродуктивном возрасте наряду с классическими симптомами, такими как дисменорея, диспареуния, дисхезия, нередко наблюдаются нетипичные симптомы эндометриоза, а именно, расплывчатые абдоминальные симптомы, расстройства функционирования желудочно-кишечного тракта и мочеполовые симптомы. Показано, что классические симптомы циклической боли испытывают лишь 9,4% подростков [5, 7].
Известно, что стадия заболевания не имеет четкую корреляцию с наличием или тяжестью симптомов, при этом ни один симптом не является специфичным для эндометриоза [8, 9]. Боль в области таза у пациенток с эндометриозом имеет спастический или ноющий характер, обычно начинается за 1–2 дня до начала менструаций, сохраняется на протяжении первых 3–4 дней менструальных выделений и может продолжаться в течение нескольких дней после менструации [10]. Общие симптомы эндометриоза у молодых женщин включают также хроническую тазовую боль, которая, в отличие от дисменореи, длится от 6 месяцев и дольше и может быть постоянной, прерывистой, циклической или ациклической. Кроме того, при эндометриозе могут встречаться такие симптомы, как дисфункция кишечника и мочевого пузыря, аномальные маточные кровотечения, обильные менструальные выделения, боль в пояснице, хроническая усталость, головные боли, головокружение. Симптомы со стороны желудочно-кишечного тракта могут включать вздутие живота, запор, диарею, тошноту, боль во время или после дефекации. Нарушение функции мочевой системы может включать дизурию, гематурию и разлитую боль в области поясницы [11].
Во многих исследованиях оценивалась диагностическая ценность биомаркеров эндометриоза, но на сегодняшний день нет надежных рекомендуемых параметров в ткани эндометрия, менструальных или маточных жидкостях и иммунологических показателей в крови или моче для клинического использования в качестве диагностического теста на эндометриоз [12]. Учитывая хронический характер заболевания и значимое влияние на репродуктивную функцию, овариальный резерв, на социальный, психологический статус и качество жизни молодых пациенток, основная задача на сегодняшний день заключается как можно в более раннем выявлении заболевания и своевременном начале патогенетической терапии.
Цель исследования: изучить клинико-диагностические особенности разных форм эндометриоза у девочек подросткового возраста.
Материалы и методы
Проведено исследование «случай–контроль» на базе 2-го гинекологического отделения детского и юношеского возраста ФГБУ «НМИЦ АГП им. акад. В.И. Кулакова» Минздрава России. В исследование были включены 98 пациенток с подтвержденным диагнозом генитального эндометриоза, наблюдавшиеся с 2016 г. по февраль 2022 г. Группу сравнения составили 44 соматически здоровые девочки аналогичного возраста с регулярным менструальным циклом без гинекологической и эндокринной патологии. Исследование было одобрено Комиссией по этике биомедицинских исследований Центра, получено информированное согласие пациенток и их законных представителей на включение в исследование, использование персональных данных и публикацию полученных результатов.
Критерии включения в основную группу исследования: возраст больных от менархе до 18 лет; клиническая симптоматика жалоб на стойкую дисменорею и хроническую тазовую боль, устойчивую к действию НПВП и спазмолитических препаратов; подтвержденный диагноз разных форм генитального эндометриоза (по данным ультразвукового исследования (УЗИ), магнитно-резонансной томографии (МРТ) и лапароскопической картины); отсутствие приема лекарств за последние 3 месяца до начала исследования, в том числе КОК; информированное согласие пациентов на включение в исследование.
Критерии исключения общие: возраст более 18 лет; соматическая, эндокринная патология, онкологические заболевания, инфекционные заболевания; отсутствие дисменореи и/или хронических тазовых болей (для основной группы); пороки развития половых органов, связанные с нарушением оттока менструальной крови; отсутствие информированного согласия.
Основная группа была затем разделена на 3 подгруппы в зависимости от формы генитального эндометриоза: 1-я подгруппа – девочки с наружным генитальным эндометриозом (НГЭ) брюшины (n=65); 2-я – девочки с аденомиозом (АДМ) (n=15); 3-я – девочки с эндометриоидными кистами (ЭК) (n=18).
Методы исследования включали анализ расширенного клинико-инструментального обследования:
- клинико-анамнестические данные: жалобы, анамнез беременности и родов матери, отягощенность наследственности, клиническая картина заболевания;
- клинико-лабораторные данные: общий анализ крови; биохимический анализ крови: общий белок, глюкоза, мочевина, креатинин, билирубин общий и прямой, С-реактивный белок; гормональный профиль крови на 2–4-й день менструального цикла: тиреотропный гормон (ТТГ), лютеинизирующий гормон (ЛГ), фолликулостимулирующий гормон (ФСГ), пролактин, эстрадиол, тестостерон, кортизол, антимюллеровый гормон (АМГ), андростендион, дегидроэпиандростерона-сульфат (ДГА-С), антитела к тиреоидной пероксидазе (АТ-ТРО), глобулин, связывающий половые гормоны (ГСПГ), онкомаркеры СА-125, СА-19-9;
- данные инструментальной диагностики: УЗИ органов малого таза на 5–7-й день менструального цикла и МРТ органов малого таза накануне менструации (с 25-го дня менструального цикла), данные лапароскопической картины (хирургический диагноз, вид, размеры очагов и площадь поражения);
- данные гистологического исследования операционного материала (макро- и микроскопическое описание).
Статистический анализ
Статистическая обработка данных проводили в среде пакета Excel (Microsoft) и с помощью программы Statistica 8 (Statsoft Inc.). Оценка категориальных переменных произведена с вычислением частот и долей (%), для сравнения различий использовали таблицы сопряженности, χ2 тест, точный критерий Фишера. При сравнении средних значений величин при нормальном распределении переменных и гомогенности дисперсий в двух независимых выборках применяли параметрический t-критерий Стьюдента. Статистически значимыми считали различия при уровне достоверности р<0,05. Оценку различий между двумя группами при непараметрическом распределении количественных переменных независимых выборок проводили с помощью U-критерия Манна–Уитни. Сравнение переменных в нескольких независимых группах, имеющих нормальное распределение, проводили методами дисперсионного анализа (ДА) ANOVA, при ненормальном распределении использовали критерий Краскела–Уоллиса. Сравнение попарно множества групп при нормальном распределении производили с помощью пост-хок метода апостериорных множественных сравнений (наименьшей значимой разницы ((Least Significant Difference test (LSD)) и с помощью апостериорного критерия Данна при непараметрическом распределении. Для проверки корреляций между показателями использовали коэффициент корреляции Пирсона при линейной зависимости, при непараметрическом распределении – коэффициент ранговой корреляции Спирмена и коэффициент конкордации Кендалла в случае, если переменных было больше двух. Оценка факторов риска произведена методами многофакторного анализа с использованием логистической регрессии, расчетом скорректированного отношения шансов (ОШ) и доверительного интервала (ДИ), а также методами факторного ДА ANOVA для анализа эффектов взаимодействия категориальных независимых факторов.
Результаты
По клинико-анамнестическим данным пациентки основной группы в сравнении со здоровыми девочками значимо чаще характеризовались отягощением наследственности по эндометриозу и другим гинекологическими заболеваниями (миома матки, аномальные маточные кровотечения, гиперплазия эндометрия) у родственников (32/98 (32,7%) против 4/44 (9,1%), р<0,001; χ2-тест). Также в группе пациенток основной группы значимо чаще отмечены осложнения течения беременности у матерей пациенток (угроза прерывания беременности, токсикоз, преэклампсия) в 76/98 (77,6%) в сравнении с 16/44 (36,4%) в группе здоровых девочек (р=0,047, χ2-тест с поправкой Йейтса), что отражено в таблице 1.
По данным индекса массы тела пациентки основной группы и группы сравнения значимо не отличались (20,5±3,74 против 20,3±5,8 кг/м2, р=0,54). Основная жалоба пациенток основной группы была на выраженную дисменорею, устойчивую к действию обезболивающих и спазмолитических препаратов (73/98 (75,3%)); в группе сравнения пациентки не отмечали жалобы на устойчивую дисменорею тяжелой степени (р<0,001, χ2-тест). Девочки из контрольной группы в 6/44 (13,6%) случаях характеризовались функциональной дисменореей, не требовавшей повторных приемов обезболивающих препаратов, максимальной интенсивностью до 4–7 баллов по визуально-аналоговой шкале (ВАШ) в первый день менструации; при этом боль легко снималась после однократного приема НПВП. Пациентки с эндометриозом отмечали боль до 8–9 баллов (ВАШ) и описывали менструальную боль, как резкие пульсирующие ощущения внизу живота, в среднем появляющиеся за день до начала выделений и длящиеся первые 3 дня (40,8%); периодически боль внизу живота не была связана с менструальным циклом (13,4%).
У девочек с эндометриозом средний возраст менархе оказался меньше (11,8±2,49 лет), чем у здоровых девочек (12,5±1,19 лет) в среднем на 8 месяцев (р<0,001; t-тест). Нерегулярные менструации в основной группе встречались значимо чаще, по сравнению со здоровыми девочками: 42 (42,9%) против 7 (15,9%) (р=0,002, χ2-тест). Кроме того, пациентки с эндометриозом значимо чаще отмечали обильные менструальные выделения в сравнении с группой здоровых девочек: 17 (32,1%) против 4 (10,5%) (р=0,034, χ2-тест).
При анализе данных клинико-анамнестической картины методами многофакторного анализа было подтверждено, что к значимым факторам риска развития эндометриоза у девочки относится отягощение наследственности по эндометриозу и другим гинекологическим заболеваниям у родственников (ОШ 4,85, ДИ1,58; 14,87, р=0,005) и наличие болезненных менструаций с менархе (ОШ 19,30, ДИ=7,19; 51,60, р<0,001).
По данным общего анализа крови пациентки с эндометриозом в сравнении со здоровыми подростками характеризовались более высоким уровнем эозинофилов (2,6±2,15 против 1,9±2,15, р=0,042, Манна–Уитни тест).
Особый интерес представлял уровень маркеров воспаления, а именно сравнение в группе пациенток с эндометриозом и здоровых девочек уровня лейкоцитов (6,5±1,82 против 6,9±2,36, р=0,392, Манна–Уитни тест), СОЭ (3,4±2,15 против 3,3±1,60, р=0,804, Манна–Уитни тест) и С-реактивного белка (0,9±0,99 против 1,0±0,91, р=0,393, Манна–Уитни тест), однако значимой разницы по этим параметрам не выявлено.
Анализ гормонального профиля показал, что группы значимо не отличались по большинству показателей, кроме повышенного в основной группе в сравнении с контрольной группой уровня ЛГ (8,3±6,72 против 4,1±1,96, р<0,001), эстрадиола (335,2±292,28 против 171,5±73,95, р=0,032), 17-ОН прогестерона (5,8±3,63 против 3,9±1,84, р=0,022), общего андростендиона (10,8±4,27 против 8,4±2,45, р=0,013) и пролактина (481,2±312,42 против 237,8±126,43, р<0,001), что представлено в таблице 2.
Проведенный многофакторный анализ показал, что более высокий уровень ЛГ (ОШ 0,09, ДИ=0,02;0,37, р<0,001) и андростендиона (ОШ 1,23, ДИ=1,05; 1,42, р=0,01), а также их сочетание (ОШ 0,09, ДИ= 0,02; 0,37, р<0,001) значимо повышает риск возникновения эндометриоза у девочек.
Для пациенток с эндометриозом были характерны более высокие, но не превышающие верхней границы нормы (35 ед/л), показатели СА-125. При сравнении с группой контроля значимых отличий по показателям онкомаркеров Са-125 (31,4±55,80 против 19,6±9,93, р=0,469), СА19-9 (10,01±9,49 против 6,53±2,39, р=0,746), НЕ-4 (49,23±9,72 против 50,21±2,31, р=0,889), РЭА (1,14±1,61 против 2,5±1,78 р=0,899) выявлено не было.
По данным УЗИ у девочек с эндометриозом в сравнении с контрольной группой М-эхо оказалась значимо больше (0,8±0,33 против 0,5±0,32 см, р<0,001), что, вероятно, может быть следствием местной гиперэстрогении при эндометриозе. При проведении сравнительного анализа параметров матки по данным УЗИ статистически значимое различие было выявлено в большей толщине матки у пациенток с эндометриозом в сравнении со здоровыми девочками (3,3±0,83 против 2,9±0,51, р=0,001). При сравнении длины, толщины, ширины и объема яичников между группами пациенток с эндометриозом без ЭК и в группе здоровых девочек значимых различий не выявлено.
Далее каждую из подгрупп пациенток с генитальным эндометриозом сравнили с группой контроля и между собой. Единственным анамнестическим фактором, значимым для всех подгрупп, оказалось указание на дисменорею с менархе (НГЭ1 – 76,92%, АДМ2 –66,67%, ЭК3 –76,47% против 13,64% в группе сравнения, р1,4<0,001, р2,4<0,001, р3,4<0,001, соответственно). Пациентки с НГЭ в сравнении со здоровыми девочками отличались отягощением гинекологической наследственности по эндометриозу у родственников (38,46% против 9,09% р=0,001), более обильными менструальными выделениями у девочки (41,18% против 10,53%, р=0,003) и нерегулярным менструальным циклом (43,08% против 15,91%, р=0,003), а также значимо более высоким уровнем ЛГ (9,1±7,39 против 4,1±1,96, р<0,001), ФСГ (6,0 ±2,02 против 5,0± 1,77, р=0,028), 17-ОН прогестерона (6,1±3,68 против 3,9±1,84, р=0,038) в периферической крови. В группах пациенток с НГЭ и ЭК отмечен значимо высокий уровень пролактина в сравнении с группой контроля (499,4±336,72, р1,4<0,01 и 566,6±256,12 против 237,8±126,43, р3,4=0,01, соответственно). Данные УЗИ свидетельствуют о более высоких показателях толщины матки в группе пациенток с НГЭ1 и ЭК3 в сравнении с группой контроля 4 (3,2±0,57 и 3,8±1,45 против 2,9±0,51, р1,4=0,047 и р3,4=0,001) и М-ЭХО (0,7±0,31 и 0,9±0,40 против 0,5±0,32, р1,4<0,01 и р3,4<0,01), что подтверждает гиперэстрогенный фон у пациенток данных подгрупп.
По данным УЗИ органов малого таза подозрение на НГЭ было установлено всего в 3,2% (3/94) случаев, АДМ – в 8,5% (8/94), ЭК – в 14,9% (14/94). По данным МРТ, которое было проведено всего 49 пациенткам, подозрение на НГЭ устанавливалось в 79,6% (39/49), на АДМ – в 48,9% (24/49), на ЭК – в 10,2% (5/49) случаях.
Особое внимание мы уделили анализу описания МРТ органов малого таза и сравнили локализацию, выявленную по данным МРТ и при выполнении лапароскопии для дальнейшего выявления ранних признаков НГЭ у подростков. К наиболее значимым признакам НГЭ по данным МРТ с использованием факторного анализа у подростков при диагностике заболевания инструментальными методами отнесли: наличие скудного количества свободной жидкости в Дугласовом пространстве (87,2%, F=19,9 p<0,001), спаечный процесс в малом тазу, фиксация маточной трубы, кишки, яичников (56,4%, F=9,52 р=0,002), неоднородность параовариальной, параметральной, парацервикальной клетчатки, гипоинтенсивные очаги в клетчатке (51,3%, F=14,37 р<0,001), утолщение или уплотнение крестцово-маточных связок (43,6%, F=5,36 р=0,022), уплотнение брюшины Дугласова пространства (12,8%, F=2,28 р=0,131).
По данным МРТ у 48,9% (24/49) пациенток основной группы с генитальным эндометриозом было выявлено подозрение на АДМ, из них АДМ отмечен примерно в половине случаев у пациенток с НГЭ (51,3% (20/39)). Наиболее часто встречающиеся признаки АДМ у подростков не отличались от описанных для взрослых пациенток с АДМ и были представлены следующими характеристиками: неравномерностью толщины стенки матки/ассиметричным утолщением одной из стенок матки 75,0% (18/24); снижением зональной дифференцировки матки 50,0% (12/24); неоднородной структурой миометрия/ повышенным МР-сигналом в 83,3% (20/24) случаях; неоднородным, гипоинтенсивным МР сигналом эндометрия в 100% (24/24) случаях; неравномерным утолщением переходной зоны 58,3% (14/24); неровными контурами переходной зоны 95,8% (23/24); неоднородной структурой переходной зоны в 75,0% (18/24) случаях.
Из 79,6% (39) пациенток, у которых НГЭ был зарегистрирован по данным МРТ, в большинстве случаев были определены очаги на крестцово-маточных связках – в 38,5% (15/39), по серозному покрову матки (задний листок широкой связки) – в 33,3% (13/39), на брюшине – в 25,6% (10/39), эндометриоидные очаги и кисты яичников – в 12,8% (5/39), в области перешейка матки – в 2,6% (1/39).
У всех пациенток основной группы с выраженной дисменореей, устойчивой к НПВП, при наличии подозрения на НГЭ и невозможности поставить диагноз без операции, была проведено лапароскопическое подтверждение заболевания с последующим гистологическим исследованием очагов. Суммарно, лапароскопия была выполнена 80 пациенткам; из них НГЭ определялся в 95,0% (76/80) случаях, ЭК – в 21,3% (17/80). По данным лапароскопии отмечалась разная локализация очагов НГЭ, что представлено в таблице 3. У подростков ранние формы НГЭ по данным лапароскопии характеризовались преимущественным расположением очагов на крестцово-маточных связках (78,9% (60/80)); у половины пациенток визуализировались очаги в Дугласовом пространстве (51,3% (39/80)); у трети девочек уже в подростковом возрасте эндометриоз имел распространенный вариант и очаги выявлялись на пузырно-маточной складке, ретроцервикальной области, в яичниковых ямках, на широкой связке матки.
В большинстве случаев у пациенток регистрировались прозрачные сливные очаги (64,7%), у трети пациенток – красные и черные очаги (38,2%) и белые фиброзные очаги (29,4%) (рис. 1). При проведении корреляционного анализа выявлено, что черные по цвету очаги выявлялись при более тяжелой стадии эндометриоза по классификации AFS (r=0,382, p=0,045); напротив, прозрачные очаги наблюдались при более легкой стадии эндометриоза по классификации AFS (r=-0,528, p=0,004).
Для понимания возможностей неинвазивной диагностики ранних форм генитального эндометриоза мы провели сравнение данных УЗИ, МРТ описания органов малого таза и лапароскопической картины.
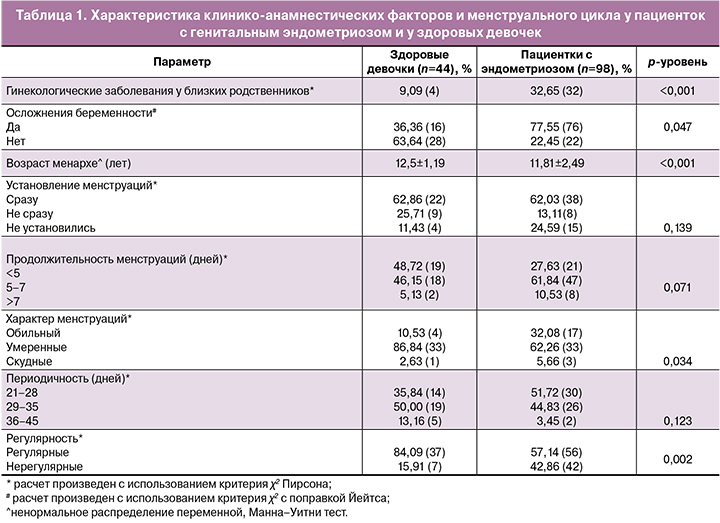
Диагностическая точность УЗИ в определении разных форм эндометриоза у подростков была наиболее высока в отношении ЭК – в 77,8% (14/18) случаях; УЗИ позволяло заподозрить в 16,7% (8/48) АДМ и практически не было показательно в отношении НГЭ – 4,1% (3/74).
Точность диагностики генитального эндометриоза по МРТ составила у пациенток с НГЭ – 79,6% (39/47), АДМ – 88,9% (24/27), ЭК – 100% (5/5) (рис. 2). При сравнении данных МРТ органов малого таза и лапароскопии в отношении НГЭ отмечено, что в 75,5% (37) пациенток c НГЭ диагноз совпадал с результатами оперативного вмешательства; в 20,4% (10) был отмечен ложноотрицательный результат и в 4,1% (2) – ложноположительный результат; очаги эндометриоза не были найдены при диагностической лапароскопии (рис. 2). Хотелось бы подчеркнуть, что при наличии клинической симптоматики даже в отсутствии подозрения по данным МРТ, у пациентки в подростковом возрасте в 20,4% при лапароскопии мы имели подтверждение НГЭ. МРТ (при сравнении с данными лапароскопии) позволяет предположить непосредственную локализацию очагов меньше, чем в половине случаев (38,5% (15/39)) на крестцово-маточных связках, лишь в четверти случаев – по брюшине малого таза (в 25,6% (10/39)), в 33,3% (13/39) случаях – по заднему листку широкой связки матки, в 12,8% (5/39) – при наличии очагов на яичниках). При лапароскопии мы видим локализацию очагов наиболее часто на крестцово-маточных связках – 78,9% (60/80), брюшине Дугласова пространства – 51,3% (39/80), в трети случаях – в ретроцервикальной области, пузырно-маточной складке и в яичниковых ямках.
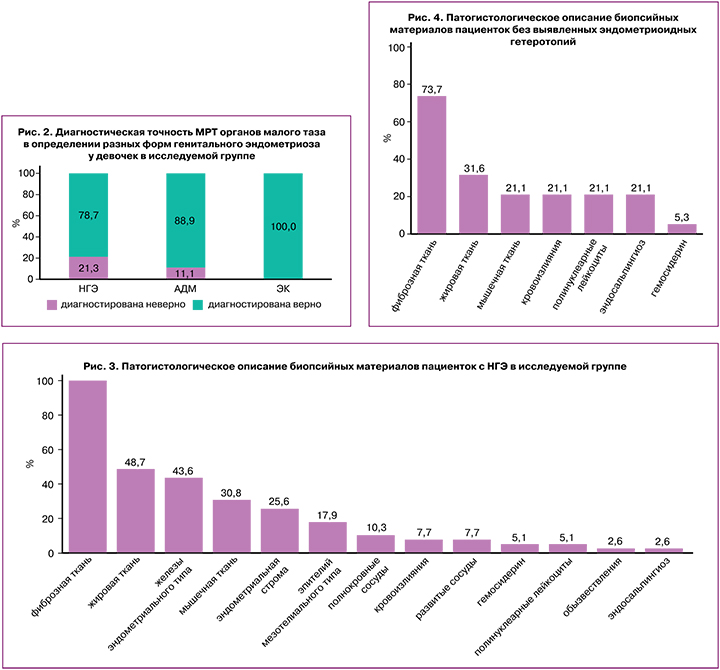
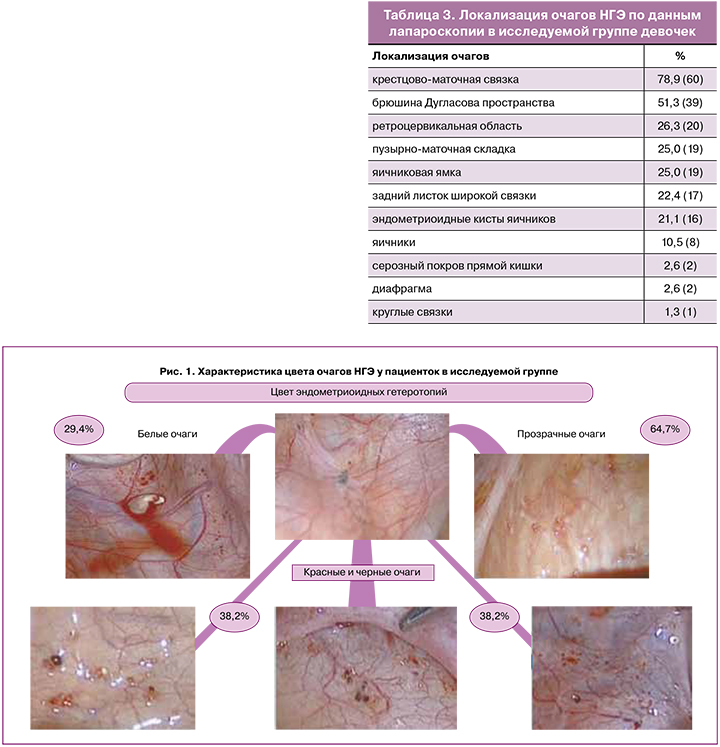
Далее 58 пациенткам с НГЭ и ЭК провели сравнение хирургического и гистологического диагнозов. В результате гистологического исследования микроскопическая картина очагов эндометриоза в 67,2% (39/58) была представлена эндометриоидными гетеротопиями, в 32,8% (19/58) случаев эндометриоидные гетеротопии отсутствовали; очаги эндометриоза были представлены в основном фиброзной, жировой, мышечной тканью, участками кровоизлияний (рис. 3, 4). Также в 21,1% (4/58) случаях был визуализирован трубный эпителий, что определило гистологическое заключение эндосальпингиоза.
В 67,2% (39) случаев, помимо эндометриоидных гетеротопий при гистологическом исследовании очагов НГЭ, отмечались участки фиброзной, жировой, мышечной ткани, кровоизлияния, сосуды, участки обызвествления; некоторые участки были инфильтрированы полинуклеарными лейкоцитами, содержали эпителий мезотелиального типа, в одном из случаев определялось сочетание эндосальпингиоза и эндометриоидных гетеротопий (рис. 5).
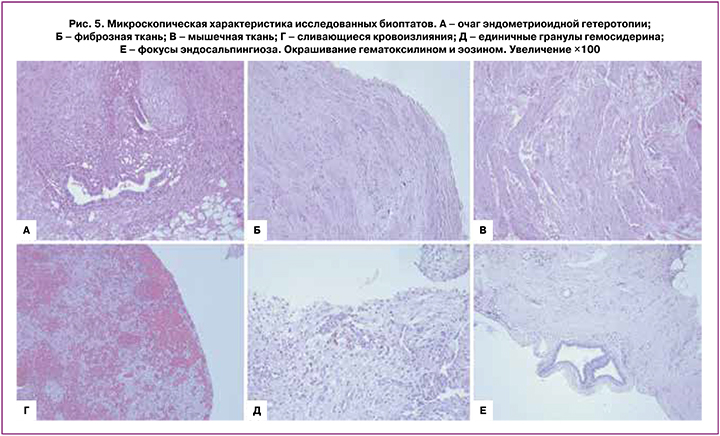
Таким образом, у 32,8% (19) пациенток при анализе гистологической картины в биопсийных очагах эндометриоидных гетеротопий брюшины не выявили эндометриоидной железистой или стромальной ткани, однако такая гистологическая картина не соответствует очагам здоровой брюшины и не исключает диагноз согласно ESHRE 2022.
Обсуждение
Эндометриоз является ведущей патологической причиной дисменореи и хронической тазовой боли у подростков. При этом в литературе крайне мало клинических исследований по эндометриозу у подростков, поэтому стратегия и тактика лечения экстраполирована из данных, полученных у взрослых. По данным зарубежных и отечественных исследований известно, что наследственная предрасположенность, ранний возраст менархе (<14 лет), короткая продолжительность менструального цикла, более длительные менструальные выделения, ожирение, раннее начало дисменореи увеличивают риск развития эндометриоза, более чем в два раза [13–15]. В ходе нашего исследования в результате сбора анамнеза пациенток были изучены и оценены факторы, потенциально влияющие на риск развития эндометриоза. Значимым фактором риска оказалось отягощение наследственности по эндометриозу и другим гинекологическими заболеваниями (миома матки, кисты различных видов и гиперплазия эндометрия) у родственников девочки, что увеличивает риск развития заболевания у девочки в 4,9 раз (ДИ 1,58; 14,87, р=0,005). В ряде исследований указывается, что у женщин с низким индексом массы тела повышается риск развития эндометриоза. Объясняется это тем, что при ожирении часто наблюдается опосредованное гиперинсулинемией и инсулинорезистентностью повышение андрогенов, что ассоциировано с ановуляторным и нерегулярным циклом и меньшей частотой ретроградной менструации [16–18]. Однако, по данным некоторых авторов, отсутствует корреляция индекса массы тела с риском развития эндометриоза [18, 19], а по результатам других работ, напротив, ожирение в детском возрасте может служить фактором риска развития эндометриоза в дальнейшем [20, 21]. Предполагается, что в связи с тем, что у девочек с ожирением возраст менархе наступает раньше, риск развития эндометриоза в молодом возрасте выше, в том числе в связи с более высоким уровнем биодоступного эстрадиола, образующегося в результате превращения тестостерона в эстрадиол ароматазой в жировой ткани, а также более с высоким уровнем секреции адипоцитокинов и лептина жировой тканью, что создает провоспалительное микроокружение и оказывает проангиогененное действие [20].
Метаанализ 18 публикаций, посвященных исследованию ассоциации возраста менархе с эндометриозом, показал небольшое увеличение риска развития эндометриоза при раннем менархе [2]. Авторы считают, что в основе этого может лежать ранняя активация гипоталамо-гипофизарной-яичниковой оси, увеличение числа менструаций в течение жизни женщин и, соответственно, риска ретроградного заброса менструальной крови в брюшную полость. Однако, опубликованы и противоречивые данные, где возраст менархе не связан с развитием заболевания или, наоборот, раннее менархе является протективным фактором [22]. По нашим данным у девочек с эндометриозом средний возраст наступления менархе оказался меньше (11,8±2,49), чем у здоровых девочек (12,5±1,19) в среднем на 8 месяцев (р<0,001; t-тест).
Имеются противоречивые данные о связи продолжительности менструального цикла с развитием эндометриоза [23, 24]. По данным некоторых исследований, длинный менструальный цикл (>29 дней) связан с увеличением риска развития эндометриоза в 1,8 раз [25]; однако, по другим данным именно более короткий менструальный цикл (<27) ассоциирован с большей частотой заболевания [26]. В нашем исследовании при статистическом анализе значимой разницы по длительности менструального цикла между группами не выявлено; при этом, девочки с эндометриозом по сравнению со здоровыми девочками значимо чаще отмечали нерегулярные (42 (42,9%) против 7 (15,9%) (р=0,002, χ2-тест)) и более обильные менструальные выделения (17 (32,1%) против 4 (10,5%) (р=0,034, χ2-тест)), что может быть следствием гиперэстрогенного фона и совпадает с данными литературы [22] о более высоком риске ретроградного заброса менструальной крови при длительных и обильных менструациях [15].
Важным звеном в патогенезе эндометриоза является нарушение функции гипоталамо-гипофизарно-яичниковой системы. У пациенток с эндометриозом в исследуемой группе отмечены более высокие показатели ЛГ (8,3±6,72 против 4,1 ±1,96, р<0,001) и пролактина (481,2±312,42 против 237,8±126,43, р<0,001), что может служить предрасполагающим фактором развития эндометриоза у девочек с более незрелой гипоталамо-гипофизарной системой и повышением частоты и амплитуды секреции ЛГ в период полового созревания, в том числе стрессового характера. Также основная группа пациенток характеризовалась более высокими уровнями эстрадиола (335,2±292,28 против 171,5±73,95, р=0,032), 17-ОН прогестерона (5,8±3,63 против 3,9±1,84, р=0,022), общего андростендиона (10,8±4,27 против 8,4±2,45, р=0,013), что говорит и об активации гипоталамо-гипофизарно-яичниковой и надпочечниковой оси.
При проведении УЗИ высококвалифицированным специалистом можно предположить наличие АДМ, ЭК и очагов глубокого инфильтративного эндометриоза, особенно в стенке кишки, что определяется в основном у женщин репродуктивного возраста [27]. В нашем исследовании УЗИ оказалось информативным лишь в диагностике ЭК (77,8%), вероятно, в связи с менее распространенным процессом у подростков.
Известно, что МРТ имеет более высокую точность в диагностике АДМ, ЭК, а также поверхностного и глубокого инфильтративного эндометриоза, позволяя выявлять субперитонеальные очаги, вовлечение смежных органов и выраженность спаечного процесса [28]. По нашим данным, точность диагностики по МРТ органов малого таза НГЭ была значимо выше, чем по данным УЗИ (в 82,3% против 4,1% случаев); также с высокой точность определяли АДМ (88,9% против 16,7%) и ЭК (100% против 77,8%). С использованием факторного анализа выделили наиболее значимые признаки НГЭ по данным МРТ: наличие скудного количества свободной жидкости в Дугласовом пространстве (87,2% (34), F=19,9 p<0,001); спаечный процесс в малом тазу, фиксация маточной трубы, кишки, яичников (56,4% (22), F=9,52 р=0,002); неоднородность параовариальной, параметральной, парацервикальной клетчатки, гипоинтесивные очаги в клетчатке (51,3% (20), F=14,37 р<0,001); утолщение или уплотнение крестцово-маточных связок (43,6% (17), F=5,36 р=0,022); уплотнение брюшины Дугласова пространства (12,8% (5), F=2,28 р=0,13).
В литературе есть описание эндометриоидного поражения крестцово-маточных связок с асимметрией связок, диффузным или локальным утолщением, наличием узлов с нечеткими тяжистыми контурами, имеющими характерный для эндометриоидных гетеротопий вид [29]. По данным авторов, при ретроцервикальном эндометриозе в процесс часто вовлекается прямокишечно-влагалищная перегородка, влагалище и толстая кишка, что приводит к формированию массивного спаечного процесса в малом тазу. Поражение яичников может иметь вид поверхностных или глубоких очагов, в том числе фиброзной плотности, или может быть представлено ЭК. Эндометриома, представляющая собой толстостенную ретенционную кисту с циклично повторяющимися кровоизлияниями в нее, характеризуется гиперинтенсивным МР-сигналом на Т1-ВИ и гетерогенным МР-сигналом на Т2-ВИ, часто с двуслойной структурой, что обнаруживается по данным МРТ с высокой специфичностью, до 98% [8]. Выделенные нами признаки АДМ на МРТ совпадают с литературными данными и данными коллектива авторов, под руководством Л.В. Адамян, которая описали неравномерное утолщение, неравномерные контуры и неоднородную структуру переходно-соединительной зоны, появление в переходно-соединительной зоне мелких гетерогенных и кистозных включений, выявление в миометрии единичных мелких, неравномерно расположенных очагов или зон неоднородной структуры, увеличение размеров и асимметрию матки при АДМ у женщин репродуктивного возраста [1].
Лапароскопическое подтверждение является золотым стандартом верификации диагноза эндометриоза, определения степени распространения и выраженности процесса [30]. Как отмечалось ранее, эндометриоидное поражение у подростков часто выглядят иначе, чем у взрослых женщин; как правило, чаще выявляются сливные пузырьковидные прозрачные, красные, белые и/или желто-коричневые поражения, чем черные или синие [31]. В нашем исследовании при лапароскопии чаще всего визуализировались множественные очаги эндометриоза, смешанные по цвету: прозрачные – в 64,7% случаях, красные – в 38,2%, черные и синюшные – в 38,2%, белые очаги – у 29,4% подростков.
Еще в 1987 г. авторы Chatman D. и Zbella E. в ходе исследования 115 пациенток с эндометриозом обнаружили, что диагноз может быть не подтвержден гистологически даже при наличии макроскопически видимых очагов [9]. В настоящее время мировое сообщество придерживается тактики, что диагностика и лечение эндометриоза не должны зависеть от гистологического подтверждения диагноза. В проспективном исследовании Stratton P. et al. (2002) у 65 пациенток было выявлено и иссечено суммарно 314 очагов эндометриоза, гистологическое подтверждение было получено лишь в 61% случаев [32].
В исследовании Marchino G. et al. было исследовано 122 биопсий у 54 пациенток, эндометриоз был подтвержден в 54% иссеченных образований при визуализации железистых и стромальных компонентов эндометриоидной ткани [33]. Частота гистологической верификации была значительно выше при классических поражениях, представленных везикулярными и папулезными образованиями, чем для атипичных (64% против 42%, р<0,05) очагах. Участки фиброза выявлялись наиболее часто среди тех образцов, в которых не было найдено эндометриодных гетеротопий и предполагалось, что эти поражения представляют собой поздние стадии естественного течения болезни. Несоответствие между визуальным и гистологическим диагнозами также отмечалась в нашем исследовании, где в 32,8% (19) не было найдено эндометриоидных гетеротопий в участках биопсии. Чаще всего эти очаги были представлены фиброзной тканью – 73,7% (14), жировой тканью – 31,6% (6), мышечной тканью – 21,1% (4) и участками кровоизлияний – 21,1% (4).
По данным литературы, наиболее часто очаги эндометриоза получают гистологическое подтверждение при гетеротопиях черного цвета, а также множественных очагах белого цвета или смешанных вариантов очагов [34]. В нашем исследовании не было выявлено ассоциации между цветом очагов и вероятностью обнаружения эндометриодной ткани при патогистологическом исследовании. Однако, по нашим данным, черные по цвету очаги выявлялись при более тяжелой стадии эндометриоза по данным AFS (r=0,382, p=0,045), и большей суммой баллов по шкале AFS (r=0,443, p=0,018). Напротив, выявление прозрачных очагов наблюдалось при более легких поражениях по данным балльной оценки тяжести эндометриоза (r=-0,528, p=0,004). В исследовании Еl Bishry G. et al. показали, что чем более тяжелая степень заболевания, тем выше вероятность гистологического подтверждения [4]. В нашем исследовании не было выявлено данной связи (r=-0,096, p=0,626), однако, в выборку исследования входили пациентки в основном с начальными формами заболевания при манифестации в подростковом возрасте. По данным литературы, стадия заболевания не коррелирует с тяжестью симптомов [35–37]. В нашем исследовании также не было обнаружено связи между стадией заболевания и тяжестью дисменореи, оцененной по ВАШ (r=0,205, p=0,483).
Стоит отметить, что хирургическая тактика ведения рассматривается при невозможности поставить диагноз без оперативного вмешательства при начальных формах заболевания и далее требует длительной консервативной гормональной терапии, или в случаях неэффективности консервативной терапии и при глубоком инфильтративном характере поражения с вовлечением смежных органов. У пациенток с эндометриомами яичников (до 4–5 см в диаметре), АДМ или НГЭ, который может быть визуализирован при УЗИ или МРТ, на первом этапе предпочтение отдается нехирургическому ведению [32, 36, 37].
Заключение
Таким образом, учитывая хронический характер заболевания, влияние эндометриоза на репродуктивную функцию, овариальный резерв молодых пациенток, на социальный и психологический статус, основная задача на сегодняшний день заключается как можно в более раннем выявлении заболевания и своевременном начале терапии с целью предотвращения прогрессирования и формирования осложнений. Несмотря на то, что до сих пор не существует достоверных биомаркеров или иных неинвазивных методов диагностики, совокупность клинических и анамнестических симптомов, данных гинекологического обследования и инструментальных методов (УЗИ органов малого таза в случаях ЭК и МРТ в случаях НГЭ) позволяет заподозрить ранние формы генитального эндометриоза при манифестации заболевания у молодых пациенток. При невозможности поставить диагноз без хирургического вмешательства операция лапароскопическим доступом и гистологическое исследование очагов эндометриоза является важным этапом в диагностике эндометриоза у молодых пациенток с хронической тазовой болью и дисменорей, не поддающейся медикаментозной терапии. Однако, не всегда в биопсийных материалах присутствуют клетки эндометриоидных гетеротопий, что не исключает диагноз эндометриоза у пациенток с клинической симптоматикой и визуальным подтверждением по данным лапароскопии.
На основании проведенной работы, были сделаны следующие выводы:
1. Пациентки с генитальным эндометриозом в подростковом возрасте в сравнении со здоровыми девочками характеризуются отягощением наследственности по эндометриозу, что увеличивает риск развития заболевания в 4,9 раза (ДИ=1,58; 14,87, р=0,005), более ранним менархе (11,8 лет, р<0,001), большей частотой обильных (р=0,034) и нерегулярных (р=0,002) менструаций. Основной жалобой пациенток с эндометриозом является боль 8–9 баллов по ВАШ, в среднем появляющаяся за день до начала выделений и длящаяся первые 3–4 дня (40,8%), устойчивая к спазмолитикам и НПВП.
2. Пациентки с генитальным эндометриозом в сравнении со здоровыми девочками характеризуются более высоким уровнем ЛГ (р<0,001), эстрадиола (р=0,032), 17-ОН прогестерона (р=0,022), андростендиона (р=0,014), что свидетельствует об активации стероидогенеза. По данным УЗИ девочек с генитальным эндометриозом в сравнении с группой контроля отличает более высокий показатель М-эхо (р<0,001) и толщины матки (р=0,001), вероятно, как следствие гиперэстрогении при эндометриозе.
3. В диагностике генитального эндометриоза у подростков УЗИ органов малого таза является информативным в обнаружении ЭК (77,8%) и практически не позволяет выявить ранние формы НГЭ (4,1%). МРТ органов малого таза имеет точность в диагностике ЭК в 100%, АДМ – в 88,9%. Значимыми признаками НГЭ по данным МРТ является утолщение крестцово-маточных связок (р=0,022), неоднородность клетчатки малого таза (р<0,01), в особенности в сочетании со спаечным процессом (р=0,002) или жидкостью в Дугласовом пространстве (р<0,01), что позволяет предположить НГЭ в 78,7% случаев. Отсутствие указаний на наличие НГЭ по данным МРТ (в 21,3%) не исключает наличие генитального эндометриоза у подростков, в связи с чем, при наличии стойкой клинической симптоматики оправдано проведение диагностической лапароскопии.
4. По гистологической картине в 67,2% случаях в эндометриоидных очагах выявляются эндометриоидные железы и строма, в 32,8% очаги эндометриоза представляют собой фиброзную, жировую, мышечную ткань с участками кровоизлияний, что не исключает диагноз НГЭ и обуславливает те же принципы дальнейшего ведения и лечения пациенток.



