Исследования последних 10–15 лет существенно расширили представление о патогенезе микроциркуляторных нарушений гемостаза в жизни человека. Во многом этому способствовало открытие ADAMTS-13. ADAMTS-13 – металлопротеиназа, которая принадлежит к семейству пептидазных белков «ADAM» (ADisintegrin And Metalloproteinase), отщепляет фрагменты от мультимерной молекулы фактора фон Виллебранда (ФВ) и является важной частью гемостаза. Дефицит ADAMTS-13 способен спровоцировать развитие острого эпизода тромботической тромбоцитопенической пурпуры (ТТП), в том числе и у детей раннего возраста. В настоящее время выделяют наследственную форму ТТП (синдром Апшоу–Шульмана), которая обусловлена генетическим дефектом протеазы vWF-ADAMTS-13, и приобретенную форму ТТП, обусловленную наличием антител к ADAMTS-13 или ее ингибитора. Понимание патофизиологии развития ТТП позволило осознать важное значение ADAMTS-13 в развитии вторичных тромботических микроангиопатий, педиатрических инсультов и неонатальных тромбозов. В настоящее время недостаточно охарактеризованы причины развития тромбозов у новорожденных, а тромбоэмболия продолжает занимать свое место в списке причин, приводящих к смерти детей. Так, например, в Германии частота возникновения неонатальной тромбоэмболии составляет 5,1 на 100 тыс. новорожденных [1]
Конечно, спонтанные тромботические состояния, такие как тромбоз глубоких вен, легочная эмболия или инсульты, у здоровых новорожденных детей встречаются редко [2], но тем не менее существуют некоторые факторы риска для развития тромбоэмболии у новорожденных. К ним относятся «имплантируемые» центральные сосудистые катетеры, наследованные тромбофилии, сепсис, перинатальная гипоксия, системные вирусные инфекции, врожденные пороки сердца, полицитемия и низкий сердечный выброс. Со стороны матери – такие состояния, как диабет и системные заболевания, также способны привести к развитию неонатальной тромбоэмболии [3].
Впервые в 1982 г. Moake и соавт. обнаружили в плазме крови у 4 пациентов с хронической рецидивирующей ТТП, находящихся в ремиссии, сверхкрупные мультимеры ФВ, которые отсутствовали в плазме крови здоровых людей. Они выдвинули предположение об их возможной роли в развитии тромбозов и провел связь между ФВ и патогенезом развития ТТП. Эта гипотеза была подтверждена Asada et al., они смогли установить при иммуногистохимическом исследовании сосудов, что в состав тромбов при ТТП входят преимущественно тромбоциты и ФВ [4].
ФВ – это мультимерный плазменный гликопротеин, содержащий несколько структурных доменов, который относится к свертывающей системе крови и обеспечивает реализацию остановки кровотечения. Он синтезируется в мегакариоцитах и эндотелиальных клетках и хранится в тельцах Вайбеля–Паладе эндотелиальных клеток и в α-гранулах тромбоцитов [5]. Также он принимает большое участие в гемостазе и выполняет роль адгезивной связи между тромбоцитами и поврежденными стенками сосудов. Кроме того, ФВ способствует коагуляции за счет стабилизации фактора XIII. Ген ФВ расположен на 12 хромосоме (коротком плече), содержит 52 экзона и является одним из самых крупных генов человека. ФВ циркулирует как глобулярный протеин и распознается двумя рецепторами, которые могут выступать посредниками при его удалении из кровообращения: CLEC4M – на эндотелиальных клетках и Siglec-5 – на макрофагах [6].
В 1996 г. две группы исследователей выделили из плазмы человека ранее не известный энзим, который способен был расщепить сверхкрупные мультимеры ФВ на субъединицы Y1605 и М1606, обладающие малой функциональной активностью [7, 8]. В 2001 г. его отнесли к 13 члену семейства металлопротеиназ [9, 10]. Ген ADAMTS-13 локализуется в 9q34 хромосоме интервала 37kb и содержит 29 экзонов [11]. Эта металлопротеиназа гомологична другим членам семейства протеаз, начинается с сигнального пептида и пропептида, которые расщепляются при секреции. Также она содержит N-терминальный каталитический домен, дезинтегриновый домен, повторы тромбосподина типа-1 (TSP-1), цистеин-обогащенный домен, С-конец, семь дополнительных повторов TSP-1 и два уникальных CUB домена [12]. ADAMTS-13 способна отщеплять фрагменты как от трансмембранной, так и от плазменной формы мультимера ФВ. Таким образом, ADAMTS-13 необходима для высвобождения ФВ в плазму, а также для регулирования его чрезмерной активности.
Дефицит ADAMTS-13 приводит к беспрепятственному накоплению ФВ, а следовательно, к микрососудистым тромбозам и тромбоцитопении, что клинически проявляется ТТП [13].
Роль ADAMTS-13 в развитии ТТП
В 1924 г. E. Moschowitz [14] впервые описал клинический случай с 16-летней девушкой, у которой отмечались: лихорадка, петехиальная сыпь, гемолитическая анемия, гемипарез, поражение почек, обусловленное гиалиновыми тромбами терминальных артериол и капилляров. Именно в честь Moschowitz и был назван этот синдром, но в 1947 г. K. Singeretal [15] переименовал его в «ТТП». Выделяют два основных типа ТТП: врожденная (синдром Апшоу–Шульмана) и приобретенная [11, 16].
ТТП – редкое системное заболевание, которое при недиагностированных или нелеченых случаях в 85–100% приводит к летальному исходу. Развитие ТТП патофизиологически связано с тяжелой функциональной недостаточностью ADAMTS-13 (ADAMTS-13 ниже 10% от нормы). Этот недостаток приводит к накоплению сверхбольших мультимеров ФВ, индуцирующих спонтанное образование микротромбов в пределах артериол и капилляров и в последующем приводящих к ишемии [16–18].
Клинически для ТТП характерны 5 основных симптомов:
- тромбоцитопения;
- микроангиопатическая гемолитическая анемия;
- неврологические симптомы;
- лихорадка;
- почечная дисфункция [19].
У детей ТТП составляет менее 10% (⅓ – врожденная форма ТТП и ⅔ –приобретенная) [20]. При отсутствии соответствующего лечения ТТП может привести к смерти.
Наследственная форма ТТП – очень редкая патология, обычно развивается у новорожденных или детей раннего детского возраста, хотя также описываются случаи и более позднего начала заболевания. Синдром Апшоу–Шульмана наследуется по аутосомно-рецессивному механизму и вызывается мутациями гена ADAMTS-13, приводящими к дефициту фермента. Впервые наследственная ТТП чаще проявляется в возрасте 5 лет, в соотношении полов 1:1. Также она проявляется клинической гетерогенностью: приблизительно 50% пациентов с тяжелой и хронической формами нуждаются в ежемесячном переливании плазмы; около 50% пациентов с менее тяжелой формой, с большими периодами ремиссии профилактическая плазмотерапия не нужна. Развитие ТТП может быть спровоцировано прививками, инфекциями и хирургическими процедурами [21–23]. Заподозрить врожденную ТТП можно при обнаружении дефицита ADAMTS-13 без наличия ингибитора ADAMTS-13 [24]. В данный момент существует Международный регистр больных наследственной ТТП [25].
Приобретенная ТТП – наиболее частая форма данной патологии, встречающаяся в основном у детей старшего возраста. Распространенность данного заболевания составляет 1 случай на 1 млн детей. Исследование было проведено во Франции, изучали 45 детей, и было отмечено, что первый эпизод приобретенной ТТП отмечался чаще у девочек (2,5:1) в возрасте от 4 месяцев до 17 лет (средний возраст начала 13 лет). Начало ТТП у детей характеризуется гемолитической анемией (средний уровень гемоглобина 6,7 г/дл), глубокой тромбоцитопенией (количество тромбоцитов в среднем 11×109/л) и серьезным дефицитом ADAMTS-13 (активность <10%). Лихорадка отмечалась лишь у 36% детей. В целом приобретенная форма TTП связана в основном с анти-ADAMTS-13 аутоантителами (82%). Большинство пациентов хорошо отвечают на переливание плазмы, однако в случае неэффективности подобного способа назначают иммуносупрессивную терапию, а при необходимости – спленэктомию. Смертность при вторичной ТТП у детей составляет 9% [26].
Диагностика ТТП остается весьма проблематичной, так как по концентрации ADAMTS-13 бывает очень трудно поставить диагноз. Сейчас имеются сведения о том, что активность ADAMTS-13 может снижаться при целом ряде заболеваний, даже при сепсисе и индуцированном им синдроме диссеминированного внутрисосудистого свертывания [27–29].
Также снижение активности ADAMTS-13 было отмечено и при других микроангиопатических синдромах: гемолитико-уремическом синдроме [30], антифосфолипидном синдроме [31, 32].
Тем не менее положительная реакция Кумбса или отсутствие шистоцитов в мазке крови не должны исключать диагноз TTП, так как у 10% больных ТТП может характеризоваться нетипичными особенностями, подвергая диагноз сомнению [26, 33]. Все эти стандартные исследования (табица) не являются специфическими для диагноза ТТП у детей, и только биологическое исследование ADAMTS-13 может подтвердить или исключить диагноз.
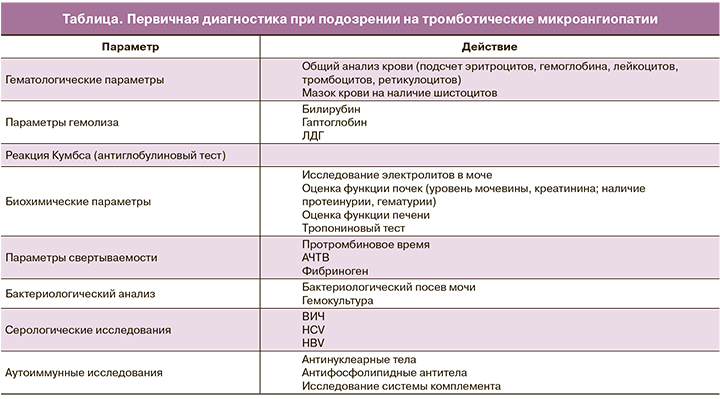
При подозрении на тромботическую микроангиопатию необходимо провести дополнительные исследования:
- рентгенографию органов грудной клетки;
- исследование сердца (эхокардиографию, ЭКГ);
- ультразвуковое исследование (УЗИ) почек;
- при необходимости – консультацию невролога и окулиста.
Исследование ADAMTS-13
ADAMTS-13 является единственным специфическим маркером для постановки диагноза ТТП. Значительно повышается достоверность диагностики при определении функциональной активности ADAMTS-13 иммунофлюоресцентным методом. Также имеет смысл определить антитела к этой протеиназе, чтобы выявить причину снижения активности ADAMTS-13. Количественное определение специфических антител к ADAMTS-13 проводится с помощью наборов для иммуноферментного анализа. Значения ADAMTS-13 исследуют методом трехфазного иммуноферментного анализа (ELISA) с помощью поликлональных антител (TechnozymvWF:AgELISA Americandiagnosticinc. vWFactivitykit) [34–36].
Фактор фон Виллебранда/ADAMTS-13 у новорожденных
Существуют значительные различия в системе свертывания крови у новорожденных по сравнению с детьми более старшего возраста и взрослых. Эволюция системы гемостаза человека является сложным процессом, и возрастные различия в уровнях белков свертывания крови сохраняются в течение всего детства [37, 38]. До сих пор существует лишь ограниченное понимание соотношения ФВ/ADAMTS-13 у новорожденных и клинических проявлений ТТП. Несмотря на отсутствие консенсуса в отношении значений уровня ADAMTS-13, большинство исследователей пришли к выводу, что в неонатальном периоде активность ADAMTS-13 ниже, а уровень ФВ выше по сравнению со взрослыми.
Данные исследований, которые измеряли ФВ в разном возрасте [39–41], свидетельствуют о том, что уровень ФВ у детей достигает уровня взрослых в возрасте 6 месяцев. Проводилось два исследования пуповинной крови: Hellstrom-Westas и соавт. и Strauss и соавт. [42, 43], в которых определили значения ФВ у доношенных и недоношенных детей. Эти два исследования оказались противоречивыми: Hellstrom-Westas и соавт. утверждали, что уровень ФВ выше у недоношенных детей, а Strauss и соавт. показали, что уровень ФВ выше у доношенных. Эти противоречивые результаты не позволяют понять, каково на самом деле соотношение ФВ/ADAMTS-13 у новорожденных. Кроме того, считается что на уровень ФВ могут влиять такие триггеры, как стресс и воспаление [44].
Также противоречивы данные о показателях ADAMTS-13 у новорожденных. По данным некоторых исследований, уровень ADAMTS-13 у детей первых 6 месяцев ниже, чем у взрослых [42, 45–47], а по данным других – они аналогичны таковым у взрослых [48, 49]. В исследованиях Hellstrom-Westas и соавт. [42] уровень ADAMTS-13 между доношенными и недоношенными детьми существенно не отличался, а по данным Strauss и соавт. [43] – у доношенных уровень ADAMTS-13 в 1,25 больше, чем у недоношенных [43]. Hellstrom-Westas и соавт. также измеряли уровень ADAMTS-13 в пуповинной крови у недоношенных детей и обнаружили значимую корреляцию между ADAMTS-13 и гестационным возрастом (r=0,70) и весом при рождении (r=0,83), но нет сообщений о таких значениях у доношенных детей [42]. Результаты этого исследования должны восприниматься с осторожностью из-за малой выборки (10 доношенных и 9 недоношенных детей). Следует отметить, что большинство исследований проводилjсь до введения FRETS-vWF73.
В целом исследования ADAMTS-13 и ФВ у новорожденных показали противоречивые результаты, особенно для ADAMTS-13. Текущие данные свидетельствуют о том, что уровень ФВ в неонатальном периоде выше, чем в плазме взрослых, и постепенно уменьшается, достигая уровня взрослых к 6 месяцам. С другой стороны, неонатальный уровень ADAMTS-13 значительно ниже по сравнению с уровнем взрослых. Эти результаты показывают обратную связь между уровнем ФВ и уровнем ADAMTS-13 в плазме [50]. До конца не ясно, почему новорожденные имеют более высокий уровень ФВ и более низкую активность ADAMTS-13. Предположительно, эта физиологическая реакция возникает при подготовке к родам или как реакция на стресс после рождения. У здоровых новорожденных это соотношение ADAMTS-13/ФВ не приводит к тромбозам, но может дать толчок к развитию тромбозов под воздействием дополнительных факторов риска, таких как гипоксия, сепсис и введение на длительное время внутривенных устройств.
Недавнее исследование взаимодействий ФВ/ADAMTS-13 показалj, что активность ФВ выше у новорожденных и грудных детей, перенесших операции на сердце [51]. Интересно, что исследование не показало существенных различий между уровнем ADAMTS-13. В целом эти данные поднимают вопрос о том, что несбалансированное соотношение ФВ/ADAMTS-13 действительно является фактором риска развития тромбозов для новорожденного.
Неонатальные тромбозы
Новорожденные имеют очень высокий риск развития тромбоэмболических осложнений (ТЭО), так как скорость развития венозной тромбоэмболии (ВТЭ) у них значительно выше, особенно это касается тяжелобольных детей [52]. Всплеск развития ВТЭ чаще всего наблюдается у детей до года. Канадские и немецкие неонатологи опубликовали данные о развитии тромбозов у новорожденных. В исследовании канадских ученых говорилось о развитии тромбозов (исключая инсульт) у новорожденных в соотношении 2,4/1000, в то время как в Германии эти показатели составляют 5,1/100 тыс. детей [53–55]. Частота развития ВТЭ у новорожденных занимает высокие позиции и увеличивается с возрастом. Так, частота инсульта у новорожденных, особенно у недоношенных, составляет 25 на 100 тыс. населения в год, при этом половина из них – ишемические [52]. В Северной Америке была оценена частота неонатального ишемического инсульта, она варьировала в диапазоне от 2,5 до 2,7 случаев на 100 тыс. детей в год, а во Франции – 13 случаев на 100 тыс. детей в год. Ишемический инсульт находится в топ-10 причин смерти среди детей в Соединенных Штатах, с самой высокой частотой развития в течение первого года жизни. Факторы риска развития ВТЭ у новорожденных можно разделить на три категории: 1) со стороны матери: инфекции, плацентарные заболевания, сахарный диабет, гипертония, преэклампсия, дислипидемия, метаболический синдром, антифосфолипидный синдром, наследственная тромбофилия, преждевременный разрыв плодных оболочек; 2) неонатальные факторы риска: центральный венозный катетер, сепсис, врожденные пороки сердца, перинатальная асфиксия, обезвоживание; 3) дополнительные факторы риска, специфичные для ВТЭ, связанные с центральным венозным катетером: низкая масса тела при рождении, недоношенность, длительное использование катетера (>6 дней), катетеризация пупочной вены, механическая вентиляции, хирургические манипуляции [52].
На основании данных из итальянского реестра по детским тромбозам, который велся между 2007 и 2013 гг. среди 75 зарегистрированных человек, у 41 (55%) из них был венозный тромбоз, у 22 (29%) – артериальный тромбоз и у 12 (16%) – внутричерепной тромбоз; мужчины представляли 65% всех случаев. У 19 (25%) детей диагноз тромбоэмболии был поставлен в первый день жизни. В дополнение к основным факторам риска (недоношенность, инфекции, центральные сосудистые катетеры), они идентифицируют постнатальные стероиды в качестве дополнительного фактора риска для развития тромбоза у недоношенных детей. Однако клинических данных о взаимодействии между экзогенными стероидами и тромбозом очень мало, и требуется больше исследований [56].
Лечение
Наиболее эффективным методом лечения детей на данный момент является плазмотерапия (переливания свежезамороженной плазмы крови); таким образом восстанавливается концентрация металлопротеиназы ADAMTS-13 и удаляются антитела к ней. Переливание плазмы выполняется до регрессии клинических проявлений, нормализации количества тромбоцитов (≥150×109 /л) и активности лактатдегидрогеназы [57]. При врожденной форме ТТП профилактическое переливание плазмы является единственным доступным методом лечения в настоящее время (обычно 10 мл/кг), а частота плазменных инфузий ориентируется на толерантность и хронизацию заболевания. У таких пациентов стоит регулярно проверять титр анти-ADAMTS-13 IgG, с тем чтобы вовремя обнаружить появление анти-ADAMTS-13 аллоантител [21, 58, 59]. При приобретенной ТТП, помимо плазмотерапии, назначаются стероиды. Пациентам, не восприимчивым к первой линии терапии (количество тромбоцитов не увеличивается после 4 дней интенсивного лечения, а уровень лактатдегидрогеназы выше нормального значения), или в случае обострения заболевания (отсутствие клинического улучшения и/или тромбоцитопении <100×109 / л в течение 2 дней) назначают иммуномодулятор ритуксимаб (моноклональное антитело против CD20) [60]. Ритуксимаб, как правило, начинает действовать через 2 недели после первого введения, и поэтому он не может предотвратить раннюю смерть. Другие иммуносупрессивные препараты (винкристины, циклофосфамид импульсы, циклоспорин А) и спленэктомия должны быть рассмотрены в более тяжелых случаях.
Рекомендуется регулярное наблюдение пациентов, у которых была выявлена ТТП. Необходимо проверять активность ADAMTS-13 каждые 3 месяца в течение первых лет после первого эпизода приобретенной ТТП [26].
Заключение
ТТП у детей является редким заболеванием, поэтому изначально может быть диагностирована неверно. Для постановки правильного диагноза врачам очень важно знать о взаимодействии между ADAMTS-13 и ФВ, так как благодаря этим значениям мы способны оценить факторы риска в развитии тромбозов у детей уже с самого рождения.



