Синдром Ашерсона, катастрофический антифосфолипидный синдром (КАФС), – одна из тяжело протекающих форм антифосфолипидного синдрома (АФС), которая характеризуется развитием мультиорганного тромбоза, приводящего к полиорганной недостаточности. Это редко встречающееся заболевание, возникающее менее чем у 1,0% людей из общей популяции с диагностированным АФС, приводящее к летальному исходу в половине всех случаев. Возникает у мужчин и женщин, но последних поражает в 2 раза чаще.
На данный момент официально зарегистрировано более 500 случаев КАФС, которые внесены в международный реестр пациентов с КАФС [1]. В последние годы изучению синдрома уделялось большое внимание, но, несмотря на это, КАФС часто не диагностируется, а следовательно, пациенты не получают должного лечения.
КАФС – редкое, но опасное для жизни состояние, которое может быть спровоцировано беременностью. Его трудно диагностировать, так как оно имитирует другие тромботические микроангиопатии, которые связаны с беременностью [2]. АФС впервые был описан английский исследователем Hughes в 1983 г. [3] как аутоиммунное заболевание и/или протромботическое состояние, которое характеризуется наличием антифосфолипидных антител (АФА) в крови и приводит к периферическим тромбозам (например, тромбозам глубоких вен), повторным выкидышам, при которых отмечается состояние тромбоцитопении. В 1991 г. S. Greisman [4] описал клиническую картину КАФС у 2 пациентов как «острую катастрофическую распространенную окклюзию висцеральных сосудов на фоне высокого титра АФА». Определение клинической картины КАФС, которая характеризуется как «острая диссеминированная коагулопатия-васкулопатия, связанная с АФС», позволяет выделить три типа пациентов с циркуляцией АФА [5]:
- пациенты, у которых наблюдается бессимптомная циркуляция АФА и не развиваются тромбозы (2–4%);
- пациенты, у которых циркуляция АФА сопровождается 1–2 эпизодами тромбозов с типичным вовлечением только одной артерии или вены с длительным периодом (от 1 месяца до нескольких лет), свободным от тромботических проявлений;
- пациенты, у которых циркуляция АФА сопровождается развитием множественных тромбозов с вовлечением одновременно трех и более сосудов с ишемическими изменениями органов, сетчатым ливедо, тромботической васкулопатией внутренних органов.
R. Asherson в 1992 г. отметил, что КАФС – это ускоренная форма АФС, приводящая к ишемии и полиорганной недостаточности [6, 7]. Разработанные R. Asherson в 2002 г. диагностические критерии остались до настоящего времени без изменений [8]. Учитывая огромный вклад Ronald A. Asherson в изучение КАФС (он первым ввел термин «КАФС», описал более 130 случаев этого синдрома, изучил его факторы риска, разработал классификацию и рекомендации по лечению КАФС, проанализировал прогноз у пациентов после перенесенного КАФС), было решено присвоить КАФС название «синдром Ашерсона» [9].
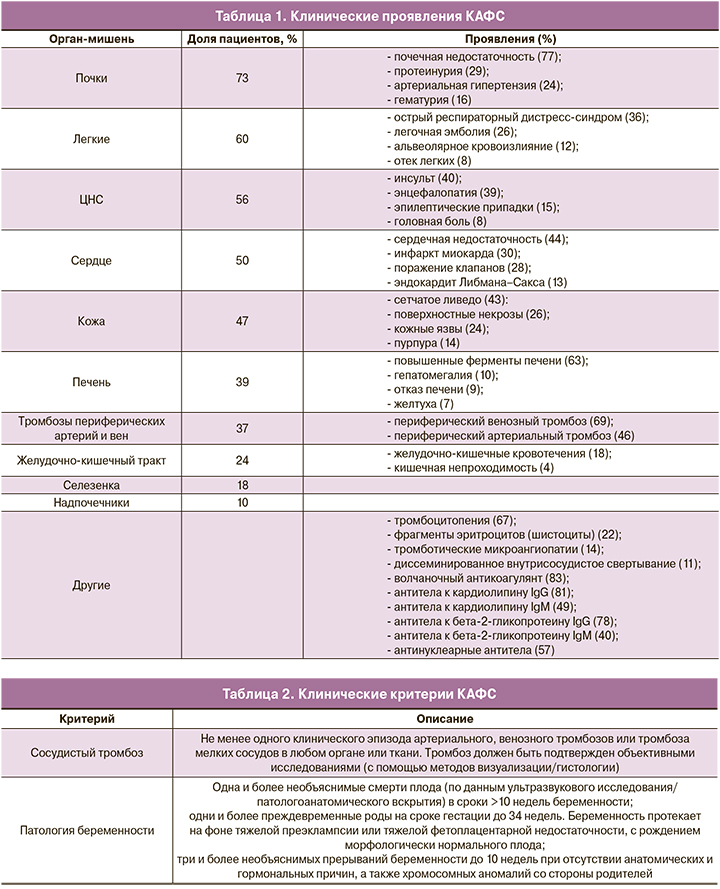
 КАФС – жизнеугрожающее заболевание, которое поражает меньше чем за неделю не менее трех органов, систем и/или тканей. К органам, которые поражаются чаще других, относят: печень, центральную нервную систему (ЦНС), сердце, кожу, почки и легкие (рис. 1). У пациентов с поражением почек наблюдаются почечная недостаточность (повышение на 50% сывороточного креатинина), гипертензия (180/100 мм рт. ст.), протеинурия (500 мг/сутки), в то время как у пациентов с поражением легких возникают острая дыхательная недостаточность, легочная эмболия и легочные кровотечения. У пациентов с поражением ЦНС клиническая картина проявляется в виде энцефалопатий, инсультов и припадков; при повреждении сердца диагностируют сердечную недостаточность и инфаркт миокарда [8, 10, 11].
КАФС – жизнеугрожающее заболевание, которое поражает меньше чем за неделю не менее трех органов, систем и/или тканей. К органам, которые поражаются чаще других, относят: печень, центральную нервную систему (ЦНС), сердце, кожу, почки и легкие (рис. 1). У пациентов с поражением почек наблюдаются почечная недостаточность (повышение на 50% сывороточного креатинина), гипертензия (180/100 мм рт. ст.), протеинурия (500 мг/сутки), в то время как у пациентов с поражением легких возникают острая дыхательная недостаточность, легочная эмболия и легочные кровотечения. У пациентов с поражением ЦНС клиническая картина проявляется в виде энцефалопатий, инсультов и припадков; при повреждении сердца диагностируют сердечную недостаточность и инфаркт миокарда [8, 10, 11].
Выделяют первичный и вторичный АФС. Вторичный связан с аутоиммунными заболеваниями, главным образом с системной красной волчанкой (СКВ, около 30% пациентов), которая поражает 1–20:100 000 женщин, в зависимости от этнического происхождения [12, 13].
Распространенность АФС в популяции неизвестна. Заболевание чаще развивается в молодом возрасте, чем в пожилом, описано у детей и даже новорожденных [14].
Патогенетические механизмы потери беременности, связанные с АФА
Эксперименты на мышах показали прямую причинно-следственную связь между присутствием АФА и выкидышами. Здоровым крысам вводили сыворотку крови от женщин с высоким титром АФА, это вызывало резорбцию плода на ранних стадиях и активировало аутоиммунные реакции, которые проявлялись клиническими признаками АФС [15, 16]. Эти исследования показывают, что плазма от женщин с АФС является весьма патогенной для эмбрионов крыс. Для чистоты эксперимента беременным крысам также вводили очищенную сыворотку, и данный эксперимент продемонстрировал прямое воздействие АФА на желточный мешок и на эмбрион [17]. Подобные эксперименты способны показать, что АФА являются причиной выкидышей, но они не объясняют механизмы, с помощью которых происходят такие потери.
Существуют различные гипотезы и концепции о механизмах, с помощью которых АФА вызывают гиперкоагуляцию:
- АФА способны изменять баланс эйкозаноидов за счет сокращения производства эндотелиальными клетками простациклина и повышения производства тромбоксана (что приводит к вазоконстрикции и увеличению агрегации тромбоцитов) [18, 19];
- существует перекрестная связь между АФА и гликозаминогликанами, а именно, гепарино-подобными веществами, препятствующими свертыванию крови. Ингибированием функции гликозаминогликанов АФА можно частично объяснить возникновение тромбов у пациентов [20];
- АФА способны вызывать гиперкоагуляцию, блокируя основной физиологический антикоагулянт протеин С [21];
- уменьшение плацентарного антикоагуляционного протеина (аннексина-5), который конкурирует с АФА за связь с фосфолипидами, приводит к плацентарной гиперкоагуляции [22];
- помимо описанных протромботических механизмов, ведутся споры о возможности прямого воздействия АФА на трофобласт [23]. Имплантация эмбрионов представляет собой динамический процесс, при котором ряд мероприятий тесно связан с трофобластом. Любые изменения в его функциональном состоянии могут привести к отказу имплантации. Бета-2-гликопротеин является одной из основных мишеней для АФА. Его присутствие на мембране трофобласта объясняет тропизм АФА к плаценте. Эти выводы помогают нам понять, почему в эксперименте с беременными крысами, которым вводили сыворотку крови, АФА исчезали из периферической крови и накапливались в плацентарной ткани [24, 25];
- инфекции были предложены в качестве еще одного механизма, который может привести к АФС. Экспериментальные мыши были заражены гемофильной палочкой, гонорейным гонококком и столбнячным токсином, которые привели к выработке антител против бета-2-гликопротеина [26]. У беременных крыс при введении этих инъекций отмечались: тромбоцитопения, удлинение активированного частичного тромбопластинового времени (АЧТВ) и увеличение количества выкидышей. У человека вирус ветряной оспы также может привести к развитию АФС [27].
При КАФС отличительной чертой является возникновение сразу нескольких тромбозов, преимущественно в мелких сосудах. Еще пока не ясно, почему у некоторых людей с АФС возникают быстрые и множественные тромбозы в мелких сосудах, что приводит к развитию синдрома Ашерсона. Многие случаи связаны с наличием провоцирующих факторов, таких как операция, инфекции или беременность. Кроме того, многие люди с АФС и АФА могут быть стабильны в течение длительного периода. Таким образом, возникло предположение, что для развития КАФС требуется «два удара» [28]. Теория «двойного удара» породила гипотезу о существовании дополнительных факторов, необходимых для развития синдрома. К таким факторам относят триггеры: инфекции (35% случаев), травма (14%), онкологические заболевания (6%), отмена антикоагулянтов (7%), беременность и послеродовой период (5%), обострение СКВ (3%).
Почти всегда перед хирургическими вмешательствами возникает необходимость в отмене антикоагулянтов. Таким образом, родилась теория «двойного удара», объясняя причину развития КАФС. С одной стороны, хирургическое вмешательство обусловливает повреждение эндотелия, массивный выброс цитокинов, экспрессию прокоагулянтных факторов и формирование протромботического фенотипа, а с другой – отмена антикоагулянтов также способствует активации коагуляции.
Неясно, почему провоцирующие факторы запускают «пусковой механизм» развития КАФС. Инфекции стимулируют иммунный ответ, поэтому возможно развитие аутоиммунного ответа. Новообразования также вызывают интенсивный иммунный ответ. Менее понятно, почему оральные контрацептивы и/или беременность могут спровоцировать развитие АФС. Хотя стоит отметить, что оба этих фактора включают в себя повышение уровня эстрогена. Хирургические вмешательства и травмы способны активировать КАФС под воздействием стресса [2] (рис. 2).

Клиническая картина и диагностические критерии
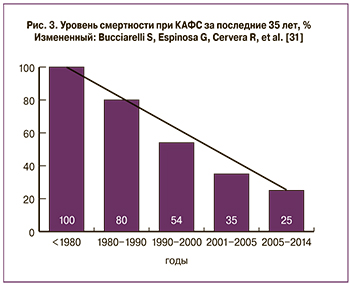 КАФС возникает у 1% больных с АФС [11, 29] и примерно у 4–6% женщин в период III триместра беременности или в послеродовом периоде [30–32]. Среди пациенток, у которых во время беременности развивается КАФС, более половины имеют данные о ранних проявлениях АФС, такие как выкидыши, потеря плода, возникающие тромбозы; у трети пациенток отмечают СКВ в анамнезе, а у остальных диагностируют аутоиммунные заболевания [6, 8].. Уровень смертности пациентов от синдрома Ашерсона снизился, как показано на рис. 3, что связано с более ранней диагностикой, а также с использованием тройной терапии, состоящей из антикоагулянтов+глюкокортикоиды+иммуноглобулины или плазмаферез [33] .
КАФС возникает у 1% больных с АФС [11, 29] и примерно у 4–6% женщин в период III триместра беременности или в послеродовом периоде [30–32]. Среди пациенток, у которых во время беременности развивается КАФС, более половины имеют данные о ранних проявлениях АФС, такие как выкидыши, потеря плода, возникающие тромбозы; у трети пациенток отмечают СКВ в анамнезе, а у остальных диагностируют аутоиммунные заболевания [6, 8].. Уровень смертности пациентов от синдрома Ашерсона снизился, как показано на рис. 3, что связано с более ранней диагностикой, а также с использованием тройной терапии, состоящей из антикоагулянтов+глюкокортикоиды+иммуноглобулины или плазмаферез [33] .
Клинически могут иметь место общее недомогание, боли в животе, в грудной клетке; также могут отмечаться изменения в психическом статусе и возникать эпилептические припадки. Только 50% женщин, у которых во время беременности развился КАФС, имели в анамнезе первичный АФС или признаки АФС. Поэтому врачи должны быть всегда начеку, так как неправильный диагноз или задержка в диагностике увеличивают риск неблагоприятного исхода для матери и плода. Этот факт привел к тому, что даже неполный набор диагностических критериев необходимо классифицировать как вероятный КАФС (41%) и относиться к нему соответствующим образом (табл. 1–2).
Лабораторные критерии КАФС
Описано много видов АФА, но в диагностике АФС обращают внимание на три наиболее важных критерия. К ним относятся волчаночный антикоагулянт (ВА), антитела к кардиолипину и антитела к β2-гликопротеину. ВА – это аутоантитела, вырабатываемые против собственных фосфолипидов и/или фосфолипидно-белковых комплексов, что приводит к нарушению свертываемости крови. ВА включает в себя: протромбиновое время, каолиновое время свертывания плазмы, тест Рассела с разведением змеиного яда, АЧТВ. Именно выявление ВА часто связано с неблагоприятным акушерским прогнозом [34]. Для того чтобы поставить положительный диагноз, необходимо иметь положительные значения АФА не менее чем в 2 случаях с 6-недельным перерывом и гистологическое подтверждение окклюзии сосуда [35]. Заподозрить КАФС трудно при отсутствии серологической диагностики.
Кроме традиционных лабораторных данных, еще оценивают: антитела к кардиолипину IgA и антитела к бета-2-гликопротеину IgA, антитела к фосфатидилсерину [5].
Диагностические критерии КАФС
К диагностическим критериям КАФС относят:
- доказательства причастности 3 или более органов, систем и /или тканей;
- развитие всех клинических проявлений одновременно или за неделю;
- подтвержденную гистопатологией окклюзиюмелких сосудов (не менее 1 органа);
- лабораторное подтверждение, наличие АФА.
Таким образом, диагноз КАФС ставится на основании всех 4 критериев. Диагноз «вероятный КАФС» ставится при наличии:
- всех 4 критериев, за исключением только двух органов, систем и/или тканей;
- всех 4 критериев, за исключением отсутствия лабораторного подтверждения с интервалом менее 6 недель;
- пункты 1, 2 и 4;
- пункты 1, 3 и 4 (развитие клинических проявлений более чем за неделю, но менее чем за месяц).
Наиболее часто в клинической практике ставят диагноз «вероятный КАФС».
Дифференциальная диагностика КАФС
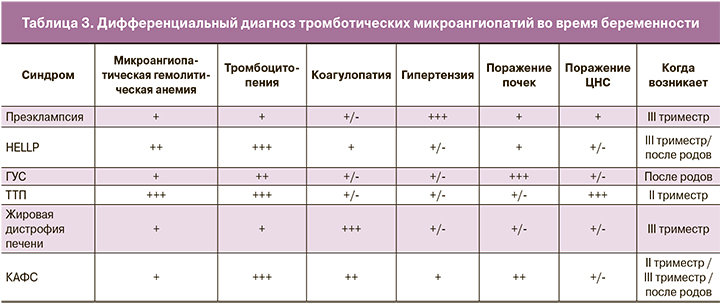
Дифференциальный диагноз включает в себя другие тромботические микроангиопатии, многие из которых связаны с беременностью. К ним относятся преэклампсия, синдром HELLP, гемолитико-уремический синдром (ГУС), тромботическая тромбоцитопеническая пурпура (ТТП), СКВ, синдром диссеминированного внутрисосудистого свертывания и острой жировой дистрофии печени у беременных. Все эти условия характеризуются микроангиопатической гемолитической анемией и тромбоцитопенией. Многие из них также включают заболевания почек, поражение ЦНС, гипертонию и коагулопатии (табл. 3) [2]. Точная диагностика имеет важное значение, так как методы лечения различаются.
Тромботические микроангиопатии
Термин «тромботическая микроангиопатия» вобрал в себя несколько нозологий, для которых характерны разные механизмы возникновения микротромбоза. В настоящий момент к тромботическим микроангиопатиям относятся 3 синдрома, требующие неотложной помощи: ТТП, HELLP-синдром, атипичный ГУС (аГУС) [36].
Эти 3 синдрома имеют сходные патологические особенности, обусловленные тромботической микроангиопатией [37], и сходные клинические особенности, которые являются различными патологиями с разными этиологией и патогенезом.
Характерными признаками тромботической микроангиопатии являются тромбоцитопения и гемолитическая анемия, что связано с потреблением и разрушением тромбоцитов и эритроцитов в микроциркуляторном русле [38].
HELLP-синдром – серьезное осложнение беременности, характеризующееся гемолизом, повышением печеночных ферментов и низким содержанием тромбоцитов, встречающееся в 0,5–0,9% всех беременностей и в 10–20% случаев – при тяжелой форме преэклампсии [39]. Этиология преэклампсии до конца не изучена. Ее возникновение может быть связано с аномальной плацентарной функцией [40].
ТТП представляет собой системное заболевание, в ходе которого происходит тромбоз микрососудов, связанное с выраженным дефицитом ADAMTS-13. В 1982 г. Moake et al. сделали предположение о возможной роли фактора Виллебранда (vWF) в развитии патогенеза ТТП [41]. ТТП также может быть наследственным, вызванным гомозиготной или гетерозиготной мутацией ADAMTS-13 [42]. При семейных формах ТТП наблюдается наследственный дефект плазменной протеазы, расщепляющей мультимеры vWF, в то время как приобретенные формы ТТП характеризуются наличием антител-ингибиторов vWF-протеазы [43].
Наследственная форма ТТП (синдром Апшою–Шульмана) встречается гораздо реже, чем приобретенная [44, 45]. Беременным женщинам с наследственным дефектом плазменной протеазы на всем протяжении беременности необходимо проводить плазменные инфузии [46]. В то время как большинство беременностей при приобретенной форме ТТП имеют благоприятные исходы [47].
Следует обратить внимание на то, что с увеличением сроков гестации происходит снижение показателей ADAMTS13. Беременность пациенткам, в анамнезе у которых имеется ТТП, особенно связанная с предыдущей беременностью, категорически противопоказана [44].
Также появились данные о том, что антитела к ADAMTS-13 могут формироваться в условиях АФС, что может являться одним из самых важных факторов развития тромботических и акушерских осложнений [48]. Данные указывают на взаимосвязь между циркуляцией АФА и приобретенным дефицитом ADAMTS-13.
ТТП характеризуется пентадой симптомов, включающей: тромбоцитопению, поражение почек, неврологическую симптоматику, микроангиопатическую анемию, лихорадку.
аГУС представляет собой тромботическую микроангиопатию, часто вызванную мутациями в генах комплемента [49]. Для аГУС характерны: тромбоцитопения, микроангиопатическая анемия, повреждения почек. Акушерский аГУС связан с неблагоприятными исходами в отношении почек [50] (табл. 4)
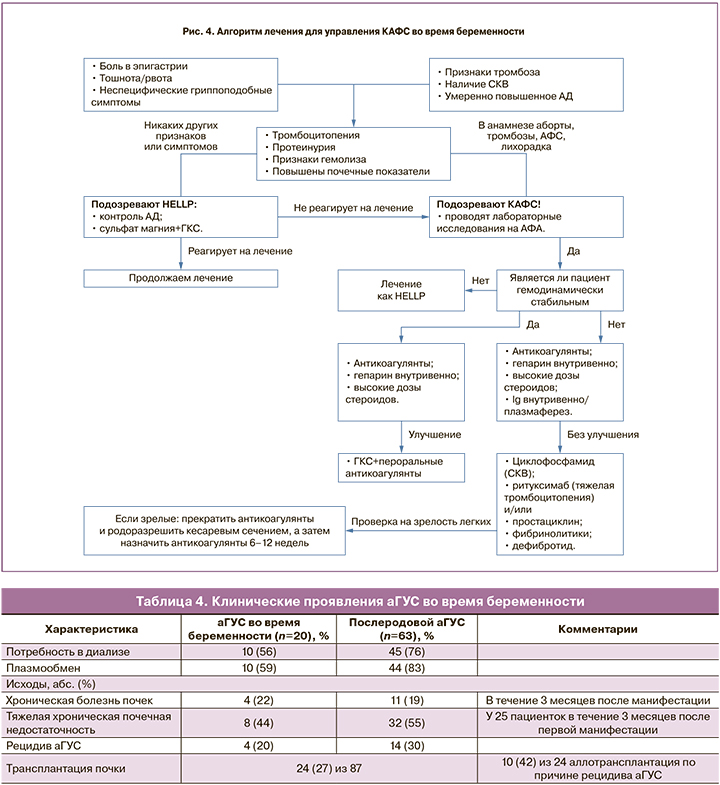
Необходимо дифференцировать ТТП/аГУС и HELLP-синдром, так как лечение этих состояний различно. Так, при HELLP-синдроме переливание плазмы требуется в редких случаях (при отсутствии улучшения состояния в течение 72 ч после родоразрешения), так как в большинстве случаев патологический процесс регрессирует самостоятельно после родоразрешения [51]. В то же время при подозрении на аГУС/ТТП необходимо незамедлительное начало переливания плазмы [52].
Лечение КАФС
Именно ранняя диагностика и своевременное начало адекватной терапии являются основными звеньями для благополучного исхода КАФС. В основе лечения синдрома Рональда Ашерсона лежит назначение антикоагулянтов, а также иммуносупрессивной терапии. Терапевтическое лечение антикоагулянтами следует назначать с внутривенного нефракционного гепарина (при отсутствии гепарин-индуцированной тромбоцитопении (ГИТ)). В дополнение к его антикоагуляционным свойствам гепарин способен ингибировать активацию комплемента и адсорбировать АФА. Гепарин можно продолжать в течение 7–10 дней. Затем пациент может быть переведен на пероральные антикоагулянты или низкомолекулярный гепарин. В случае возникновения ГИТ пациенту следует назначить другой антикоагулянт, например, фондапаринукс натрий или данапароид; низкомолекулярный гепарин не показан, так как также может привести к ГИТ [49].
Другие методы лечения сосредоточены на иммуносупрессии. Лечением первой линии, как правило, являются мегадозы глюкокортикостероидов, хотя их эффективность до конца не определена. В действительности, глюкокортикостероиды самостоятельно не способны улучшить исход, именно поэтому они всегда назначаются с антикоагулянтной терапией [7].
Оптимальное соотношение дозировки и пути введения для глюкокортикостероидов неизвестны. Обычная дозировка составляет 500–1000 мг или 1–2 мг/кг метилпреднизолона в сутки. Другие стероиды могут быть использованы в эквивалентных терапевтических дозах. Кроме того, назначают внутривенно иммуноглобулин (0,4 мг/кг в сутки, в течение 3–5 дней) или плазмаферез (2–3 л плазмы в течение 3–5 дней), так как они обладают дополнительной иммуносупрессией [50].
При лечении также необходимо исключить «триггерные» факторы. При наличии инфекционного заболевания или при подозрении на инфекцию (при отсутствии знаний об устойчивости микроорганизма) назначают антибиотики широкого спектра действия. Любая некротическая или нежизнеспособная ткань должна быть удалена.
Безопасное родоразрешение женщины с КАФС зависит от стабильности пациента, от состояния противосвертывающей системы и от возможности проведения безопасной нейроаксиальной анестезии [51].
В настоящее время существует мало данных о новых терапевтических подходах к лечению КАФС у беременных. На данный момент оценку проходит гипохолестеринемический препарат экулизумаб, ингибитор белка комплемента С5 (рис. 4).
В 2010 г. появились данные о 51-летнем мужчине с поздней стадией заболевания почек, которое развилось на фоне КАФС. Мужчине произвели трансплантацию почки от живого донора. Для предотвращения развития КАФС ему было назначено профилактическое введение экулизумаба совместно с системными антикоагулянтами и иммуносупрессорами, и после трансплантации почки уровень АФА у него оставался умеренно повышенным [53].
Заключение
Факторы риска развития КАФС должны быть тщательно оценены для каждой беременной женщины, у которой присутствует любой из этих признаков/симптомов: полиорганные тромбозы, лабораторные данные, присутствующий в анамнезе АФС. В любой момент может произойти ухудшение, которое, возможно, приведет к пагубным последствиям как для матери, так и для плода. Именно поэтому так важны детальное обследование и ведение таких пациентов. Ранняя диагностика и правильно подобранное лечение остаются ключевыми факторами для благополучного исхода.



