Программы с использованием донорских гамет и эмбрионов способствуют решению проблем бесплодия разной этиологии. Исторически сложилось так, что использование донорской спермы (ДС) изначально планировалось при мужском бесплодии, а именно азооспермии, тяжелой олигозооспермии и другой выраженной патозооспермии или нарушениях эякуляции у мужчины. Позже к показаниям добавились наследственные заболевания, наличие у мужа (партнера) неизлечимой инфекции, передаваемой половым путем, а также следующие показания со стороны женщины: отрицательный Rh-фактор и тяжелая Rh-изоиммунизация при наличии положительного Rh-фактора у супруга, вынужденное бесплодие, связанное с отсутствием полового партнера [1]. Первая беременность, возникшая в результате переноса донорского эмбриона (ДЭ), была зарегистрирована в 1983 г. у женщины с овуляторным менструальным циклом, но бесплодной [2]. Беременность закончилась самопроизвольным абортом на сроке 10 недель. Через 4 месяца первые успешные беременности, полученные в результате оплодотворения донорских яйцеклеток спермой партнеров, закончившиеся впоследствии рождением здоровых детей, были зарегистрированы сразу у двух женщин [3]. Основными показаниями для проведения программ вспомогательных репродуктивных технологий (ВРТ) с использованием донорских ооцитов (ДО) являются: отсутствие ооцитов, обусловленное естественной менопаузой, синдром недостаточности яичников, состояние после овариэктомии, химиотерапия, генетические заболевания; неудачные повторные попытки переноса эмбрионов при 3 и более попытках в программах экстракорпорального оплодотворения (ЭКО) и интрацитоплазматической инъекции сперматозоида (ИКСИ); недостаточный ответ яичников на стимуляцию, неоднократное получение эмбрионов низкого качества, перенос которых не приводит к наступлению беременности; наличие у женщины генетических заболеваний, сцепленных с полом [1]. Перенос ДЭ рассматривается при отсутствии у партнеров собственных половых клеток, высоком риске передачи наследственных заболеваний, неоднократном получении эмбрионов низкого качества, перенос которых не приводит к наступлению беременности в паре [1, 4].
В нашей стране первый банк ДС был создан в Международном центре репродуктивной медицины (МЦРМ, Санкт-Петербург) в 1995 г. [5]; за 25 лет его деятельности в программе приняли участие 119 доноров. В том же году в МЦРМ был проведен первый в России цикл с использованием свежих донорских яйцеклеток [6]. Следом за этим была начата работа по криоконсервации яйцеклеток и созданию банка ДО. Уже в 2003 г. впервые в практике ЭКО в России на свет родилась тройня после переноса эмбрионов, полученных из размороженных ДО [7]. Накопленный опыт позволяет нам на собственных данных провести анализ эффективности программ лечения бесплодия с использованием донорских гамет и эмбрионов в циклах ВРТ.
Материалы и методы
Материалом для исследования послужили данные о результативности циклов с использованием ДС, свежих и размороженных ДО, а также с использованием ДЭ. Для участия в программах ВРТ с использованием ДС, ДО, ДЭ отбирались пациенты по показаниям, перечисленным в п.п. 55, 63, 74 Приказа Министерства здравоохранения Российской Федерации №107н от 30.08.2012. Процедуры проводились в соответствии с национальными этическими нормами и условиями Хельсинкской декларации. Все доноры и пациенты подписали информированное добровольное согласие на проведение исследования и обработку персональных данных, включая данные историй болезни, при условии обезличенного использования для публикаций.
Отбор претендентов в программу ДС и ДО соответствовал требованиям, перечисленным в Приказе Министерства здравоохранения Российской Федерации №107н с некоторыми дополнительными условиями, определенными на основе опыта работы МЦРМ. Все претенденты проходили дополнительное обследование у психолога и медико-генетическое тестирование, которое включало в себя анализ не только кариотипа, но и мутаций в генах, определяющих четыре самых частых аутосомно-рецессивных наследственных заболевания в России (муковисцидоз, фенилкетонурия, несиндромальная нейросенсорная тугоухость, спинальная мышечная атрофия). Каждый донор ооцитов имел как минимум одного здорового ребенка. Возраст доноров спермы составил от 18 до 33 лет включительно, что на 2 года меньше установленных законом рамок. Дополнительным требованием было также наличие постоянной или временной регистрации в Ленинградской области или Санкт-Петербурге не менее 1 года, что позволяло обеспечивать постоянный контакт с донором.
В ходе исследования была проанализирована результативность 165 циклов с использованием ДС из криобанка МЦРМ с 2014 по 2018 гг. Критериями исключения из анализа были: использование собственных криоконсервированных ооцитов пациенток, суррогатное материнство, отсутствие переноса эмбрионов в свежем цикле. Главным исследуемым параметром была частота наступления клинической беременности (ЧНКБ) в расчете на перенос эмбрионов в свежем цикле в зависимости от возраста женщины.
Соотношение по возрастам женщин-реципиентов в программах с использованием ДО рассчитывали на основе данных 299 циклов, проведенных по этой программе в МЦРМ за 2017 и 2018 гг. Были проанализированы результаты эффективности программ ДО в 145 циклах с использованием свежих ооцитов и 154 циклах с применением криоконсервированных ДО, а также 32 циклов с ДЭ, выполненных в МЦРМ в этот период. В качестве критерия для оценки использовались показатели ЧНКБ на перенос и кумулятивная ЧНКБ на цикл, а также данные о рождении детей.
Криоконсервация спермы доноров проводилась в виалах сразу после ее анализа (спермограммы) в соответствии с рекомендациями производителя среды для криоконсервации спермы SpermFreeze (FertiPro, Бельгия). Хранение замороженных образцов ДС осуществлялось в жидком азоте или парах азота в сосудах Дьюара [5].
Оплодотворение и культивирование
Сперму для оплодотворения обрабатывали стандартным методом с использованием SupraSperm (Origio, Дания), центрифугировали, промывали 2 раза средой Sperm medium (COOK, Австралия) и помещали на 1–3 ч в инкубатор 37°С, с 6% углекислого газа для всплытия подвижной фракции сперматозоидов (swim-up) до момента оплодотворения. Свежие ооциты оплодотворяли методом ЭКО или ИКСИ в зависимости от качества спермы через 4–5 ч после пункции фолликулов. Оплодотворение методом ЭКО проводили в каплях среды Universal IVF medium (Origio, Дания) под маслом. После проведения ИКСИ клетки переносили в культуральную среду Cleavege medium (COOK, Австралия) под маслом и инкубировали. Через 16–18 ч проверяли результат оплодотворения (наличие двух пронуклеусов). Размороженные ооциты оплодотворяли только методом ИКСИ. Полученные в результате оплодотворения зиготы переносили в культуральную среду Cleavege medium (COOK, Австралия), культивировали до 3-го дня развития c заменой среды на Blastocyst medium (COOK, Австралия) и продолжали культивирование с 3-го до 5/6-го дня развития в инкубаторе [5]. Для морфологической оценки бластоцист использовали классификацию Гарднера [8].
Криоконсервацию ооцитов и эмбрионов проводили методом витрификации в соответствии с рекомендациями производителя (Kitazato Supply Co., Япония). Ооциты витрифицировали через 1–1,5 ч после пункции фолликулов и отбора зрелых ооцитов MII. Эмбрионы, достигшие стадии бластоцисты отличного и хорошего качества, криоконсервировали на 5–6-й день развития. На один крионоситель помещали не больше 3–4 ооцитов, 2–3 эмбрионов или по 1 эмбриону в случае проведения преимплантационного генетического тестирования на анеуплоидии (ПГТ-А). Сразу после витрификации крионосители помещали в криохранилище для последующего хранения в жидком азоте [5].
Размораживание и реабилитация ооцитов и эмбрионов проводились на специализированных средах (Kitazato Supply Co., Япония) в соответствии с протоколом производителя. После разморозки ооцитов через 2 ч прекультивирования в среде Universal IVF medium (Origio) под маслом в условиях 37°С в атмосфере 6% углекислого газа, 5% кислорода, 89% азота проводили оплодотворение методом ИКСИ. После разморозки эмбрионов проводили прекультивирование в среде Blastocyst medium (COOK, Австралия) под маслом в инкубаторе в течение 2–3 ч до переноса эмбрионов в полость матки [5].
ПГТ-А было выполнено для ДЭ, полученных в результате оплодотворения донорских гамет, достигших стадии бластоцисты отличного и хорошего качества. Для этого на 4-й день развития проводили хетчинг с помощью лазера. На 5–6-й день развития была выполнена биопсия клеток трофэктодермы с использованием лазера (cutting) либо механически, путем притирания биопсийной пипетки о присоску (flipping). После проведения биопсии трофэктодермы бластоцисты замораживали методом витрификации, как описано выше. Клетки трофэктодермы сразу после биопсии перекладывали в фосфатный буфер, замораживали и хранили до проведения амплификации и последующего секвенирования. Полногеномную амплификацию проводили с использованием набора реактивов SmarTer PicoPLEX WGA Kit (Takara Boi, США) по протоколу производителя. Качественную оценку амплификата осуществляли методом электрофореза в 1,5% агарозном геле. Количество амплификата оценивали на флюориметре Qubit 4.0 с использованием набора реактивов Qubit ds DNA BR Assay Kits (Invitrogen, Life technologies, США) согласно рекомендациям производителя. Секвенирование и анализ численных хромосомных аномалий выполняли методом массового параллельного секвенирования нового поколения (NGS) с использованием оборудования Illumina MiSeq и программного обеспечения BluFuse Multi v 4.3 (Illumina, США) согласно протоколу производителя на базе в СПб ГБУЗ «Городская больница № 40» и ООО «Сербалаб».
Перенос эмбриона(-ов) являлся заключительным этапом цикла ВРТ. В свежем цикле перенос осуществлялся на 4–5-е сутки развития эмбрионов, для размороженных эмбрионов проводился после их реабилитации в течение 2–3 ч в условиях СО2-инкубатора [5]. Катетер для переноса выбирался в зависимости от клинической ситуации и предпочтений врача-репродуктолога, осуществляющего перенос: Cook (СООК Medical, США), Wallace Classis (Smiths Medical, Великобритания) или Fridman (Laboratoire C.C.D., Франция). Решение о количестве переносимых эмбрионов (не более 2) принималось врачом акушером-гинекологом, исходя из клинической ситуации, качества эмбрионов и желания пациентки.
Результаты и обсуждение
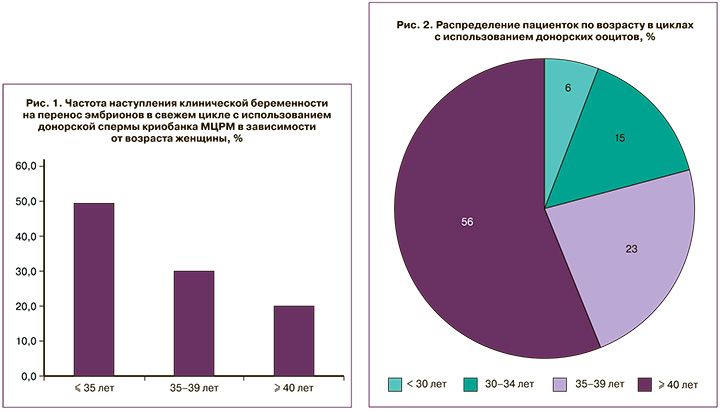
Для оценки результативности программ с использованием ДС была выполнена оценка ЧНКБ в расчете на перенос эмбрионов в свежем цикле, отобранных для анализа на основе критериев, описанных выше, без дифференцировки метода оплодотворения (ЭКО/ИКСИ). Значения среднего приводятся с указанием в скобках стандартного отклонения. Пациентки были разделены на три возрастные группы: до 34 лет включительно (группа 1, средний возраст 30,1 (2,8) года, 99 циклов), 35–39 лет (группа 2, средний возраст 37,0 (1,2) года, 46 циклов), 40 лет и старше (группа 3, средний возраст 41,8 (1,9) года, 20 циклов). Наиболее высокое значение ЧНКБ было достигнуто в самой молодой возрастной группе 1, для которой оно составило 49,5%, тогда как в группе 2 получена ЧНКБ 30,4%, а в группе 3 – 20,0% (рис. 1). Полученная закономерность полностью соответствует распределению доли эуплоидных эмбрионов в зависимости от возраста матери [9].
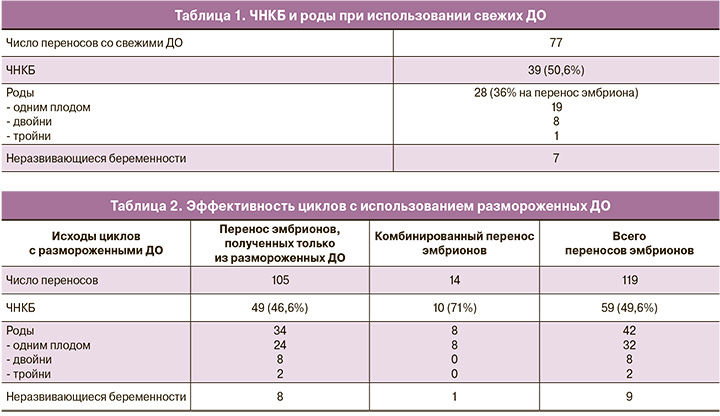
По анализу 299 циклов с ДО, включая использование свежих и размороженных ДО, с переносом эмбрионов как в свежем, так и в криоцикле были получены данные о востребованности таких программ в зависимости от возраста женщины (рис. 2). В 56% таких циклов возраст женщин-реципиентов был выше 40 лет. Эти данные согласуются с результатами анализа данных Национальной системы мониторинга ВРТ, входящей в состав Центра контроля и предупреждения заболеваний (США) [10].
Согласно литературным данным, результативность циклов с ДО возрастает при переносе эмбрионов 5-го дня развития по сравнению с переносом эмбрионов 3-го дня развития (29,6% против 23,3%), а также при селективном переносе одного эмбриона по сравнению с неселективным переносом одного эмбриона (44,7% против 24,9%) [10]. Под селективным переносом одного эмбриона подразумевался перенос одного эмбриона при наличии дополнительных эмбрионов, которые впоследствии были криоконсервированы. В нашем исследовании большая часть эмбрионов, полученных из ДО, были перенесены на 5-й день развития, в том числе с использованием селективного переноса при наличии такой возможности.
В 145 циклах, проведенных со свежими ДО, в 55 циклах оплодотворение было выполнено методом ЭКО, а в 90 – методом ИКСИ; в среднем у доноров получали 18,1 (7,7) ооцита, 79,4% из них были пригодны для оплодотворения, что составило в среднем 14,4 (6,3) ооцита на пациентку. Перенос в свежем цикле выполнен у 77 пациенток (53% случаев). В 12 случаях переносили один эмбрион (15,6% случаев), в 65 – 2 эмбриона (84,4% случаев). ЧНКБ составила 50,6%, что демонстрирует высокую эффективность программы (табл. 1). Полученная нами эффективность циклов с использованием свежих ДО оказалась немного выше показателей, имеющихся в литературе [11, 12].
В 125 циклах (86% от начатых) были получены эмбрионы хорошего качества, пригодные для криоконсервации; в дальнейшем они были использованы для переносов пациенткам в криоциклах. Кумулятивная ЧНКБ в этой группе составила 66%, что привело к рождению 76 живых детей (исход 14 беременностей неизвестен). Такая стратегия позволила дополнительно увеличить эффективность выполненных программ.
Криоконсервированные ДО из банка доноров МЦРМ были использованы в 154 циклах; в 59 из них размораживание ооцитов было приурочено ко дню пункции реципиентки («комбинированные» циклы с использованием свежих ооцитов пациентки и размороженных ДО); в 95 случаях у реципиентов пункции не проводились и не планировались. Размораживали в среднем 7,9 (4,4) ооцита на пациента, при этом 6,4 (3,4) были пригодны для оплодотворения. Частота выживаемости ооцитов после криоконсервации составила 79,8%. Перенос одного эмбриона был выполнен в 54 циклах (45,4%), двух – в 65 циклах (54,6%). В циклах с использованием размороженных ДО ЧНКБ составила 49,6%, причем наилучший результат (71%) – в циклах с «комбинированным» переносом двух эмбрионов (один эмбрион из размороженных ДО, второй – из свежего ооцита пациентки (табл. 2)).
В 59 циклах (38% от начатых) были получены эмбрионы хорошего качества, пригодные для криоконсервации; в дальнейшем они были использованы для переносов пациенткам в криоциклах. Кумулятивная ЧНКБ в группе пациентов, где для переноса использовали только эмбрионы, полученные из размороженных ДО без учета результативности комбинированных циклов, составила 53%, что привело к рождению 56 живых детей (исход 10 беременностей неизвестен).
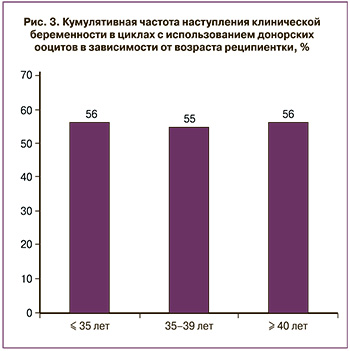 Кумулятивная частота наступления беременности в циклах с ДО (свежие/криоконсервированные) не различалась у пациентов разных возрастных групп (рис. 3).
Кумулятивная частота наступления беременности в циклах с ДО (свежие/криоконсервированные) не различалась у пациентов разных возрастных групп (рис. 3).
В литературе существуют противоречивые данные о сравнении преимуществ программ с использованием свежих и криоконсервированных ДО; эффективность программ с размороженными ДО составляет от 46 до 59% [11, 12]. Нам не удалось выявить значимых различий в ЧНКБ для циклов с использованием свежих и размороженных ДО. Некоторое увеличение кумулятивной ЧНКБ в циклах со свежими ДО может быть связано с большим числом ДО, использованных в каждом цикле, в результате чего число эмбрионов хорошего качества, пригодных для криоконсервации и последующего переноса в криоциклах, было больше.
В 32 циклах с использованием ДЭ для пациентов МЦРМ был выполнен перенос 38 размороженных ДЭ, в том числе в 79% был выполнен перенос одного эмбриона на основе данных морфологической оценки и результатов ПГТ-А. Кумулятивная ЧНКБ в этой группе составила 78%, что привело к рождению 18 живых детей, в том числе в составе двух беременностей двойней, из которых одна монохориальная наступила в результате криопереноса единственного эмбриона после ПГТ-А.
Ежегодно в США проводится около 20 000 циклов ВРТ с использованием ДО и ДЭ [13]; в России эта цифра составляет около 10 000 и имеет тенденцию к росту [14, 15]. Очевидно, что программы с применением донорских гамет в соответствии с медицинскими показаниями позволяют достичь наступления беременности у пациентов, имеющих существенные ограничения для использования собственных половых клеток. Так, в России в 2017 г. ЧНКБ в программе донорства ооцитов составила в расчете на цикл 44,3%, на перенос – 45,5% [15]; в США в 2016 г. ЧНКБ с криоконсервированными ДО составила 54,7% [16], со свежими – 65%; в АО «МЦРМ» за период 2017–2018 гг. кумулятивная ЧНКБ составила 53 и 66% в программах с криоконсервированными и свежими ДО соответственно. За 2017 г. в России по программе «Донорство эмбрионов» было проведено 1384 переноса эмбрионов, в результате наступили 642 беременности (46,4%) [15]; в США в 2016 г. ЧНКБ по этой программе составила 56% [16]; в МЦРМ за период 2017–2018 гг. кумулятивная ЧНКБ при переносе ДЭ – 78%.
Заключение
Полученные нами результаты свидетельствуют о высокой эффективности использования ДС, ДО и ДЭ в программах ВРТ для преодоления бесплодия и соответствуют, а по некоторым параметрам даже превосходят опубликованные общероссийские и мировые показатели работы центров ВРТ с донорскими гаметами.



