Преждевременные роды (ПР) являются основной причиной неонатальной заболеваемости и смертности во всем мире [1]. У недоношенных детей часто развиваются хронические респираторные и сердечно-сосудистые заболевания, бронхолегочная дисплазия, отмечается высокий риск физических и психоневрологических дефицитов [2]. Преждевременный разрыв плодных оболочек (ПРПО) при недоношенной беременности имеет место в 30% всех спонтанных ПР и является важной проблемой в акушерской практике [3]. Патогенез разрыва плодных оболочек и последующие материнские и неонатальные заболевания четко ассоциированы с инфекцией [4, 5]. В 80% случаев роды происходят в течение 9 дней с момента разрыва оболочек; за этот промежуток времени полость матки, плацента и плод в результате восходящей инфекции подвержены высокому риску развития хориоамнионита и фунисита, которые связаны с неблагоприятными материнскими и неонатальными исходами [6–10]. Изучение микробиоты влагалища у беременных и ее особенностей при дисбиотических нарушениях играет важную роль для исхода беременности [11, 12]. Дисбиотическая вагинальная микробиота является признанным фактором риска для досрочного ПРПО (22–36 недель и 6 дней) [13–15].
Цель исследования – исследовать микробиоту влагалища у женщин с ПРПО в сроке беременности 22–36 недель и 6 дней.
Материалы и методы
Проведено одномоментное сравнительное исследование. Обследованы 150 женщин в возрасте от 18 до 40 лет. Все пациентки разделены на 3 группы: 1-ю группу составили 50 пациенток с ПРПО в сроке беременности до 36 недель и 6 дней, 2-ю группу – 50 пациенток с интактными плодными оболочками в сроке до 36 недель и 6 дней, 3-ю группу – 50 соматически здоровых беременных с неотягощенным акушерско-гинекологическим анамнезом и спонтанными своевременными (≥37 недель) родами. Критерии включения в 1-ю и 2-ю группы: одноплодная спонтанно наступившая беременность, завершившаяся ПР в 22–36 недель и 6 дней с ПРПО (1-я группа) и ПР при наличии интактных плодных оболочек (2-я группа). Критерии включения в 3-ю группу: одноплодная, спонтанно наступившая беременность, завершившаяся своевременными спонтанными родами (≥37 недель). У всех пациенток было получено информированное согласие на участие в исследовании. Критерии исключения: многоплодная беременность, наступление беременности в результате применения вспомогательных репродуктивных технологий (ВРТ), структурные и хромосомные аномалии, тяжелая соматическая патология у беременной, развитие преэклампсии (ПЭ) во время данной беременности, пороки развития матки, проведение антибактериальной терапии.
У 150 беременных одномоментно взят материал из заднего свода влагалища для культурального исследования, микроскопии вагинальных мазков по Граму и количественной полимеразной цепной реакции (ПЦР) («Фемофлор-16»). Сбор материала в группе беременных с ПРПО производился на момент разрыва плодных оболочек и до проведения антибиотикотерапии.
Комплексное микробиологическое исследование включало оценку микробиоценоза влагалища по данным микроскопии мазка вагинального отделяемого, окрашенного по Граму, и культурального исследования в соответствии с медицинской технологией «Интегральная оценка состояния микробиоты влагалища. Диагностика оппортунистических вагинитов». Вагинальное отделяемое засевали на стандартные питательные среды. Для выделения факультативно-анаэробных микроорганизмов использовали: колумбийский агар, маннит-солевой агар (Сonda, Испания), среду Эндо и агар Сабуро (ФГУН «ГИЦПМиБ», Оболенск, Россия). Лактобактерии культивировали на среде Лактобакагар (ФГУН «ГИЦПМиБ», Оболенск, Россия), строгие анаэробы – на прередуцированном агаре Schaedler (Сonda, Испания) с необходимыми добавками. Инкубировали посевы в условиях СО2-инкубатора (Jouan, Франция). Строгие анаэробы и лактобациллы культивировали в анаэробном боксе (Jouan, Франция) в атмосфере трехкомпонентной газовой смеси (N2 – 80%; CO2 – 10%; Н2 – 10%). Видовую идентификацию микроорганизмов проводили методом MALDI TOF MS с использованием времяпролетного масс-спектрометра AutoFlex III c программным обеспечением MaldiBioTyper (BrukerDaltoniks, Германия). Молекулярно-генетическое исследование микроценоза влагалища методом количественной ПЦР проводили, используя тест-систему «Фемофлор-16» (ООО «НПО ДНК-Технология», Россия) в детектирующем амплификаторе ДТ-96 (ООО «НПО ДНК-Технология», Россия), согласно инструкции производителя.
Для проведения клинико-анамнестической характеристики исследуемых групп женщин использовали следующее описание: количественные данные были представлены в виде среднего арифметического и стандартного отклонения M (SD). Для сравнения групп по качественным бинарным признакам использовали метод хи-квадрат Пирсона, если одно из значений было менее 5 – применяли точный метод Фишера. Статистически значимыми считались различия при уровне значимости p<0,05.
Данные по образцам представлены в виде содержания микроорганизмов или их подгрупп (далее «микроорганизмы»). Доля каждого микроорганизма определялась степенью обсемененности в КОЕ/мл и ГЭ. Описательная статистика по микроорганизмам была представлена в виде медианы (Me) и квартилей Q1 и Q3 по группам в формате Me(Q1;Q3). С точки зрения клинической значимости учитывали представленность микроорганизма в умеренной или высокой концентрации (>104 КОЕ/мл), а также в низкой (<=104 КОЕ/мл). Поэтому для выявления статистической значимости межгрупповых различий использовали точный критерий Фишера, оценивающий частоту встречаемости микроорганизмов с высокой (умеренной) и низкой степенью обсемененности в тестируемых группах.
Так как выбранный критерий предназначен для сравнения двух групп, а в исследовании принимали участие три группы, то для большей информативности в первом блоке тестов критерий рассчитывался 6 раз:
- 3 раза – попарно между группами (соответственно сравнение 1-й и 2-й, 1-й и 3-й, 2-й и 3-й групп);
- 3 раза – отдельно для каждой группы (при делении всей выборки в понимании «целевая группа» и «остальные» соответственно, сравнение 1-й и (2-й, 3-й), 2-й и (1-й, 3-й), 3-й и (1-й, 2-й) групп; символ обозначает объединение двух групп, которые включаются в «остальные»).
Некоторым пациенткам из 1-й и 2-й групп проводили хирургическую коррекцию (ХК) истмико-цервикальной недостаточности в течение беременности. Это могло повлиять на состав микробиоты влагалища на момент забора материала. Для выявления возможных различий внутри или между группами исследования, к которым могли привести последствия ХК, проводили второй блок статистических тестов также с применением точного критерия Фишера. На этом этапе проводили расчет внутри групп: сравнивали частоту представленности микроорганизмов с высокой и низкой концентрацией в образцах пациенток 1-й группы, прошедших через ХК (1-я: c ХК) и не прошедших (1-я: без ХК); аналогичный анализ проводился внутри 2-й группы исследования. Также проводили попарное сравнение групп исследования только на образцах пациенток с ХК (тест для 1-й: с ХК и 2-й: с ХК) и на образцах пациенток без ХК (соответственно тесты для 1-й: без ХК и 2-й: без ХК, 2-я: без ХК и 3-я, 1-я: без ХК и 3-я). Для всех расчетов точного критерия Фишера статистически значимыми считали значения р<0,05.
Для визуализации наиболее значимых данных использовали тепловую карту, отображающую профиль представленности микроорганизмов по образцам. Эти микроорганизмы были отобраны после проведения статистических тестов (по точному критерию Фишера, описаны выше), так как их степень обсемененности значительно (p<0,05) отличалась между группами исследования, согласно как минимум одному из тестов.
Статистическая обработка и визуализация проведены с применением пакета прикладных программ Statistica 7.0 и дополнительных программных разработок на языке Python 2.7 и его библиотек: Sklearn, Skipy, Pandas, Matplotlib.
Результаты
Клинико-анамнестические данные беременных представлены в табл. 1.
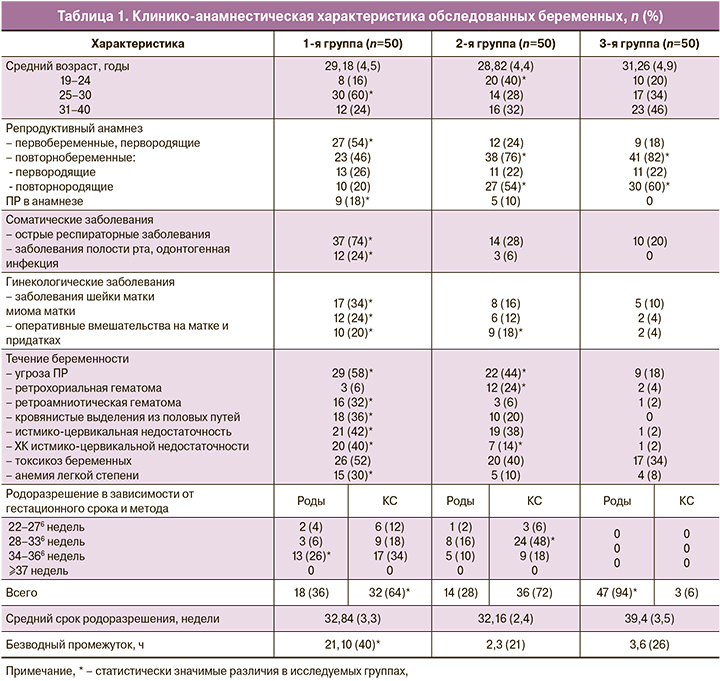
Возраст обследованных женщин колебался в пределах от 19 до 40 лет и в среднем составил 29,54 (5,0) года: в 1-й группе – 29,18 (4,5) года, во 2-й группе – 28,82 (4,4) года, в группе контроля – 31,26 (4,9) года. В группе беременных с ПРПО значительно чаще встречались женщины в самом активном репродуктивном возрасте – 25–30 лет (p=0,001). Статистически значимо чаще встречались первобеременные первородящие женщины в 1-й группе – 27 (54%) по сравнению со 2-й и 3-й группами – 12 и 9 (24% и 18% соответственно; p<0,001). Статистически значимых различий между повторнобеременными первородящими не было выявлено. Повторнобеременные повторнородящие с наибольшей частотой встречались во 2-й и 3-й группах – 27 и 30 (54% и 60% соответственно) по сравнению с 1-й группой – 10 (20%), р<0,001. Женщины с ПРПО были соматически отягощены частыми респираторными и одонтогенными воспалительными заболеваниями; при изучении гинекологического анамнеза встречались заболевания шейки матки, миома матки. Для беременных с ПРПО было характерно сочетание нескольких факторов риска, имевших место при данной беременности: угрожающий выкидыш, обусловленный наличием протракционной ретроамниотической гематомы, волнообразный характер кровянистых выделений из половых путей, развитие истмико-цервикальной недостаточности, требующей хирургической коррекции. Средний гестационный срок при родоразрешении в группe с ПР составил 32,84 (3,3) недель, во 2-й группе – 32,16 (2,4) недель и в 3-й группе – 39,4 (3,5) недель беременности. У беременных с ПРПО статистически значимо чаще проводилось кесарево сечение (КС), однако в 34–36 недель и 6 дней беременности – родоразрешение через естественные родовые пути. Продолжительность безводного промежутка статистически выше в группе с ПРПО, варьировала от 50 минут до 105 ч 40 минут и в среднем составила 21 ч 10 (40) минут по сравнению со 2-й и 3-й группами – 2,3 (21 минута) и 3,6 (26 минут) соответственно (p<0,001). Наиболее частыми показаниями к оперативному родоразрешению в группе с ПРПО явились: ангидрамнион (при безводном промежутке свыше 24 ч), отсутствие регулярной родовой деятельности, нарушение состояния плода по данным ультразвукового исследования (УЗИ) и допплерометрии; в группе с интактным плодным пузырем – ухудшение состояния плода, слабость родовой деятельности, начавшаяся острая гипоксия плода. Средняя масса тела при рождении в 1-й группе женщин составила 2000,0 (605,0) г, вo 2-й группе – 1917,0(485,0) г, a в 3-й группе – 3308,0 (209,0) г (p=0,01).
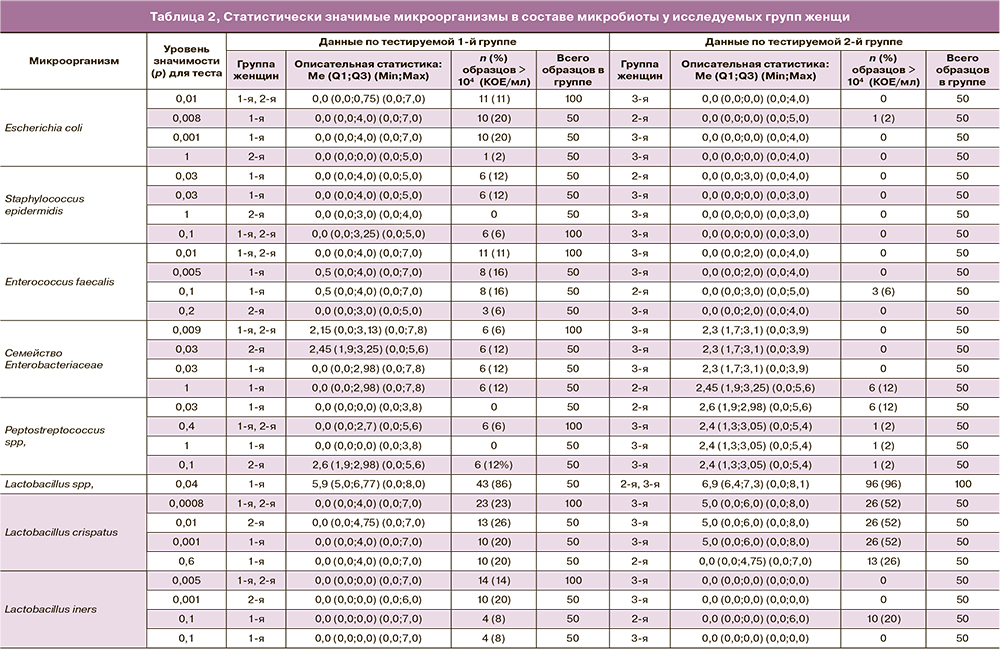
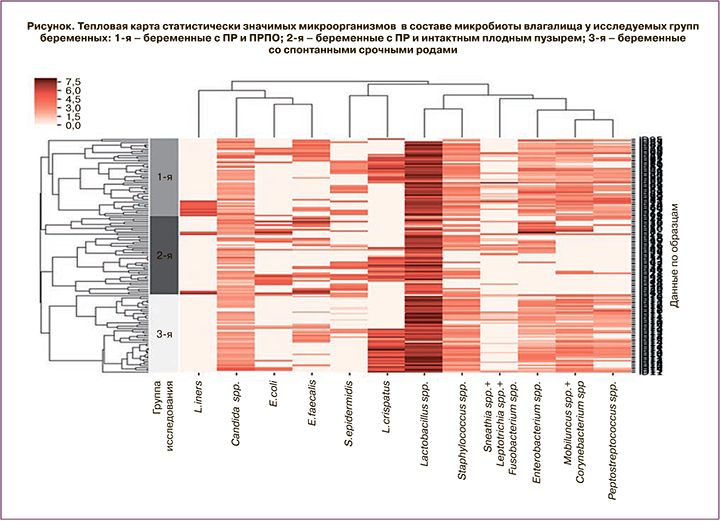
Проведенное исследование показало, что во всех трех группах женщин микробиота влагалища характеризовалась разнообразием видового состава: выявлено 44 группы микроорганизмов, включая лактобациллы и условно-патогенные микроорганизмы (УПМ). При проведении статистического анализа, касающегося частоты выявления микроорганизмов и степени обсемененности ими вагинальных образцов, отобраны 12 статистически значимых видов или групп микроорганизмов (рисунок). Микроорганизм считался статистически значимым, если при оценке различий между группами и подгруппами (с ХК, без ХК) исследования на это указывал хотя бы один из проводимых тестов (p<0,05). Результаты расчетов, выявивших высокий уровень значимости отобранных микроорганизмов, приведены в табл. 2.
На рисунке представлена тепловая карта – графическое изображение частоты обнаружения отобранных микроорганизмов в группах исследования и их количественные характеристики. Присутствующая на графике дендрограмма отображает результат предварительного кластерного анализа с выбранной метрикой расстояния – коэффициент корреляции Спирмена. Кластерный анализ выполнен между микроорганизмами (столбцы) и внутри групп исследования (состав микрофлоры влагалища по образцам выведен построчно).
Статистически значимые микроорганизмы и их статистическое описание (медиана (Me) и квартили Q1 и Q3 по группам в формате Me (Q1;Q3)) приведены в табл. 2.
При сравнительном изучении микробиоты у пациенток 1-й, 2-й и 3-й групп, по данным культурального исследования и количественной ПЦР (см. табл. 2), выявлены следующие статистически значимые виды УПМ и лактобацилл: Escherichia coli (E. coli), Staphylococcus epidermidis (S. epidermidis), Enterococcus faecalis (E. faecalis), Enterobacteriaceae spp., Peptostreptococcus spp., Lactobacillus crispatus (L. crispatus) и Lactobacillus iners (L. iners) (p<0,05), согласно тесту Фишера.
E. coli в умеренной или высокой концентрации (104–107 КОЕ/мл) встречалась значительно чаще (11/100 (11%) у беременных с ПР (суммарно 1-я и 2-я группы)) (Me (Q1;Q3) – 0,0 (0,0;0,75), тогда как у большинства беременных контрольной группы этот микроорганизм отсутствовал или в единичных случаях встречался с низкой степенью обсемененности (менее 104 КОЕ/мл) (0,0 (0,0;0,0), p=0,01. При сравнении этого показателя в 1-й и 2-й группах установлено, что у женщин с ПРПО E. coli в умеренной или высокой концентрации встречалась в 10 раз чаще (20 и 2% соответственно), чем при ПР у женщин с интактным плодным пузырем (соответственно 0,0 (0,0;4,0) и 0,0 (0,0;0,0), p=0,008). В то же время по частоте выявления и степени колонизации вагинального биотопа E. coli пациентки 2-й и 3-й групп статистически значимо не отличались, p=1.
E. faecalis статистически чаще (11/100 (11%)) в умеренной и высокой концентрации (104–107 КОЕ/мл – 0,0 (0,0;4,0)) выделяли у пациенток с ПР (суммарно 1-я и 2-я) в сравнении с контрольной группой (менее 104 КОЕ/мл – 0,0 (0,0;2,0)), p=0,01. Максимальное отличие в сравнении с контрольной группой отмечено для пациенток 1-й группы (8/50 (16%)), p=0,005, тогда как для 2-й группы (3/50 (6%)) статистически значимого отличия в сравнении с контрольной и 1-й группами не получено (p=0,2 и p=0,1 соответственно).
S. epidermidis в 1-й группе встречался в умеренных концентрациях (104–105 КОЕ/мл; 0,0 (0,0;4,0)) у 6 (12%) женщин, тогда как во 2-й и 3-й группах – 0,0 (0,0;3,0) и 0,0 (0,0;0,0) данный микроорганизм либо отсутствовал, либо степень обсемененности была низкой (менее 104 КОЕ/мл). Статистически значимая разница отмечена между 1-й и 3-й (p=0,03) и между 1-й и 2-й группами (p=0,03).
По данным количественной ПЦР представители семейства Enterobacteriaceae обнаружены в 12 (12%) случаях в группе беременных с ПР (суммарно 1-я и 2-я) в умеренной и высокой концентрации (104–107,8 ГЭ – 2,15 (0,0;3,13)), тогда как в 3-й группе для большинства беременных характерна низкая концентрация (до 103,9 ГЭ – 2,3 (1,7;3,1)) соответственно, p=0,009. В 1-й и 2-й группах УПМ семейства Enterobacteriaceae в значимых концентрациях выявлены с одинаковой частотой (по 6/50 (12%)), и при сопоставлении с контрольной группой получено статистически значимое отличие (p=0,03). При сравнительном изучении данного микроорганизма в 1-й и 2-й группах статистически значимых различий не выявлено (p=1).
При изучении роли строгих анаэробов рода Peptostreptococcus показано, что они, напротив, встречались в умеренной концентрации (до 105,6 ГЭ – 2,6 (1,9;2,98)) чаще во 2-й группе (у 6/50 (12%)) беременных, тогда как у большинства беременных 1-й группы отсутствовали и с меньшей частотой встречались в низкой концентрации (до 103.8 ГЭ – 0,0 (0,0;0,0)), p=0,03. При сравнении 1-й и 3-й; суммарно 1-й и 2-й от 3-й; 2-й и 3-й групп статистически значимых различий не выявлено.
По данным прямого белкового профилирования методом MALDI TOF MS идентифицировано 12 видов лактобацилл. Доминирующими были четыре вида: L. crispatus, L. gasseri, L. jensenii и L. iners. Согласно критерию Фишера, статистически значимыми оказались: L. crispatus и L. iners, p<0,05.
Вид L. сrispatus в высокой концентрации (105–108 КОЕ/мл – 5,0 (0,0;6,0)) с наибольшей частотой выделяли в контрольной группе (26/50 беременных, 52%), а при ПР (суммарно в 1-й и 2-й) – статистически реже (23/100, 23%) (до 107 КОЕ/мл – 0,0 (0,0;4,0)), p=0,0007. У 77 женщин с ПР отмечалось значительное снижение концентрации L. crispatus, не превышавшее 104 КОЕ/мл. Отдельное сравнение этого показателя в 1-й и 3-й и во 2-й и 3-й группах также показало значительно более высокую степень обсемененности вагинального отделяемого L. crispatus в группе контроля (p=0,001 и p=0,01 соответственно). При сравнении 1-й и 2-й групп статистически значимых различий не выявлено.
Напротив, вид L. iners статистически чаще встречался у женщин в группе с ПР (суммарно 1-я и 2-я) (14/100, 14%) с некоторым преобладанием во 2-й группе (в 10 из 14 случаев), степень обсемененности варьировала в пределах 104–107 КОЕ/мл (p=0,001), тогда как в контрольной группе он отсутствовал (p=0,005).
Следует отметить, что в течение данной беременности у 20 (40%) женщин 1-й группы и 7 (14%) женщин 2-й группы произведена ХК истмико-цервикальной недостаточности, однако при изучении микробиоты влагалища статистически значимых различий не выявлено.
Обсуждение
Полученные нами результаты показали, что во всех трех группах беременных микробиота влагалища характеризовалась разнообразием видового состава УПМ, однако выраженные дисбиотические нарушения, сопровождающиеся дефицитом лактобацилл и пролиферацией УПМ с преобладанием представителей семейства Enterobacteriaceae (преимущественно E. coli), E. faecalis, S. epidermidis, Peptostreptococcus spp., чаще наблюдали в группе беременных с ПР, в том числе с ПРПО. Аналогичные данные получены Baldwin E.A. и соавт. и Brown RG. и соавт., которые обнаружили, что колонизация вагинального биотопа лактобациллами заметно уменьшалась у беременных с ПРПО, по сравнению с женщинами с неосложненными родами, родившими в срок [16, 17]. J.P. Ghartey и соавт. изучили микробиоту влагалища у беременных с ПР в 18–32 недели и родивших в срок и показали, что доминирование E. coli следует рассматривать как фактор риска неблагоприятных исходов беременности и причину досрочного ПРПО [18]. Дятловой Л.И. [19] при исследовании микробиоценоза влагалища методом ПЦР установлено, что у пациенток, беременность которых осложнилась ПРПО при сроке гестации 22–34 недели, на фоне снижения содержания лактобацилл преобладали УПМ семейства Enterobacteriaceae и Staphylococcus spp., Mobiluncus spp./Corynebacterium spp. Genovese C. и соавт. [20] исследовали микробиоту влагалища у 600 беременных. У 8 беременных с ПРПО на 28-й и 32-й неделях выделены следующие микроорганизмы: E. coli +Enterococcus spp. в 2 случаях; E. coli+Peptococcus spp. в 1 случае; E. coli+Enterobacter spp. в 1 случае; Gardnerella vaginalis+Peptococcus spp. в 1 случае при отсутствии Lactobacillus.
В исследовании Ходжаевой З.С. и соавт. [21] у 6 женщин с ПРПО проведено динамическое изучение вагинальной микробиоты в течение всей беременности. При исследовании микрофлоры влагалища после излития околоплодных вод получены следующие данные: у 4 обнаружены ассоциации двух УПМ (E. coli+E. faecalis и S. hominis+Candida albicans); у 4 – (E. coli+S. lugdunensis+S. anginosus+Gardnerella vaginalis; S. epidermidis+S. agalactiae+E. faecalis+S. lugdunensis) и в одном случае выделен E. faecalis в монокультуре, свидетельствующие о возможной причастности выделенных УПМ к ПРПО. У всех пациенток в течение динамического наблюдения выявлен хотя бы один эпизод неспецифического (аэробного) вагинита, вызванного указанными микроорганизмами. Полученные результаты свидетельствуют о том, что выявление УПМ на ранних сроках беременности требует динамического наблюдения и своевременной коррекции вагинальной микробиоты.
В литературе обсуждается вопрос о возможном влиянии различных видов лактобацилл на стабильность микробиоты при беременности. Динамическое наблюдение Macintyre D. и соавт. [22] за микробиотой влагалища в течение беременности продемонстрировало, что максимальная стабильность обеспечена в случае представленности лактофлоры видом L. crispatus. Verstraelen H. и соавт. [23] отметили, что максимальная стабильность вагинальной экосистемы определяется видом L. crispatus, а минимальная – L. gasseri и L. iners. Показано, что риск дисбиотических нарушений десятикратно возрастает в случае заселения влагалища лактобациллами видов L. gasseri/L. iners. В нашем исследовании среди лактобацилл у женщин, родивших в срок, доминировал вид L. crispatus, а при ПР, в том числе с ПРПО, – L. iners. Преобладание L. iners, по мнению ряда авторов, ассоциировано с повышенным риском развития выраженных дисбиотических нарушений в микробиоте влагалища и является фактором риска ПР [24, 25]. Поэтому выявление у женщин с умеренным дисбиозом лактофлоры, представленной только L. iners, является неблагоприятным признаком, а такие варианты микробиоты, возможно, требуют коррекции.
Заключение
Таким образом, обнаружение нарушений в составе влагалищной микробиоты с преобладанием УПМ ассоциировано с негативными репродуктивными последствиями, поэтому всестороннее изучение состава микробиоты влагалища с ранних сроков беременности играет важную роль в развитии и поддержании физиологической беременности. Своевременная диагностика дисбиотических нарушений направлена на профилактику в первую очередь ПР, связанных с ПРПО, и улучшение материнских и неонатальных исходов.



