Физиологическая беременность характеризуется адаптивной перестройкой системы гемостаза по типу гиперкоагуляции, подготавливающей организм матери к угрозе кровопотери в родах и раннем послеродовом периоде и поддерживающей нормальное функционирование фетоплацентарного комплекса [1]. На приобретенную гиперкоагуляцию во время физиологической беременности указывают глобальные гемостатические тесты, повышение в крови концентрации факторов свертывания, снижение активности естественных антикоагулянтов, снижение активности ферментов фибринолитической системы [2–4]. Физиологическая гиперкоагуляция достигает максимума к родам с нормализацией в течение 4–6 недель после родов [5].
Уровень тромбоцитов при нормально протекающей беременности может оставаться неизменным [4] или снижаться до умеренной тромбоцитопении [6, 7], которая объясняется естественной гемодилюцией вследствие увеличения объема циркулирующей крови [8]. Другим возможным механизмом является повышенная секвестрация и расход тромбоцитов в маточно-плацентарном кровообращении, а также депонирование в селезенке, перфузия которой во время беременности увеличивается. Изменения функциональной активности тромбоцитов и их роль во время физиологической беременности изучены намного меньше, по сравнению с коагуляционным гемостазом, и характеризуются противоречивыми результатами [9–12].
Важно отметить, что, несмотря на локальную активацию и секреторную активность тромбоцитов в области имплантации [13], в нормальной плаценте нет признаков микротромбоза. Это дает основание предполагать, что главное функциональное предназначение тромбоцитов во время беременности может быть связано не с их гемостатическими и тромбогенными свойствами, а заключаться в чем-то другом, например, в доставке цитокинов к месту инвазии хориона посредством секреции содержимого α-гранул [14]. Таким образом, функция тромбоцитов при физиологической беременности не до конца понятна, что диктует необходимость дальнейшего исследования количественных и качественных изменений тромбоцитов в крови здоровых женщин на разных сроках нормальной беременности.
Исходя из сказанного, целью работы было изучение функционального состояния тромбоцитов в сопоставлении с коагуляционным гемостазом в динамике физиологической беременности.
Материалы и методы
Общая характеристика клинического материала
Исследование проведено на образцах крови 38 беременных женщин в возрасте от 23 до 41 года (средний возраст 29 (4) лет) с неотягощенным акушерским анамнезом. Исследование проводили при наличии письменного согласия обследованных и согласно требованиям Этического комитета Казанского (Приволжского) федерального университета (протокол №3 от 23.03.17). Критериями включения в исследование были отсутствие личной и семейной истории тромбозов и отсутствие приема антикоагулянтов или антитромбоцитарных препаратов на протяжении беременности. Исследование проводили в динамике до беременности и на разных сроках беременности – всего от 3 до 11 раз – и группировали результаты по триместрам. При обобщении результатов оказалось, что некоторые обследованные образовывали только группу I триместра, некоторые входили в первую и вторую группы, другие – во вторую и третью и т.д. Таким образом, группы были неоднородны по составу и при статистическом анализе рассматривались как независимые.
Клиническая и генетическая характеристика обследованных беременных представлена в таблице 1.
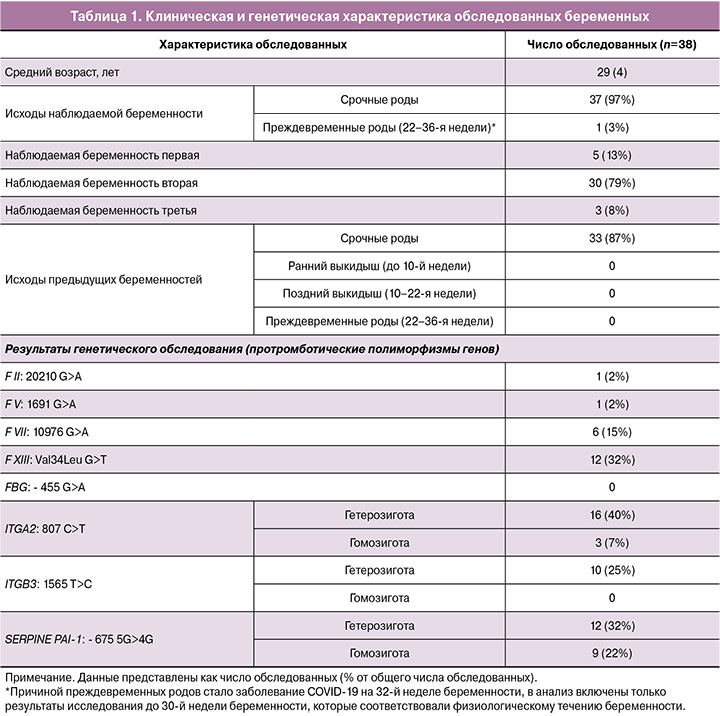
Обращает внимание относительно высокая частота полиморфизмов ITGA2 19/40 (47%) и PAI-1 22/40 (55%), что согласуется с ранее опубликованными данными о распространенности данных полиморфизмов в популяции [15].
Клинико-лабораторные методы исследования
Кровь для исследования брали натощак из антекубитальной вены в вакутейнер с 3,8% цитратом натрия, смешивая в соотношении 9:1 по объему, с последующим разделением на несколько проб, как описано ранее [16]. Первую пробу использовали для изучения контракции сгустка крови. Вторую пробу крови центрифугировали при 200g в течение 10 минут при комнатной температуре, отбирали богатую тромбоцитами плазму и использовали для проточной цитометрии. Часть богатой тромбоцитами плазмы повторно центрифугировали при 2000g в течение 10 минут, отбирали бедную тромбоцитами плазму и использовали для определения рутинных параметров гемостаза. Для проведения теста тромбодинамики использовали бестромбоцитную плазму, которую получали путем дополнительного центрифугирования бедной тромбоцитами плазмы в течение 5 мин при 10 000g при комнатной температуре. Отдельный образец крови стабилизировали ЭДТА (конечная концентрация 1,6 мг/мл) для гематологического и генетического анализов. Стабилизированную кровь хранили и обрабатывали при комнатной температуре и использовали не позднее 4 ч после взятия.
Определение степени контракции сгустков крови проводили оригинальным методом, основанным на оптической регистрации размера сгустка крови в процессе сжатия [17]. Тест тромбодинамики проводили согласно описанному ранее протоколу [18]. Оба метода осуществляли с использованием прибора «Регистратор тромбодинамики T-2» («ГемаКор», Москва). Процесс формирования фибринового сгустка фиксировался оптически каждые 6 секунд в течение 30 минут. Полученные снимки обрабатывались автоматически с вычислением следующих параметров: 1) лаг-период – время, необходимое для начала образования фибрина с момента контакта плазмы с активирующей поверхностью; 2) начальная скорость роста сгустка – средняя скорость роста сгустка, рассчитанная в интервале 2–6 минут после начала роста сгустка; 3) стационарная скорость роста сгустка – средняя скорость роста сгустка, рассчитанная в интервале 15–25 минут после начала роста сгустка; 4) размер фибринового сгустка через 30 минут после контакта плазмы со вставкой-активатором; 5) оптическая плотность сгустка – интенсивность светорассеяния, пропорциональная концентрации фибрина.
Тромбоциты выделяли методом гель-фильтрации богатой тромбоцитами плазмы на сефарозе 2B, уравновешенной буфером Тироде, и исследовали в течение 3 ч после взятия крови. Жизнеспособность тромбоцитов составляла ~97% по сохранности митохондриального потенциала. Подсчет тромбоцитов проводили в камере Горяева на микроскопе PrimoStar (Zeiss, Германия) с увеличением 400×. Функциональное состояние изолированных тромбоцитов изучали методом проточной цитометрии по экспрессии P-селектина (CD62p) и активного интегрина αIIbβ3 (определяемого по его способности связываться с фибриногеном) до и после активации пептидом (TRAP-6), активирующим тромбиновый рецептор тромбоцитов PAR1.
Состояние системы гемостаза оценивали с помощью автоматизированного коагулометра Sysmex СА-1500 (Sysmex, Япония). Определяли следующие параметры коагулограммы: активированное частичное тромбопластиновое время (АЧТВ), протромбиновое время, тромбиновое время, концентрацию фибриногена по Клауссу, а также уровень протеинов S, C и антитромбина III. Уровень D-димера измеряли на иммунохимическом анализаторе Immulite 2000XPi (Siemens Healthcare Diagnostics Inc., Германия). Определение XIIа-зависимого фибринолиза проводили с использованием коммерческих наборов (НПО «Ренам», Россия). Тромбоэластометрию проводили с помощью анализатора ROTEM (LaRosh, Франция) в тесте нативной коагуляции (NATEM), смешивая образец цельной цитратной крови с CaCl2 без добавления активаторов свертывания крови. Определяли следующие параметры: СT – время свертывания крови, CFT – время образования сгустка, α – угол наклона кривой, MCF – максимальная прочность сгустка. Гематологический анализ проводили с помощью анализатора Sysmex XN (Sysmex, Япония). Для генетического анализа использовали метод полимеразной цепной реакции в режиме реального времени с применением оборудования и диагностических наборов компании «ДНК-Технологии» (Россия).
Статистический анализ
Статистическую обработку результатов проводили, используя пакет программ GraphPad Prism 8.
Для оценки нормальности распределения всей выборки использовали критерии Д'Агостино–Пирсона, Колмогорова–Смирнова и Шапиро–Уилка. Распределение всех данных отличалось от нормального, поэтому оценку статистических различий для парных сравнений параметров контракции сгустков крови осуществляли с помощью непараметрического теста Манна–Уитни. Для многофакторного анализа независимых групп (параметры контракции, тромбодинамики, функционального состояния тромбоцитов и рутинных лабораторных параметров) применяли непараметрический критерий Краскела–Уоллиса с последующим попарным сравнением с использованием теста Данна. Ранговый корреляционный анализ степени контракции с показателями функционального состояния тромбоцитов проводили методом Спирмена. Для сравнения категориальных параметров применяли критерий хи-квадрат. Различия считались статистически значимыми при достигнутом уровне значимости р<0,05.
Результаты
Сократительная функция тромбоцитов в динамике физиологической беременности
Сократительная функция тромбоцитов является одной из важных и сравнительно малоизученных характеристик их функциональной активности [19]. В нашем исследовании количественным критерием сократительной функции тромбоцитов была степень сжатия (контракции, ретракции) сгустков, образованных в крови обследованных под действием экзогенного тромбина. Оказалось, что срединная степень контракции сгустков крови снижается в динамике беременности. Результаты попарного сравнения между группами обследованных на разных сроках беременности, представленные на рисунке (А), показывают, что срединная степень контракции сгустков крови статистически значимо снижалась во II и III триместрах по сравнению с показателями этих же женщин на этапе планирования беременности. Наибольшее отличие наблюдалось в III триместре беременности, когда срединная степень контракции составляла 41% (36; 45), что статистически значимо ниже контрольных значений (45% (41;48), p=0,02), определенных у этих же обследованных незадолго до беременности. Таким образом, в динамике нормально протекающей беременности происходит умеренное, но статистически значимое снижение сократительной функции тромбоцитов.
Индивидуальные изменения контрактильной функции тромбоцитов в динамике физиологической беременности
Анализ индивидуальных показателей в динамике беременности позволил существенно дополнить усредненные изменения контрактильной функции тромбоцитов. На рисунке (Б) представлены наиболее типичные индивидуальные графики изменения степени контракции сгустков крови по неделям беременности, которые иллюстрируют следующие закономерности. У 23/28 (82%) обследованных беременных обнаружено снижение степени контракции сгустков ниже референсных значений (<41%) в промежутках между 18-й и 24-й неделями беременности с последующей нормализацией (>41%). В 12/19 (63%) случаях у этих же беременных наблюдалось повторное аномальное снижение степени контракции на сроке 36 недель.
Функциональное состояние тромбоцитов, определенное по экспрессии маркеров активации
Чтобы установить возможную связь между снижением степени контракции в динамике беременности и функциональным состоянием тромбоцитов, исследовали активность тромбоцитов методом проточной цитометрии по уровню экспрессии P-селектина (антиген) и активного интегрина αIIbβ3, способного связывать меченый фибриноген. Эти молекулярные маркеры характеризуют степень активации тромбоцитов, от которой зависит их способности к сокращению. Изучали как фоновую активность покоящихся тромбоцитов, так и их способность отвечать на биохимический стимул, в качестве которого использовали пептид (TRAP-6), активирующий тромбиновый рецептор. Отсутствие статистически значимых различий в среднем уровне экспрессии P-селектина и активного интегрина αIIbβ3 до и во время беременности свидетельствует о низком уровне фоновой активации тромбоцитов и сохранении их высокой реактивности в динамике физиологической беременности (табл. 2).
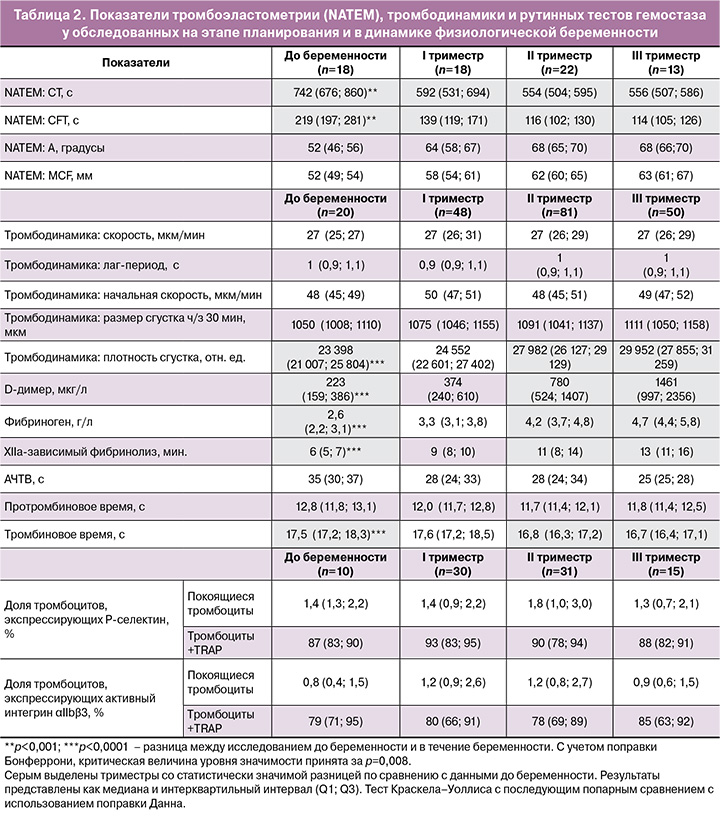
Для выявления причинно-следственных связей между изучаемыми параметрами был проведен корреляционный анализ, который включал основные параметры, представленные в таблице 2. Перекрестный корреляционный анализ по методу Спирмена выявил единственную статистически значимую корреляцию, а именно: снижение контракции сгустков крови в III триместре, которая сочеталась с повышенной фоновой активацией интегрина αIIbβ3 (r=-0,606; 95% доверительный интервал (ДИ) -0,85; -0,14, p=0,01). Этот результат указывает на то, что причиной снижения сократительной активности тромбоцитов могла быть умеренная спонтанная активация тромбоцитов в кровотоке, которая сопровождалась их частичным истощением и снижением сократительного потенциала [19].
Изменения показателей гемограммы
По результатам гемограммы в динамике физиологической беременности выявлены характерные изменения в виде умеренной анемии (статистически значимое снижение гематокрита, числа эритроцитов и уровня гемоглобина), наиболее выраженной в III триместре, что объясняется нарастающей гемодилюцией, характерной для физиологической беременности. В отличие от эритроцитов, число лейкоцитов в крови обследованных беременных прогрессивно возрастало, начиная со II триместра, достигая уровня умеренного, но статистически значимого лейкоцитоза в III триместре, что указывает на адаптивную воспалительную реакцию. Срединное содержание тромбоцитов, включая незрелые формы, не менялось по сравнению с прегравидарным периодом и оставалось постоянным на разных сроках беременности. В то же время было выявлено снижение уровня тромбоцитов менее 150×109/л в 14/50 (7%) случаях в I триместре, в 17/81 (14%) случаях – во II триместре и в 32/50 (16%) случаях – в III триместре, что согласуется с данными литературы [5]. В III триместре среди женщин с тромбоцитопенией (менее 150×109/л) снижение степени контракции меньше границы нормы (41%) наблюдалось статистически значимо чаще, чем у пациенток без тромбоцитопении (р=0,026, критерий хи-квадрат). Это указывает на физиологическую тромбоцитопению как на возможный механизм снижения контракции сгустков крови на поздних сроках беременности (рисунок).

Изменения гемостаза по данным глобальных тестов: тромбоэластометрии и тромбодинамики
Для интегральной оценки состояния гемостаза и его сопоставления с функцией тромбоцитов мы изучили параметры тромбоэластометрии и тромбодинамики при физиологической беременности. По данным NATEM выявлена прогрессирующая хронометрическая гиперкоагуляция по времени свертывания (CT) и времени образования сгустка (CFT), начиная с I триместра, с максимальными изменениями во II и III триместрах (табл. 2). По данным тромбодинамики только оптическая плотность сгустка статистически значимо увеличивалась на протяжении беременности, начиная со II триместра, с максимумом в III триместре, что, очевидно, отражает нарастающую физиологическую гиперфибриногенемию. Кинетические показатели тромбодинамики, такие как скорость формирования сгустка, начальная скорость формирования сгустка и лаг-период, не отличались от прегравидарного периода и оставались неизменными во время беременности, что соответствовало референсным значениям [2, 4].
Динамика рутинных лабораторных показателей гемостаза
По данным рутинного лабораторного исследования гемостаза (табл. 2) были выявлены изменения в хронометрических показателях коагулограммы, характеризующие гиперкоагуляцию разной степени выраженности. Уровень фибриногена также статистически значимо повышался со II триместра, достигая максимума к III триместру. Несмотря на статистически значимое повышение уровня D-димера, начиная со II триместра беременности, с достижением максимума на доношенном сроке, значения соответствовали референсным показателям [20]. Выявлено удлинение времени лизиса сгустка в тесте XIIа-зависимого фибринолиза (гипофибринолиз), начиная со II триместра, с максимальным значением в III триместре. Полученные данные указывают на прогрессирующую хронометрическую и структурную гиперкоагуляцию при физиологической беременности, что полностью согласуется с существующими представлениями [21–23].
Обсуждение
Для профилактики патологии беременности важно понимать, где пролегает граница между физиологическими и патологическими изменениями системы гемостаза на разных сроках беременности, так как декомпенсированная активация свертывания крови во время гестации вызывает разнообразные осложнения, от невынашивания беременности на ранних сроках до тяжелых акушерских осложнений, таких как (пре)эклампсия или HELLP-синдром [24]. Тромбоцитарный компонент гемостаза при физиологической беременности является наименее изученным, поэтому данная работа включает не только изучение плазменного гемостаза, но и комплексную характеристику тромбоцитов в динамике нормальной беременности. Для этого использованы как традиционные, так и сравнительно новые методические подходы, включая оценку сократительной функции тромбоцитов по способности вызывать контракцию (ретракцию) сгустков крови. Впервые показано, что в динамике нормально протекающей беременности происходит умеренное, но статистически значимое прогрессирующее снижение сократительной способности тромбоцитов. У подавляющего большинства обследованных выявлены волнообразные изменения показателей контракции сгустков крови: снижение ниже референсных значений в промежутках между 18-й и 24-й неделями беременности (у 23/28 (82%) обследованных) с последующим повторным снижением (12/19 (63%) случаев) на сроке 36 недель. Интересно, что обнаруженные волны угнетения контракции сгустков совпадают по срокам беременности с важными физиологическими процессами: завершением периода плацентации и формированием плаценты на сроках 16–18 недель [25] и предродовой готовностью системы гемостаза с пиком физиологической гиперкоагуляции [4, 5]. Эти результаты указывают на возможную взаимосвязь между сократительной активностью тромбоцитов и локальными и системными изменениями в организме будущей матери.
Объяснение сниженной контракции сгустков следует искать прежде всего в количественных и/или качественных изменениях тромбоцитов. Выявленное прогрессирующее снижение уровня тромбоцитов с максимальным снижением показателей в III триместре согласуется со снижением общего сократительного потенциала тромбоцитов и снижением степени контракции сгустков крови. Однако умеренная тромбоцитопения обнаружена у сравнительно небольшой группы беременных женщин (7–16% в зависимости от срока), тогда как снижение полноты контракции сгустков крови выявлено в подавляющем большинстве случаев – 23/28 (82%). Следовательно, количественные изменения тромбоцитов могут лишь отчасти обусловить снижение степени контракции сгустков крови в динамике нормальной беременности.
Что касается качественных изменений тромбоцитов, мы не выявили статистически значимых различий в среднем уровне экспрессии P-селектина и активного интегрина αIIbβ3 до и во время беременности, что свидетельствует об отсутствии явной фоновой активации тромбоцитов и о сохранении их высокой реактивности при физиологическом течении беременности. В то же время на основании выраженной (r=-0,606; 95% ДИ -0,85; -0,14) и статистически значимой (p=0,01) корреляции между повышенной фоновой активацией интегрина αIIbβ3 и снижением степени контракции у части беременных мы сделали заключение о возможной умеренной спонтанной активации тромбоцитов в кровотоке, типичным признаком которой является экспрессия активного интегрина αIIbβ3 [16, 26]. Вероятность фоновой активации тромбоцитов в кровотоке при нормальной беременности очень высока вследствие прогрессирующей физиологической гиперкоагуляции, которая всегда сопровождается более или менее выраженной тромбинемией. В нашем исследовании о физиологической гиперкоагуляции свидетельствуют показатели коагулограммы, рост уровней фибриногена и D-димера с одновременным реактивным гипофибринолизом, а также динамика показателей тромбоэластометрии (табл. 2). Эти результаты согласуются с литературными данными, в которых нарастающая гиперкоагуляция при физиологической беременности выявлена как по тесту тромбодинамики [2], так и методом тромбоэластографии [3]. Таким образом, функциональное состояние тромбоцитов на протяжении здоровой беременности не имеет ярко выраженных изменений, однако у части беременных фоновая активация и последующее истощение тромбоцитов в сочетании с умеренной тромбоцитопенией могут сопровождаться снижением сократительного потенциала тромбоцитов и уменьшением степени контракции сгустков крови. Дополнительный вклад в угнетение контракции сгустков крови может дать гиперфибриногенемия, т.к. концентрация фибриногена в крови находится в обратной зависимости от полноты контракции сгустков [27].
Помимо хорошо известной гемостатической функции, появляется все больше данных о менее очевидной роли тромбоцитов в регуляции имплантации и ремоделировании спиральных артерий, плацентации, васкулогенезе и поддержании плацентарной гемоперфузии [7, 14, 28]. Эмбрион с самого начала имплантации модифицирует эндометрий, включая реакции асептического воспаления, которое является одним из механизмов плацентации [29]. Как известно, активированные тромбоциты и прокоагулянтные клеточные микровезикулы обеспечивают связь между коагуляцией и воспалением. Показано, что микровезикулы вызывают стерильное воспаление в процессе плацентации, активируя материнские тромбоциты [30]. В свете важной роли воспаления в процессах имплантации и плацентации, изменения сократительной функции тромбоцитов могут иметь особое значение, поскольку воспаление, в том числе асептическое, ассоциировано с изменением степени контракции сгустков крови [19]. С более общих позиций, изменения сократительной способности тромбоцитов как характеристика их интегрального функционального состояния могут отражать возможности тромбоцитов в роли эффекторного элемента врожденного иммунитета. Потенциально механическое сокращение тромбоцитов может представлять собой клеточную реакцию и/или адаптивный механизм, не связанный с гемостатической функцией тромбоцитов.
Заключение
Нормальная беременность сопровождается умеренным снижением сократительной функции тромбоцитов, определяемой по степени контракции (сжатия) сгустков крови. Изменения контракции сгустков сочетаются с физиологической тромбоцитопенией, а также с признаками частичной фоновой активации тромбоцитов, обусловленной физиологической гиперкоагуляцией. Пик изменений сократительной активности тромбоцитов в динамике беременности совпадает со сроками завершения плацентации, что указывает на возможную связь тромбоцитов с локальными внутриплацентарными процессами и подчеркивает вероятную негемостатическую функцию тромбоцитов в процессе нормальной беременности. Полученные результаты расширяют и углубляют представление о беременности как о физиологическом процессе, в котором участвует не только плазменный, но и тромбоцитарный компонент гемостаза. Практически важно, что исследование сжатия сгустков крови in vitro может применяться, наряду с другими лабораторными тестами, для интегральной оценки состояния гемостаза и наблюдения за ходом беременности.



