Известно, что исход программ экстракорпорального оплодотворения (ЭКО) определяется наличием полноценного эмбриона для переноса в полость матки. Качество ооцитов играет существенную роль в развитии эмбрионов. В клинической практике ЭКО качество ооцитов оценивается преимущественно по их морфологическим характеристикам до и после оплодотворения. При этом аномалии строения ооцитов (дисморфизмы) подразделяются на две группы: цитоплазматические и экстрацитоплазматические. К цитоплазматическим аномалиям относятся повышение гранулярности цитоплазмы, вакуолизация, скопление аномальных агрегатов гладкого эндоплазматического ретикулума (ГЭР), а также наличие разнообразных цитоплазматических включений. Ооциты с цитоплазматическими дисморфизмами имеют более низкую частоту оплодотворения, а эмбрионы, полученные из таких клеток, обладают низким потенциалом к имплантации и дальнейшему развитию [1–3]. К экстрацитоплазматическим аномалиям относятся изменение ширины перивителлинового пространства, наличие гранулярности в перивителлиновом пространстве, изменение формы или толщины зоны пеллюцида, а также аномалии строения первого полярного тельца. Отрицательное влияние данных дисморфизмов на частоту оплодотворения клетки и развитие эмбриона спорно [1, 4].
Известно, что значительная часть ооцитов, полученных в циклах стимуляции суперовуляции, имеют те или иные аномалии строения. При этом возможными факторами риска их появления могут быть как клинические характеристики пациенток, так и различные ятрогенные факторы. В качестве возможных предикторов появления дисморфизмов ооцитов рассматривают возраст женщины, овариальный резерв яичников, генетические особенности, а также наличие метаболических нарушений (избыточная масса тела и ожирение) и гинекологических заболеваний (наружный генитальный эндометриоз, синдром поликистозных яичников, хроническая ановуляция) [5–7]. Особое внимание уделяется влиянию различных протоколов стимуляции функции яичников в программах ЭКО, длительности стимуляции функции яичников и суммарной дозы вводимых гонадотропинов на качество ооцитов [8–10]. Однако единого мнения о влиянии перечисленных факторов на появление дисморфизмов ооцитов не существует.
В связи с этим целью настоящего исследования стала оценка клинико-анамнестических и ятрогенных факторов риска развития различных дисморфизмов ооцитов у пациенток программ ЭКО.
Материал и методы исследование
В проспективное исследование случай-контроль, которое проводилось в период с сентября 2013 г. по сентябрь 2014 г., были включены 343 женщины с бесплодием различного генеза, нормальным кариотипом, отсутствием противопоказаний к проведению ЭКО и подписанным информированным согласием на участие в исследовании. Все женщины были разделены на три группы: группа 1 (n=139) – женщины с цитоплазматическими дисморфизмами ооцитов, группа 2 (n=97) – женщины с экстрацитоплазматическими дисморфизмами ооцитов, группа 3 (контроль, n=107) – пациентки с морфологически нормальными ооцитами. Критерием отнесения пациенток в группу с дисморфизмами было наличие 100% ооцитов с патологией цитоплазмы или экстрацитоплазматическими нарушениями, в группу без дисморфизмов – наличие 100% нормальных ооцитов. Группы формировались методом подбора пар по числу полученных ооцитов (2–5 ооцитов, 6–10 ооцитов и более 10 ооцитов) и эмбриологу, выполнявшему морфометрию клеток (морфологическое исследование ооцитов осуществлялось 3 эмбриологами). Перед включением в протокол ЭКО все женщины были обследованы согласно Приказу Минздрава России от 30.08.2012 №107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и показаниях к их применению» [11].
Стимуляция функции яичников проводилась с применением рекомбинантного ФСГ или комбинированного препарата рекомбинантного ФСГ и ЛГ, и назначением как агонистов (а-ГнРГ), так и антагонистов гонадотропин-рилизинг-гормона (ант-ГнРГ). Распределение различных протоколов стимуляции овуляции было следующим: протокол с ант-ГнРГ был назначен 285 пациенткам (83,1%), модифицированный протокол с ант-ГнРГ – 23 пациенткам (6,7%), длинный протокол с а-ГнРГ – 13 пациенткам (3,8%), короткий протокол с а-ГнРГ – 7 пациенткам (2%). ЭКО в естественном цикле было произведено 15 пациенткам (4,4%). Триггер овуляции вводили при наличии в яичниках фолликулов диаметром 17 мм и более. В качестве триггера использовали человеческий хорионический гонадотропин (ЧХГ) в дозе 7500–10000 МЕ, а-ГнРГ (декапептил) в дозе 0,2 мг, или сочетание а-ГнРГ с ЧХГ в дозе 1500 МЕ. Всего препараты ЧХГ были назначены 295 пациенткам, препараты а-ГнРГ – 34 пациенткам, а их сочетание – 14 пациенткам. Трансвагинальная пункция яичников осуществлялась через 36 ч после введения триггера.
Очищение ооцитов от клеток кумулюса осуществляли как энзимным, так и механическим путем; зрелые клетки на стадии МІІ культивировали отдельно от незрелых. Морфологическая оценка ооцитов проводилась эмбриологом во время проведения процедуры ИКСИ. К цитоплазматическим дисморфизмам ооцитов относились наличие центральной гранулярности цитоплазмы, вакуолизация, скопление аномальных агрегатов ГЭР, а также липофусциновые тельца в цитоплазме. К экстрацитоплазматическим дисморфизмам ооцитов относились изменение размера перивителлинового пространства и наличие в нем гранулярности, изменение формы или ширины зоны пеллюцида ооцита, а также аномалии строения первого полярного тельца.
Для статистического анализа использовали пакет статистических программ Statistica 10 (США). Расчет объема выборки был основан на определении количества изучаемых возможных факторов риска. Конечной точкой исследования стало скорректированное отношение шансов (ОШкор) развития различных дисморфизмов ооцитов в зависимости от наличия выявленных факторов риска. Статистический анализ проводили с применением χ2-теста для сравнения частотных показателей, теста Манна–Уитни и Крускала–Уаллиса для сравнения непрерывных величин, а также многофакторного регрессионного анализа (логистической регрессии) для расчета ОШкор. Корреляционный анализ проводили с использованием непараметрического корреляционного критерия Спирмена. Различия между статистическими величинами считали статистически значимыми при уровне достоверности p<0,05. Исследование было одобрено комиссией по этике ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России.
Результаты исследования
Однофакторный анализ
Так как пациентки были включены в исследование на основании метода подбора пар, то в группах не отмечалось статистически значимой разницы по числу полученных ооцитов. Также группы были равномерно распределены по эмбриологам, проводившим данное исследование.
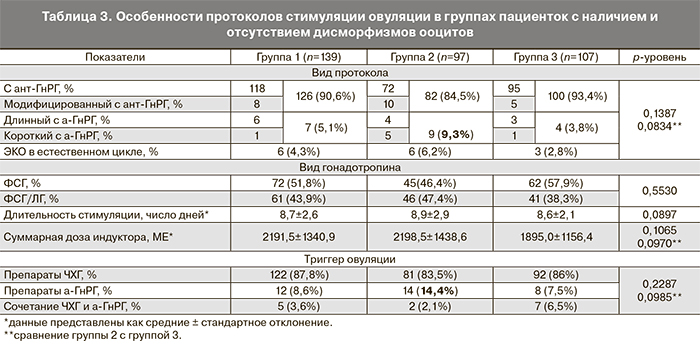
При оценке клинико-анамнестических факторов риска развития дисморфизмов ооцитов было выявлено, что пациентки группы 1 и группы 2 были более старшего возраста (35,4±5,6 и 33,8±4,5 года) по сравнению с пациентками группы контроля (31,8±4,7 года) (р<0,0001). Больше всего женщин в возрасте ≥38 лет было в группе 1 (30,9%) по сравнению с группами 2 (19,6%) и контрольной группой (8,4%). Социально-экономические характеристики (уровень образования, семейное положение, наличие или отсутствие работы, место проживания) не различались в группах сравнения. Индекс массы тела (ИМТ) был выше у женщин с наличием цитоплазматических дисморфизмов и составил в группе 1 – 24,1±4,5, в группе 2 – 23,2±3,9, в группе контроля – 22,6±3,6 (р=0,0302). Больше всего женщин с избыточной массой тела (ИМТ >25) отмечалось в группе 1 (30,9%) по сравнению с группой 2 (13,4%) и контрольной группой (15,9%). Женщины из различных групп не отличались по менструальной функции, паритету, соматической заболеваемости и наличию вредных привычек. Отмечено более позднее начало половой жизни в группе пациенток с дисморфизмами ооцитов (19,7±3,9 и 19,1±3,5 года) по сравнению с группой контроля (18,3±2,0 года) (р=0,0115). В гинекологическом анамнезе у женщин с дисморфизмами ооцитов была большая распространенность миомы матки и операций на яичниках. Обращала на себя более высокая, хотя и статистически не значимая распространенность эндометриоза и хронического сальпингоофорита в группах случаев по сравнению с контролем. Также у женщин с экстрацитоплазматическими дисморфизмами ооцитов отмечалась более высокая по сравнению с другими группами распространенность синдрома поликистозных яичников (СПКЯ) при наличии избыточной массы тела (ИМТ >25). Причина бесплодия, а также количество циклов ЭКО/ИКСИ в анамнезе существенно не различались в 3 группах. Продолжительность бесплодия была погранично выше у пациенток с дисморфизмами ооцитов (табл. 1).
При оценке уровней гормонов, измеренных однократно на 3-й день менструального цикла у каждой пациентки, было отмечено, что уровень АМГ и свободного Т4 в крови пациенток без дисморфизмов ооцитов был значимо выше по сравнению с группами 1 и 2 (рисунок).
Уровень АМГ составил 2,33±2,1 нг/мл в группе 1; 2,37±2,6 нг/мл в группе 2 и 3,66±3,3 нг/мл группе 3 (р=0,0041). Уровень Т4 составил 13,9±3,2 пмоль/л в группе 1; 14,3±2,8 пмоль/л в группе 2 и 15,0±2,4 пмоль/л в группе 3 (р=0,0138) (табл. 2). Другие лабораторные показатели не отличались в группах сравнения.
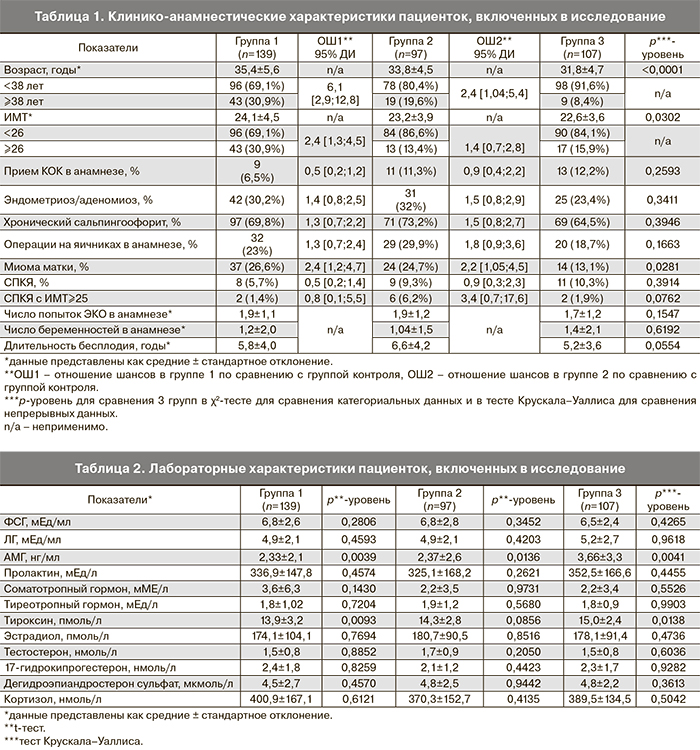
При оценке влияния на развитие дисморфизмов ооцитов ятрогенных факторов было выявлено, что частота назначения различных протоколов стимуляции суперовуляции не отличалась статистически значимо в группах сравнения, однако доля протоколов с агонистами была выше в группе 2 по сравнению с группами 1 и 3 (9,3% по сравнению с 5,1% и 3,8%). Длительность стимуляции суперовуляции существенно не различалась в группах, так же, как и частота использования различных препаратов гонадотропинов.
 В группах пациенток с дисморфизмами ооцитов была выявлена незначительно более высокая суммарная доза назначаемых препаратов гонадотропинов по сравнению с группой контроля. Что касается триггера овуляции, то у пациенток с экстрацитоплазматическими дисморфизмами ооцитов отмечалось более частое применение а-ГнРГ в качестве триггера овуляции по сравнению с группами 1 и 3 (14,4% по сравнению с 8,6 и 7,5%) (р=0,0985) (табл. 3).
В группах пациенток с дисморфизмами ооцитов была выявлена незначительно более высокая суммарная доза назначаемых препаратов гонадотропинов по сравнению с группой контроля. Что касается триггера овуляции, то у пациенток с экстрацитоплазматическими дисморфизмами ооцитов отмечалось более частое применение а-ГнРГ в качестве триггера овуляции по сравнению с группами 1 и 3 (14,4% по сравнению с 8,6 и 7,5%) (р=0,0985) (табл. 3).
Многофакторный анализ
Мы провели многофакторный анализ оценки шансов развития цитоплазматических и экстрацитоплазматических дисморфизмов ооцитов в зависимости от влияния клинико-анамнестических, лабораторных и ятрогенных предикторов. В модель были включены факторы, выделенные в ходе проведения однофакторного анализа.
На развитие цитоплазматических дисморфизмов ооцитов в однофакторном анализе значимое влияние оказывали возраст пациентки, ИМТ, уровень АМГ и уровень Т4. Единственным возможным конфаундером было наличие миомы матки (табл. 1–3). Все указанные переменные были представлены в виде бинарных данных с определением порогов отсечки, при которых созданная модель была максимально достоверной. Порогами отсечки с максимальной площадью под кривой AUC) был возраст женщин 38 лет, ИМТ – 25, уровень АМГ – 1,4 нг/мл, уровень Т4 – 13 пмоль/л. В созданной модели с помощью метода логистической регрессии было выявлено, что значимое влияние на развитие цитоплазматических дисморфизмов ооцитов оказывали лишь возраст женщин и уровень Т4. ОШкор развития цитоплазматических дисморфизмов ооцитов при возрасте пациентки более 38 лет и уровне Т4 менее 13 пмоль/л составило 5,6 (95% ДИ=2,7; 11,9). В полученной модели AUC составила 71,5%. При включении в модель вышеуказанных предикторов в виде непрерывных величин была получена следующая формула прогноза развития цитоплазматических дисморфизмов ооцитов у пациенток программ ЭКО в зависимости от возраста и уровня Т4: где Р(ЦД) – вероятность развития цитоплазматических дисморфизмов в ооцитах, Exp – экспонента, возраст – возраст женщины в годах, T4 – уровень тироксина в пмоль/л.
На развитие экстрацитоплазматических дисморфизмов ооцитов в однофакторном анализе значимое влияние оказывали возраст пациентки и уровень АМГ, погранично значимое влияние оказывали а-ГнРГ (в виде триггеров овуляции или в протоколах с а-ГнРГ). Единственным возможным конфаундером было наличие миомы матки (табл. 1–3). Порогами отсечки с максимальной AUC был возраст 38 лет, уровень АМГ – 2,2 нг/мл.
В созданной модели с помощью метода логистической регрессии было выявлено, что значимое влияние на развитие экстрацитоплазматических нарушений в ооцитах оказывали лишь уровень АМГ и применение а-ГнРГ. ОШкор развития экстрацитоплазматических дисморфизмов ооцитов при уровне АМГ пациентки менее 2,2 нг/мл и применения а-ГнРГ в циклах ЭКО составило 2,2 (95% ДИ=1,2; 4,2). В полученной модели AUC составила 61,8%. При включении в модель уровня АМГ в виде непрерывной величины была получена следующая формула прогноза развития экстрацитоплазматических дисморфизмов ооцитов в зависимости от уровня АМГ и назначения а-ГнРГ: где Р(ЭД) – вероятность развития экстрацитоплазматических дисморфизмов в ооцитах, Exp – экспонента, АМГ<2,2 – включается в формулу при условии, что АМГ<2,2 нг/мл, а-ГнРГ+ – включается в формулу при условии использования а-ГнРГ в качестве триггеров овуляции или в протоколе стимуляции овуляции.
Обсуждение
Качество ооцитов является ключевым фактором, определяющим успех программ ЭКО. Проблема морфологической оценки ооцитов в циклах ЭКО изучена недостаточно, и хотя негативное влияние различных дисморфизмов на последующее развитие эмбрионов не вызывает сомнений, причины развития и клинические предикторы данных аномалий не определены.
Главной целью нашего исследования было выявление клинико-анамнестических и ятрогенных предикторов появления морфологических аномалий ооцитов у пациенток программ ЭКО. Так как цитоплазматические и экстрацитоплазматические дисморфизмы определенно имеют различные механизмы формирования, было решено рассматривать их как отдельные формы патологии. Именно поэтому пациентки были разделены на 3 группы в зависимости от наличия или отсутствия дисморфизмов, а также от типа аномалий строения ооцитов.
На развитие цитоплазматических дисморфизмов ооцитов, к которым относились наличие центральной гранулярности цитоплазмы, повышение вакуолизации, скопление аномальных агрегатов ГЭР, а также липофусциновые тельца в цитоплазме, по данным однофакторного анализа оказывали влияние возраст пациенток, ИМТ, уровень АМГ и Т4. При проведении многофакторного анализа значимое влияние имели лишь возраст пациенток и уровень Т4. Согласно полученным данным, у женщин 38 лет и старше с уровнем Т4 менее 13 пмоль/л в 5,6 раза чаще получают ооциты с дисморфизмами цитоплазмы.
На развитие экстрацитоплазматических дисморфизмов ооцитов, к которым относились изменение размера перивителлинового пространства и наличие в нем гранулярности, изменение формы или ширины мембран ооцита, а также аномалии строения первого полярного тельца, по данным однофакторного анализа, влияли возраст пациентки, уровень АМГ и применение а-ГнРГ для десенситизации гипоталамо-гипофизарно-яичниковой системы или в качестве триггера овуляции. При проведении многофакторного анализа существенную роль играли только уровень АМГ и применение а-ГнРГ. Согласно полученным данным, у женщин с уровнем АМГ менее 2,2 нг/мл и при применении а-ГнРГ в циклах ЭКО в 2,2 чаще получают ооциты с экстрацитоплазматическими дисморфизмами. Полученные результаты не согласуются с данными других исследований, в которых не было выявлено корреляции между возрастом пациенток, их гормональным профилем и появлением экстрацитоплазматических дисморфизмов [1, 5, 7].
Возраст является известным фактором риска неудач ЭКО, что связано прежде всего с анеуплоидиями гамет и полученных эмбрионов [12]. Существуют данные, что ооциты с хромосомными аномалиями часто имеют те или иные цитоплазматические дисморфизмы [13]. Наши данные согласуются с данными, полученными в исследовании Fancsovits и соавт. (2012), в котором более старший возраст пациенток коррелировал с появлением в цитоплазме ооцитов различных аномалий [9].
Избыточная масса тела является одной из причин нарушений менструальной функции и снижения фертильности, что может быть связано с явлением окислительного стресса в различных клетках, в том числе ооцитах [14]. ИМТ пациенток влияет на эффективность программ ЭКО, а также коррелирует с вариабельностью ответа на гормональную стимуляцию и качеством эмбрионов. Были получены данные о снижении уровня АМГ у женщин с ожирением [15]. Тем не менее, нами не было найдено данных литературы, в которых бы оценивалось влияние избыточной массы тела на морфологию ооцитов. В нашем исследовании больше всего женщин с избыточной массой тела отмечалось в группе с цитоплазматическими дисморфизмами ооцитов. Однако данный фактор не показал статистической значимости при проведении многофакторного анализа.
АМГ продуцируется гранулезными клетками яичников и является доказанным количественным маркером овариального резерва. Снижение уровня АМГ у женщин репродуктивного возраста менее 1,0 нг/мл сопряжено с истощением фолликулярного пула и имеет плохое прогностическое значение для стимуляции овуляции и исходов ЭКО. В нашем исследовании уровень АМГ был значимо ниже у пациенток с дисморфизмами, особенно с экстрацитоплазматическими нарушениями в ооцитах. В исследовании Ebner и соавт. (2006) проводилось изучение влияния лабораторных характеристик на морфологию ооцитов, а также на последующее развитие эмбрионов [7]. Была выявлена сильная связь между уровнем АМГ и наличием цитоплазматических дисморфизмов в клетке, при этом уровни других половых гормонов существенно не различались между группами. В нашем исследовании уровень АМГ оказывал более сильное влияние на риск экстрацитоплазматических дисморфизмов, чем возраст женщины. Возможно, это связано с дисфункцией клеток гранулезы, которая на ранних стадиях не приводит к клинически значимому снижению овариального резерва, но нарушает созревание ооцита в процессе фолликулогенеза.
Гипотиреоз является распространенным заболеванием у женщин репродуктивного возраста и проявляется повышением уровня ТТГ и последующим снижением функции щитовидной железы. Данное заболевание негативно влияет на репродуктивную функцию женщины и сопряжено с высокой частотой различных осложнений гестационного периода. При анализе научных публикаций нами не было выявлено данных о влиянии гипотиреоза на морфологию ооцитов. В нашем исследовании уровень ТТГ не различался значимо в группах пациенток, однако была выявлена значимая разница в уровне Т4, который был выше у пациенток контрольной группы. При этом порог уровня Т4, ниже которого вероятность получения ооцитов с цитоплазматическими дисморфизмами была максимально высокой, составил 13 пмоль/л. Мы не можем точно объяснить первостепенное влияние снижения периферических гормонов щитовидной железы при отсутствии влияния повышения уровня ТТГ на развитие патологии ооцитов в программах ЭКО. Возможно, незначительное повышение гормонов щитовидной железы является в нашей выборке более чувствительным признаком начинающегося субклинического гипотиреоза, что, в свою очередь, может вызывать нарушения оогенеза.
Влияние различных протоколов стимуляции на морфологию ооцитов было проанализировано в исследовании Cotaи и соавт. (2012) [8]. Авторы не обнаружили значимого влияния данного фактора на оогенез. При этом следует отметить, что в исследовании доля протоколов с а-ГнРГ была значительно больше, чем в нашем исследовании, а объем выборки в целом был меньше. Также нами не было найдено данных, свидетельствующих о негативном влиянии дозы вводимых гонадотропинов или длительности стимуляции на морфологию ооцитов. По данным литературы, замена триггера овуляции на а-ГнРГ при риске развития синдрома гиперстимуляции яичников также не влияет на качество полученных ооцитов [16, 17]. Тем не менее, в нашем исследовании применение а-ГнРГ играло значительную роль в развитии экстрацитоплазматических дисморфизмов ооцитов. Длительность стимуляции суперовуляции существенно не различалась в группах сравнения, так же как и частота использования различных препаратов гонадотропинов, что согласуется с данными литературы. Но при этом пациентки с дисморфизмами ооцитов получили более высокую суммарную дозу препаратов гонадотропинов по сравнению с группой контроля.
В протоколах стимуляции а-ГнРГ используются для десенситизации гипоталамо-гипофизарной системы и предотвращения промежуточных пиков ЛГ. Назначение данной группы препаратов сопровождается снижением синтеза эндогенных гонадотропинов и стероидных гормонов. Вероятно, уменьшение концентрации эстрогенов, наблюдаемое в период селекции пула фолликулов (то есть в период формирования экстрацитоплазматических структур ооцита), вызывает нарушение пролиферации и секреции клеток гранулезы, что приводит к появлению морфологических аномалий ооцитов. Подобный механизм может быть реализован и при назначении а-ГнРГ в качестве триггера овуляции, при котором изменение пика ЛГ способствует появлению аномалий строения первого полярного тельца.
Заключение
Качество ооцитов определяется многими факторами, большинство которых (возраст пациентки, овариальный резерв, наличие генетических нарушений) не модифицируемые. Тем не менее, для получения ооцитов оптимального качества у конкретной пациентки необходима подготовка к программе ЭКО, а также индивидуальный выбор протокола стимуляции овуляции. Пациенткам с риском получения морфологически аномальных ооцитов требуется комплексный подход в коррекции метаболических нарушений и соматических заболеваний, а также дифференцированный подход в выборе подходящего протокола стимуляции овуляции.



