По данным Всемирной организации здравоохранения (ВОЗ), ассоциированные с вирусом папилломы человека (ВПЧ) онкозаболевания составляют около 10% всех злокачественных новообразований (ЗНО), ½ всех онкологических заболеваний у женщин в мире. Обусловленные инфекцией заболевания имеют такие локализации, как шейка матки, прямая кишка, ректосигмоидное соединение, анус, гортань, глотка, вульва, половой член [1, 2]. По данным мировых и отечественных исследователей, за последние 15 лет наблюдается значительный рост ЗНО данных локализаций, особенно рака шейки матки (РШМ) в молодом репродуктивном возрасте, что негативно влияет на демографические показатели [3, 4]. Согласно мировой статистике, заболеваемость РШМ удвоится к 2020 г. и достигнет 740 000 новых случаев в год [5, 6]. В России РШМ – 5-й по частоте рак у женщин, 2-й по частоте рак у женщин до 45 лет, занимает 1-е место в структуре смертности от ЗНО у женщин до 45 лет [6, 7].
Ведущими направлениями профилактики ВПЧ-инфицированных заболеваний являются меры по улучшению организации плановой вакцинации и реализация организованных скрининговых программ [6, 8]. Масштабы бремени ВПЧ-ассоциированных заболеваний в стране, которым подвержено женское население репродуктивного возраста, как показывает международный опыт, приводят к необходимости внедрения скрининга и вакцинации против ВПЧ [9, 10].
Проведенный учеными из Канады и Лондона метаанализ, включающий 26 исследований с общим количеством 73 428 женщин, а также ряд проведенных в России исследований по оценке экономической эффективности вакцинопрофилактики доказали, что массовая вакцинация против ВПЧ-ассоциированных заболеваний способна существенно снизить объем затрат на лечение данных заболеваний, в частности на 67,9%, что соответствует 4539 руб. в расчете на 1 вакцинированную девочку, или 453,9 млн руб. на 100 000 вакцинированных [11].
В условиях совершенствования профилактических программ по ВПЧ-ассоциированным онкозаболеваниям становятся актуальными региональные эпидемиологические исследования папилломавирусной инфекции (ПВИ) и сопряженных с ней онкозаболеваний репродуктивных органов для оптимизации скрининговых программ в Свердловской области.
Цель исследования – выявить основные эпидемиологические закономерности распространенности ПВИ, ВПЧ-ассоциированных заболеваний репродуктивных органов в Свердловской области для обоснования оптимизации и внедрения скрининговых программ, а также Программы вакцинопрофилактики ПВИ.
Материалы и методы
Для изучения распространенности ВПЧ среди женщин Екатеринбурга нами проведено проспективное когортное обследование 2567 женщин амбулаторно-поликлинического приема женских консультаций г. Екатеринбурга в возрасте от 16 до 75 лет. Впоследствии всем пациенткам с выявленной ВПЧ проводили цитологические, кольпоскопические, патоморфологические методы исследований. Для анализа заболеваемости ВПЧ-ассоциированными онкозаболеваниями в Свердловской области проведено ретроспективное исследование по данным официальной статистики за последние 11 лет, с 2008 по 2018 гг. Повозрастная характеристика заболеваемости РШМ проведена за период с 2001 по 2018 гг.
При проведении эпидемиологических исследований были проанализированы следующие показатели: распространенность (Р), методика вычисления: Р=число имеющихся случаев заболевания/численность популяции (в фиксированный момент времени), расчет на 100 000 населения; заболеваемость (З), методика вычисления: З=число вновь выявленных заболеваний за год × 100 000/среднегодовая численность населения, проживающего на данной территории; структура заболеваемости (доля отдельных случаев заболеваний среди всех случаев (%)), методика вычисления: число отдельных случаев заболеваний × 100/всего случаев заболеваний; смертность (mortality) – количество смертельных случаев в определенной популяции за определенный период времени. Статистическая обработка исследуемого материала включала обработку всей базы данных с частотным анализом полей с дискретными непрерывными значениями (n, p ± mр, ДИ, где n – число наблюдений, р – относительный показатель, ДИ – доверительный интервал).
Для выявления закономерностей распространенности заболеваемости в течение времени проводился анализ уровней динамических рядов: абсолютный прирост (убыль), темп прироста (убыли), темп роста (снижения), средний темп прироста (%).
Результаты и обсуждение
В Свердловской области в 2018 г. численность населения составила 4 325 256 человек, из них женщин репродуктивного возраста – 1 017 000. При этом смертность – 13,5 на 1000, превысила рождаемость с показателем 11,6. Заболеваемость ЗНО составила 431,1 на 100 000 населения. Следует отметить, что смертность от ЗНО оказалась более 50% с интенсивным показателем 232,7 на 100 000 населения. У взятых на учет с ЗНО в 2018 г. 15 202 пациентов 1778 (11,7%) ЗНО были ВПЧ-ассоциированными.
Изучение распространенности ВПЧ среди женщин Екатеринбурга включало обследование 2567 женщин в возрасте от 16 до 75 лет, обратившихся на прием к акушеру-гинекологу по поводу профилактического осмотра. Средний возраст обследованных составил 34,2±3,5 года. Из всех обследованных ДНК ВПЧ обнаружена у 48,8% женщин (n=1252), из них ВПЧ высокого онкогенного риска (ВПЧ ВР) выявлялся у 848 обследованных, что составило 67,7±6,5% инфицированных женщин, 33,03±3,1% всей обследованной популяции женщин. Таким образом, стандартизованный показатель распространенности ПВИ на 1000 женского населения составил 487,7, показатель распространенности ВПЧ ВР – 330,3 на 1000 женского населения, что свидетельствовало о том, что каждая вторая женщина инфицирована ВПЧ, а каждая третья – ВПЧ ВР, что значительно превышало показатели российских и зарубежных исследователей [12, 13].
При дальнейшем обследовании, включавшем цитологические, кольпоскопические, патоморфологические методы исследований, у 343 (13,4%±1,7)%; 95% ДИ [6,5–20,3] женщин выявлены различные заболевания шейки матки: хронический цервицит – 119 человек, что составило (34,7±3,7)%; 95% ДИ [25,3–44,1], гиперкератоз – 65 пациенток (18,9±1,7)%; 95% ДИ [12,3–25,5], полип цервикального канала – 42 (12,2±1,3)%; 95% ДИ [6,3–18,1], CIN I – 91 (26,5±2,6)%; 95% ДИ [14,3–38,7] пациенток, CIN II – 20 (5,8±0,5)%; 95% ДИ [3,4–8,2], CIN III – 6 (1,7±0,3)%; 95% ДИ [1,2–2,2] пациенток. При этом в 25,3%±3,2% случаев цервицит и CIN I сочетались с гиперкератозом, CIN II и CIN III – в 38,1%±3,4% и 42,3%±4,1% соответственно, с цервицитом – в 75,0%±5,6% и 79,8%±5,8% случаев соответственно. Моментальный преваленс CIN I–III составил 0,045, или 117/2567 (4,56±0,1)% обследованных женщин, а моментальный преваленс CIN II–III – 0,01, или 26/2567 (1,01%) обследованных женщин.
Полученные данные свидетельствовали о высокой инфицированности женщин Екатеринбурга онкогенными типами папилломавирусов и значительной цервикальной заболеваемости фоновыми и предраковыми заболеваниями данных пациенток, что может являться одним из критериев вакцинопрофилактики в Свердловской области.

Спектр выявленных в 2008–2018 гг. ВПЧ-ассоциированных ЗНО в Свердловской области представлен в таблице.
Проведенная сравнительная характеристика заболеваемости РШМ в Екатеринбурге Свердловской области и России в динамике за последние 11 лет продемонстрировала значительный рост изучаемой патологии, особенно в Свердловской области, на 24,3%, со средним ежегодным приростом 2,2% (рис. 1).

Следует отметить значимую разницу показателей Свердловской области и Екатеринбурга в течение всех 11 лет (р=0,001). При этом за последние 3 года в Екатеринбурге имеется тенденция к снижению данного показателя, что может быть связано с более активным внедрением за последние 10 лет образовательных технологий на базе ФГБУ НИИ ОММ МЗ РФ, ФГБОУ ВО УГМУ МЗ РФ, включающих проведение как циклов повышения квалификации, так и школ, конференций для врачей акушеров-гинекологов, онкологов и смежных специалистов, в результате чего курсанты демонстрировали более высокий уровень оказания помощи пациенткам с CIN [14, 15].
Однако значительное увеличение доли РШМ среди женщин молодого репродуктивного возраста диктует целесообразность более активного внедрения профилактических программ (рис. 2).
Если в 2001–2006 гг. пик заболеваемости РШМ отмечался в 50–59 лет, то в 2013–2018 гг. пик заболеваемости отмечается в 30–39 лет. Во втором десятилетии ХХI в. произошло увеличение заболеваемости в возрасте 30–39 лет в 1,7 раза, и эта тенденция сохраняется по настоящее время: в 2007–2012 гг. первичная заболеваемость женщин этого возраста составляет уже 26,3 на 100 000 женщин старше 14 лет (р=0,004). Затем наступает период относительного спокойствия: женщины в возрасте 59–60 лет на протяжении последних 15 лет заболевали с одинаковой частотой. Более старший возраст (60–69 лет) за 15 лет продемонстрировал существенное снижение заболеваемости, в 1,7 раза: в 2007–2012 гг. заболеваемость РШМ у женщин этого возраста составила 10,4 на 100 000 женщин старше 14 лет (р=0,004). В возрастной группе старше 70 лет вновь наблюдается подъем заболеваемости, но и в данном случае аналогичный показатель прошлых десятилетий значительно выше периода 2007–2012 гг. в 1,5 раза (р=0,003).
При анализе повозрастной постадийной заболеваемости РШМ выявлено, что в возрастных категориях 20–29, 30–39, 40–49, 50–59 лет преобладает РШМ I–II ст. (р20-29=0,001, р30-39=0,003, р40-49=0,002, р50-59=0,003), возрастная категория 60–69 лет характеризуется незначительными отличиями между заболеваемостью I–II и III–IV стадиями. В возрасте 70 лет и старше преобладают запущенные стадии РШМ (р70=0,004).
Сравнительный анализ показал, что за истекший период возрастной состав пациенток с предраковой и раковой ПШМ изменился, «помолодел»: средний возраст пациенток в I временной период (2001–2006 гг.) составил 54,4±2,2 года; 95% ДИ [49,99–58,81], что незначительно отличалось от аналогичного показателя во II временной период (2007–2012 гг.), где средний возраст составил 52,5 года; 95% ДИ [45,22–59,78] при р=0,623, и значительно отличалось от изучаемого показателя в III временной промежуток (2013–1018 гг.). Средний возраст пациенток в 2007–2012 гг. составил 48,5±2,2 года; 95% ДИ [32,31–64,69], рI–III, рII–III=0,004.
В III временной период более половины женщин составили пациентки репродуктивного возраста – 20–29 и 30–39 лет, тогда как в I и II периоды таких женщин всего ¼ (р=0,008 и р=0,005 соответственно).
Однако значительное увеличение доли РШМ среди женщин молодого репродуктивного возраста диктует целесообразность более активного внедрения скрининговых и профилактических программ. Следует отметить, что выявление онкопатологии шейки матки у пациенток происходило в основном на ранних стадиях развития (рис. 3).
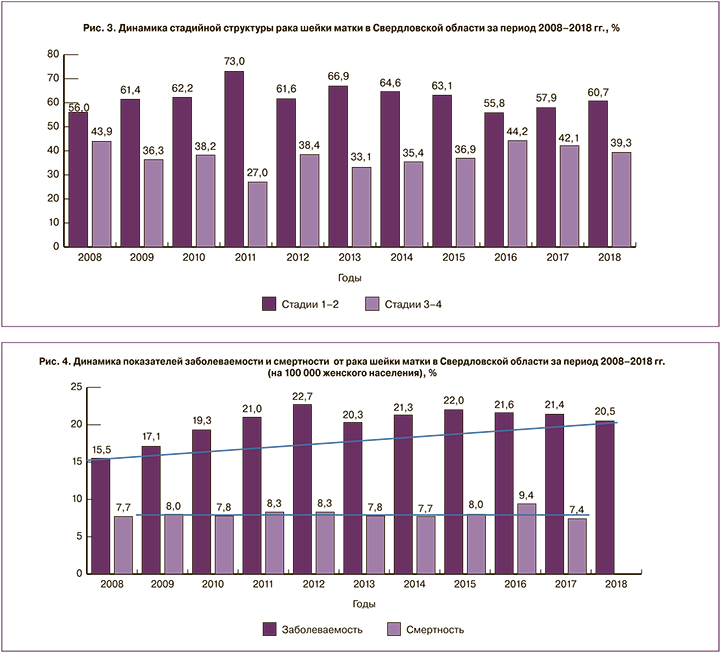
Обращает на себя внимание тенденция к снижению смертности при РШМ, несмотря на высокий рост заболеваемости данной локализации.
Данный феномен может быть связан как с более высокой выявляемостью РШМ в ранних стадиях, так и с улучшением оказания помощи пациенткам с изучаемой патологией [16] (рис. 4).
Анализ показателей заболеваемости редко встречающихся ВПЧ-ассоциированных болезней также демонстрирует значительный рост за последние 5 лет. Так, заболеваемость раком вульвы у женщин выросла на 36,7%.
Следует отметить, что ВПЧ даже при возникновении ВПЧ-ассоциированного заболевания любой степени не вызывает выработку антител в организме, поскольку отсутствует виремия, вирус реплицируется в кератиноцитах, готовых к смерти, пряча белки L1 и L2 подальше от мест иммунного надзора [10]. ВПЧ не вызывает гибель или лизис кератиноцитов, не высвобождаются цитокины, происходит лишь деструкция тканей с сохранением генома вируса в клетке. При этом реплицирующиеся вирусы вызывают образование белков E6 и E7, которые вмешиваются в механизм активации естественного иммунного ответа, убивая белок р53, отвечающий за апоптоз клетки, подавляют сигналы интерферона, необходимые для клеточного иммунного ответа, подавляют активность антивирусных цитокинов, активируют теломеразу, продляя жизнь клетке-хозяину [17].
Лишь активная защита посредством нейтрализующих антител, образующихся в ответ на введение созданной путем генной инженерии вакцины, способна остановить процесс реализации ВПЧ своего онкогенного потенциала [18].
За 15 лет поствакцинального наблюдения в более чем 90 странах учтены данные 60 млн человек и представлены убедительные доказательства положительного влияния вакцинации как на предотвращение заражений самим вирусом, так и на снижение количества неоплазий шейки матки [19].
Заключение
ДНК ВПЧ обнаружена у жительниц Екатеринбурга в 48,8% случаев, из них ВПЧ ВР выявлялся у 67,7±6,5%.
Заболеваемость ЗНО в Свердловской области составила 431,1 на 100 000 населения, 11,7% из них были ВПЧ-ассоциированными.
За исследуемый период заболеваемость РШМ выросла в регионе на 24,3%, со средним ежегодным приростом 2,2%. Из редких локализаций выявлен значительный рост заболеваемости раком вульвы, на 36,7%.
Неблагоприятная динамика показателей ВПЧ-ассоциированных заболеваний в Свердловской области, влияющая на областные демографические показатели, является научно обоснованным критерием для оптимизации скрининговых программ и принятия региональной Программы вакцинопрофилактики.



