Нормализация повышенного уровня эндотоксина и восстановление энтерогематического барьера (слизистой желудочно-кишечного тракта) в настоящее время признаны перспективными направлениями развития фармакологической помощи при различных заболеваниях [1, 2]. К лекарственным препаратам, которые обеспечивают адекватное воздействие на оба вышеупомянутых звена патогенеза заболеваний, относятся кишечные адсорбенты (энтеросорбенты). Появление современного энтеросорбента «Энтеросгель» (полиметилсилоксана полигидрат, производитель ООО «ТНК СИЛМА», Россия, Регистрационное удостоверение ЛП № 000036) расширило возможности энтеральной детоксикации. Препарат показал сорбционную активность в отношении эндотоксина грамотрицательных бактерий (липополисахарида), в то же время относительно мало сорбирует низкомолекулярные вещества, например, лекарственные препараты [3, 4]. Это позволило его рекомендовать как метод терапии гестационных пиелонефритов и послеродовых гнойно-септических осложнений [5].
Неразвивающаяся беременность является полиэтиологичной нозологической единицей, причиной которой часто является длительная персистенция инфекционного агента в слизистой оболочке полости матки с последующим развитием воспалительного процесса – хронического эндометрита – синдрома, сопровождающегося множественными вторичными морфофункциональными изменениями, ведущими к нарушениям циклической трансформации и рецептивности эндометрия. Следует отметить, что гистологически хронический эндометрит подтверждается у 72% больных с диагностируемыми инфекциями, передающимися половым путем, и у 68% больных с трубноперитонеальным бесплодием [6].
В последнее десятилетие опубликованы сведения об участии эндотоксина в хронизации воспалительных процессов. Эндотоксин участвует в регуляции различных систем организма и определяет основополагающий уровень физиологической активности этих систем в регулярно меняющихся внешних условиях. Эту функцию эндотоксин способен реализовывать за счет широкого диапазона биологических свойств и способности взаимодействовать с различными рецепторами. Выведение эндотоксина из организма в большей степени происходит за счет связывания с гистиоцитами печени, результатом этого взаимодействия является активация выработки фактора некроза опухоли альфа, интерлейкинов (ИЛ) и интерферонов. Они, в свою очередь, реализуют общую неспецифическую резистентность организма: противоопухолевый, антибактериальный и противовирусный иммунитет [7–12]. При несоответствии нормальным уровней цитокинов первой фазы иммунного ответа и антиэндотоксинового иммунитета можно утверждать о хронизации воспалительного процесса в слизистой оболочке тела матки.
Целью нашей исследовательской работы явился анализ роли эндотоксина и антиэндотоксиновой агрессии на ранних сроках гестации при формировании хронического эндометрита, следствием которого может быть неразвивающаяся беременность, и определение методов коррекции антиэндотоксинового иммунитета.
Первичные результаты оценивались по нормализации повышенного уровня эндотоксина грамотрицательной флоры, определяемой по микро-ЛАЛ-тесту, а также уровней провоспалительных цитокинов ИЛ-1β, ИЛ-6, тумор-некротического фактора альфа (TNF-α). Вторичные результаты оценивались по развитию и течению последующей беременности, завершившейся родами. Сроки наблюдения за пациентками составили 2 года.
Материалы и методы
В ходе проведенного контролируемого исследования (сравнительного открытого) были оценены эффективность, переносимость и безопасность энтеросорбента «Энтеросгель» у больных с диагнозом «хронический эндометрит после прерывания неразвивающейся беременности». В исследовании принимали участие 128 пациенток репродуктивного периода (25,50 (19,00;32,00) года): 98 больных основной группы с неразвивающейся беременностью сроками до 12 недель и 30 женщин аналогичных сроков гестации, госпитализированных для проведения артифициального аборта по собственному желанию, составивших группу контроля (рис. 1). Основная группа была разделена на 3 подгруппы (рис. 1).
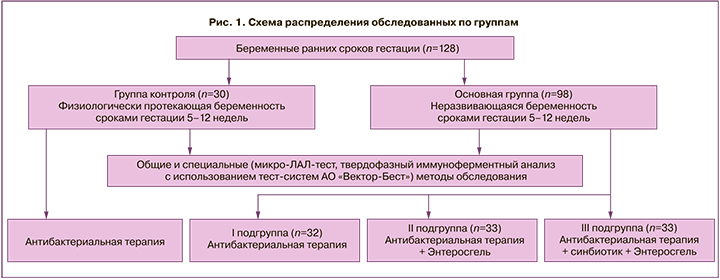
В первую подгруппу вошли 32 больные с установленным диагнозом «неразвивающаяся беременность». В этой подгруппе использовалась схема лечения, применяющаяся у больных после медикаментозного прерывания беременности, соответствующая приказу Министерства здравоохранения РФ от 1 ноября 2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю “Акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)”» для профилактики послеоперационных осложнений: инъекционный цефалоспориновый антибиотик широкого спектра действия III поколения (цефтриаксон) по 1 г 1 раз в сутки в/м в течение 7 дней + метронидазол 250 мг 3 раза в день в течение 7 дней.
Во 2-й подгруппе у 33 больных с диагнозом «неразвивающаяся беременность» применялась та же схема лечения, как и в 1-й подгруппе, но с добавлением в схему сорбента «Энтеросгель» по 1 саше 15 г 3 раза в день 2 недели.
Третья подгруппа состояла из 33 больных с диагнозом, аналогичным таковому в предыдущих двух подгруппах. У них применялась схема лечения, аналогичная схеме 2-й подгруппы, но с добавлением к ней синбиотика нового поколения (пребиотик олигофруктоза 63 мг и лиофилизат пробиотических бактерий: Lactobacillus helveticus 9,00×108 КОЕ, Lactococcus lactis 9,00×108 КОЕ, Bifidobacterium longum 6,75×108 КОЕ, Bifidobacterium breve 4,50×108 КОЕ, Streptococcus thermophilus 4,50×108 КОЕ, Lactobacillus rhamnosus 4,50×108 КОЕ, Lactobacillus casei 2,25×108 КОЕ, Lactobacillus plantarum 2,25×108 КОЕ, Bifidobacterium bifidum 2,2×108 КОЕ), который рекомендовали пациенткам в течение 14 суток по 1 капсуле в день.
Больным с выявленной хламидийной инфекцией назначали в качестве антибактериальной терапии доксициклин по 100 мг 2 раза в день в течение 10 дней. При выявлении в мазке грибковой инфекции дополнительно рекомендовали флуконазол 150 мг перорально однократно. Больным с верифицированной вирусно-бактериальной контаминацией проводили лечение суппозиториями человеческого рекомбинатного интерферона альфа-2b по 500 000 МЕ 2 раза per rectum в течение 10 дней в сочетании с антибактериальными препаратами широкого спектра действия.
В исследование вошли больные, добровольно подписавшие «информированное согласие» на участие в исследовании, возраст которых соответствовал фертильному, сроки гестации составляли 5–12 недель. Больные с пороками развития матки, недоразвитием половых органов, эндокринопатиями при повышенном уровне гормонов андрогенового ряда и с нарушениями свертываемости крови не вошли в исследование. Также критерием включения являлся нормальный кариотип по результатам цитогенетического исследования абортивного материала.
Критерии невключения в исследование: сроки гестации, не соответствующие срокам 5–12 недель, заболевания других органов и систем, при которых гестация опасна для жизни матери, невозможность конструктивного диалога с пациенткой, психологические и эмоциональные расстройства, препятствующие подписанию «информированного согласия», генетические и аутоиммунные нарушения у матери или отца, острые инфекционные процессы у матери, а также отказ матери от участия в исследовании после процедуры добровольного подписания информированного согласия.
Обследование пациенток включало сбор анамнеза, изучение лабораторных (клинико-биохимических, бактериоскопических) данных. Из специальных методов были применены: ПЦР-диагностика генитальных инфекций, изучение эндотоксемии и антиэндотоксинового иммунитета, определение «ранних» цитокинов. Проводилось гистологическое исследование полученного материала после медикаментозного прерывания неразвивающейся беременности.
Количественная оценка содержания эндотоксина в общем кровотоке определялась с использованием микро-ЛАЛ-теста (Limulus Amebocyte Lysate-тест), в основе которого лежит способность гемолимфы рачка Limulus polyphemus коагулироваться при контакте с эндотоксинами различного генеза [7, 11, 13]. В качестве единицы физической величины используется Eu/ml, равная 0,2 нг стандарта ЕС-2/мл.
Уровни провоспалительных цитокинов ИЛ-1β, ИЛ-6 и TNF-α в общем кровотоке определяли с помощью твердофазного иммуноферментного анализа с применением тест-систем АО «Вектор-Бест» (Россия): «Интерлейкин-1-бета-ИФА-БЕСТ», «Интерлейкин-6-ИФА-БЕСТ» и «альфа-ФНО-ИФА-БЕСТ» [14].
Статистический анализ
Для описания количественных переменных применялись медиана, верхний и нижний квартили в формате Me (LQ;UQ). Сопоставления двух групп по количественным переменным осуществлялись с помощью непараметрического критерия Манна–Уитни. Сравнения трех и более групп по количественным показателям проводились на основе непараметрического критерия Краскела–Уоллиса. Статистическая достоверность различий групп для бинарных и номинальных шкал определялась с использованием метода χ2 Пирсона в случае независимых выборок и при помощи метода МакНеймера в случае зависимых выборок. Анализ зависимых показателей для сравнения двух периодов осуществлялся на основе непараметрического метода Вилкоксона. Уровень статистической значимости был зафиксирован на уровне 0,05. Статистическая обработка данных осуществлялась c помощью пакетов прикладных программ Statistica 10 и SAS JMP 11 [15–18].
Результаты и обсуждение
Сбор анамнеза у обследуемых больных позволил выявить перенесенные соматические заболевания, которые могут воздействовать на процессы формирования и функционального становления женской половой системы.
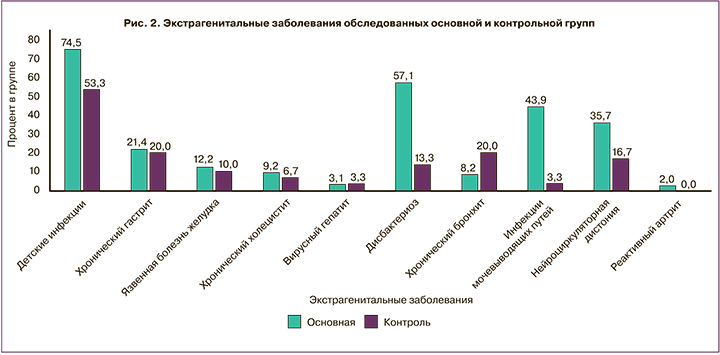
Данные об экстрагенитальных патологиях больных с диагнозом «неразвивающаяся беременность» и пациенток с физиологической гестацией проиллюстрированы рисунком 2.
Из данных, представленных на рисунке 2, следует, что в анамнезе воспалительные заболевания мочевыделительной системы (р<0,001), детские инфекции (р=0,03) и дисбактериоз (р<0,001) чаще регистрировались у пациенток основной группы в сравнении с частотой этих же заболеваний в группе контроля.
Исходя из данных показателей можно предположить, что есть вероятность их воздействия на иммунный гомеостаз у обследуемой группы пациенток.
В обеих группах частота нейроциркуляторной дистонии, хронического гастрита, вирусных гепатитов, язвенной болезни, хронического бронхита статистически значимо не отличалась (p>0,05).
В результате изучения анамнеза выявлено, что в основной группе больных доля перенесенных воспалительных процессов генитального тракта была выше по сравнению с группой контроля. У больных с диагнозом «неразвивающаяся беременность» кольпиты в сочетании с цервицитами выявлены у 29,6%, воспаление шейки матки в сочетании с бактериальным вагинозом – у 22,4%, воспалительный процесс слизистой влагалища в сочетании с бактериальным вагинозом – у 30,6%, воспаление шейки матки и воспаление придатков сочетались у 17,3%. Доля аналогичных нозологических единиц в группе пациенток с физиологической беременностью отличалась и составила 26,7, 23,3, 36,7, 13,3% соответственно.
Среди ранее перенесенных гинекологических заболеваний у пациенток с неразвивающейся беременностью были диагностированы: эндометриоз, полипы эндометрия, гиперплазия эндометрия, доля которых в процентном соотношении составила соответственно 27,6, 13,3 и 13,3%. Эти показатели выше при сравнении с аналогичными нозологиями в группе здоровых (20,0, 0,0 и 3,3% соответственно). Статистически значимое различие обнаружено для показателя «полип эндометрия» в основной группе по отношению к контрольной (на 13,3%; р=0,04) [13].
Итоги полимеразной цепной реакции (ПЦР) на определение видового состава микроорганизмов из канала шейки матки говорят о высокой частоте выявления инфекционных агентов, ассоциированных с ИППП, у больных с диагнозом «неразвивающаяся беременность». Частота их выявления в процентном соотношении следующая: Chlamydia trachomatis – у 10,2% больных, Mycoplasma genitalium – у 18,4%, Neisseria gonorrhoeae – у 1%, Trichomonas vaginalis – у 2%, Herpes simplex virus (HSV) (type - 1, - 2) – у 3,1%, Cytomegalovirus (CMV) – у 3,1%, Human papillomavirus (HPV) – у 21,4%, Ureaplasma urealyticum – у 27,6% (p<0,01). Аналогичные показатели в группе контроля были значительно ниже: HPV – у 6,7%, Ureaplasma urealyticum – у 3,3%, Chlamydia trachomatis – у 0,0%, Mycoplasma genitalium, Neisseria gonorrhoeae, Trichomonas vaginalis, HSV (type-1, -2) и CMV не определялись.
По результатам ПЦР на определение микробиоценоза в материалах, полученных из полости матки, у основной когорты больных в 100% случаев обнаружена персистенция внутриматочных инфекционных агентов. Chlamydia trachomatis диагностирована у 38,9% больных, Ureaplasma urealyticum – у 24,4%, Mycoplasma genitalium – у 19,5%, Neisseria gonorrhoeae составила 1,0%, Klebsiella – 75,5%, Enterococcus faecalis – 55,1%,HSV (type-1, -2) – 7,1%; СМV – 2,0%.
Данные гистологического анализа показали, что в основной когорте больных у 88,8% женщин подтвержден диагноз «хронический эндометрит» с гистологической картиной длительно текущего процесса, для которого характерны фиброз и склероз стенок спиральных артерий слизистой оболочки тела матки, лейкоцитарная инфильтрация. 11,2% составили больные с морфологической картиной острого эндометрита [13].
Данные ПЦР показывают, что у пациенток с диагнозом «неразвивающаяся беременность» с установленным при гистологическом исследовании хроническим эндометритом в стадии обострения (n=87) в полости матки выявлены инфекционные агенты преимущественно бактериальной природы: Chlamydia trachomatis – у 43,7% пациенток, Ureaplasma urealyticum – у 26,4%, Mycoplasma genitalium – у 21,8%, Neisseria gonorrhoeae – у 1,1%, Trichomonas vaginalis – у 0,0%, Klebsiella – у 82,8%, Enterococcus faecalis – у 58,6%, HSV (typ -1, -2) – у 3,4%, CMV – у 0,0%, HPV – у 0,0%. У больных, принадлежащих к основной когорте с морфологически установленным диагнозом «острый эндометрит» (n=11), данные показатели отличались: Chlamydia trachomatis – у 0,0%, Ureaplasma urealyticum – у 9,1%, Mycoplasma genitalium – у 0,0%, Neisseria gonorrhoeae – у 0,0%, Trichomonas vaginalis – 0,0%, Klebsiella – у 18,2%, Enterococcus faecalis – у 27,3%, HSV (type-1, -2) – у 36,4%, CMV – у 18,2%, HPV – у 0,0%. Следует обратить внимание на то, что у данной когорты больных в слизистой оболочке тела матки выявлена персистенция вирусно-бактериального микромира с преобладанием HSV над CMV. Полученные результаты аналогичны данным, полученным в исследовании, проведенном Семенцовой Н.А. (2013) [19].
В таблице 1 представлены описательные статистики количественных переменных для категорий «Личные данные» и «Результаты».
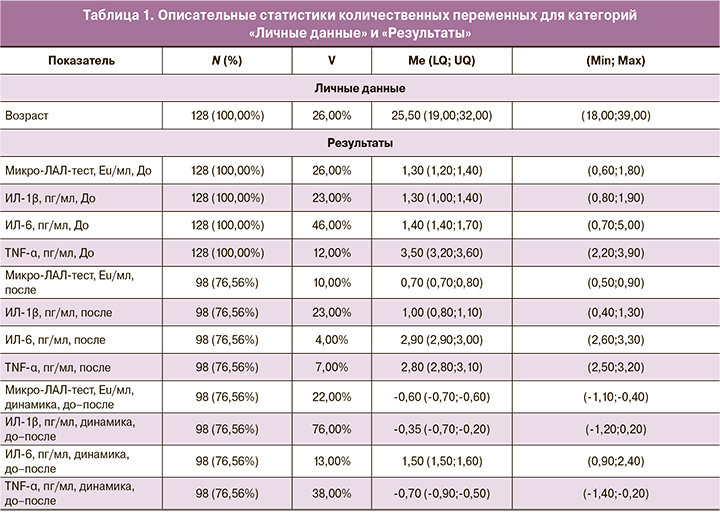
На основании таблицы 1 можно сделать вывод о том, что среди 13 переменных у трех показателей наблюдаются наименьшие доли полноты данных от 98 (76,56%) до 98 (76,56%): «TNF-α, пг/мл, динамика, до–после», «ИЛ-6, пг/мл, динамика, до–после» и «ИЛ-1β, пг/мл, динамика, до–после». Данных объемов достаточно для проведения статистического анализа данных и формирования статистических выводов. Коэффициент вариации изменяется в диапазоне от 4 до 76%, что говорит о высоком уровне разнородности некоторых исследуемых показателей. Самыми однородными показателями оказались: «ИЛ-6, пг/мл, после», «TNF-α, пг/мл, после» и «Микро-ЛАЛ-тест, Eu/мл, после», а самыми неоднородными – «ИЛ-1β, пг/мл, динамика, до–после», «ИЛ-6, пг/мл, до» и «TNF-α, пг/мл, динамика, до–после».
 Результаты микро-ЛАЛ-теста показывают, что уровень липополисахарида в системном кровотоке у пациенток с физиологически протекающей беременностью (n=30) не превышает общепринятую норму (до 1,0 Eu/ml [7]) и составил 0,70 (0,60;0,70) Eu/ml.
Результаты микро-ЛАЛ-теста показывают, что уровень липополисахарида в системном кровотоке у пациенток с физиологически протекающей беременностью (n=30) не превышает общепринятую норму (до 1,0 Eu/ml [7]) и составил 0,70 (0,60;0,70) Eu/ml.
По результатам микро-ЛАЛ-теста женщины с верифицированным хроническим эндометритом имеют повышенный уровень эндотоксина в плазме крови – 1,30 (1,30;1,40) Eu/ml, что имеет статистически значимые различия с показателями в группе здоровых (p<0,001). Проведенные исследования демонстрируют, что у 52,9% больных с диагнозом «хронический эндометрит» значения липополисахарида в крови превышали 1,5 Eu/ml по сравнению с острым эндометритом (p<0,01) (рис. 3).
При определении провоспалительных цитокинов в гемоциркуляции было выявлено, что у основной когорты больных показатели ИЛ-1β, ИЛ-6 были 1,35 (1,30;1,50) пг/мл и 1,40 (1,30;1,50) пг/мл соответственно, а у здоровых пациенток: ИЛ-1β – 0,80 (0,80;0,88) пг/мл, ИЛ-6 – 2,90 (2,40;3,68) пг/мл (p<0,001; p<0,001). В основной группе выявлены повышенные уровни TNF-α –3,60 (3,50;3,60) пг/мл, в то время как в контрольной группе его показатеи соответствовали 2,70 (2,60;2,80) пг/мл (p<0,001). Важно отметить, что ИЛ-6, подавляющий избыточную продукцию ИЛ-1β и TNF-α, в основной группе снижен в 2,2 раза по сравнению с группой контроля, что констатируется при длительной персистенции инфекции [14].
После медикаментозного прерывания беременности (мифепристон 200 мг per os 1 раз; через 24–48 ч – мизопростол 200 мг сублингвально 1 раз) проводилась терапия по вышеуказанным лекарственным схемам. Больные основной группы были разделены на три подгруппы в зависимости от схемы медикаментозной терапии после опорожнения полости матки [14].
После проведенного лечения повторно было оценено состояние иммунитета. Результаты подтвердили, что у всех женщин основной группы удалось достичь нормальных показателей антиэндотоксинового и общего иммунитета, но их показатели статистически значимо различались в зависимости от применения конкретной схемы терапии. В 3-й подгруппе пациентки показали более выраженные изменения иммунного гомеостаза, который был на уровне верхней границы группы контроля (табл. 2).

По данным таблицы 2 можно сделать вывод: в рассматриваемый период времени в категории «Результаты» все показатели статистически значимо изменяются. Наиболее значимые изменения обнаружены для показателя «ИЛ-6, пг/мл» (в среднем на 1,5 пг/мл; p<0,001); показателя «ИЛ-1β, пг/мл» (в среднем на 0,2 пг/мл; p<0,001); показателя «Микро-ЛАЛ-тест, Eu/мл» (в среднем на 0,5 Eu/мл; p<0,001).
В таблицах 3 и 4 представлены результаты статистического анализа сравнения трех подгрупп основной когорты больных по количественным показателям в период «до–после».
На основании таблиц 3 и 4 можно сделать вывод о том, что в категории «Результаты» все показатели статистически значимо различаются между тремя сравниваемыми группами. Наиболее значимые различия обнаружены для показателя «TNF-α, пг/мл, динамика» в группе «I подгруппа» по отношению к группе «III подгруппа» (в среднем на 0,5 динамика; p<0,001); показателя «ИЛ-1β, пг/мл, динамика» в группе «I подгруппа» по отношению к группе «II подгруппа» (в среднем на 0,4 динамика; p<0,001); показателя «Микро-ЛАЛ-тест, Eu/мл, динамика» в группе «I подгруппа» по отношению к группе «III подруппа» (в среднем на 0,2 динамика; p<0,001).

Дальнейшее наблюдение за пациентками основной группы в динамике показало, что наступление последующей беременности, закончившейся родами по окончании курса лечения и периода реабилитации, наблюдалось у 6 женщин I подгруппы, у 19 – II подгруппы, у 30 – III подгруппы. Остальные пациентки выбыли из-под наблюдения в связи с окончанием исследования.
Побочных эффектов, связанных с приемом «Энтеросгеля», за весь период наблюдения в основной и контрольной группе не отмечено.
Заключение
Полученные данные свидетельствуют о целесообразности подавления воспалительного процесса в полости матки путем применения антибиотиков широкого спектра действия, коррекции состояния антиэндотоксинового иммунитета назначением энтеросорбента «Энтеросгель». Наиболее оптимальной для наступления последующей беременности, ее течения и исходов явилась схема, включающая этиотропный антибиотик III поколения широкого спектра действия цефалоспоринового ряда, энтеросорбента «Энтеросгель» и синбиотика, что позволило в последующем снизить количество репродуктивных потерь. Проведенное исследование показало хорошую переносимость, эффективность и безопасность энтеросорбента «Энтеросгель» в комплексной терапии пациенток с хроническим эндометритом.



