Синдром поликистозных яичников (СПКЯ) – одно из самых распространенных в мире заболеваний у женщин репродуктивного возраста (частота заболеваемости достигает 20% среди женского населения развитых стран) [1]. СПКЯ – самый распространенный фактор женского бесплодия эндокринного генеза.
Патогенез СПКЯ до сих пор полностью не определен; обсуждается значение генетических, эпигенетических, эндокринно-метаболических факторов в развитии заболевания [2–5].
Роттердамские соглашения, сформулированные в 2004 г. и предполагающие диагностику СПКЯ на основании наличия двух из трех предлагаемых характеристик – клинические или биохимические признаки гиперандрогении, олиго- или ановуляция, поликистозные яичники по данным ультразвукового исследования, подверглись резкой критике специалистов, т.к. нивелировали само понятие СПКЯ как синдрома, включающего ряд клинических и лабораторных симптомов. Следствием дискуссии явилась новая классификация 2012 г., выделяющая фенотипы СПКЯ [6].
Указанная классификация в настоящее время используется в клинической практике, хотя и ее недостатки очевидны [7].
Не менее дискуссионным вопросом является выбор способа достижения беременности у этого контингента пациенток.
Классически считается, что препаратами первой линии при лечении ановуляторного бесплодия у пациенток с СПКЯ являются кломифена цитрат и летрозол. В случае их неэффективности и/или невозможности приема в качестве терапии второй линии проводится стимуляция овуляции гонадотропинами или хирургическое лечение – лапароскопический дриллинг яичников [8, 9]. Применение вспомогательных репродуктивных технологий (ВРТ) у пациенток с СПКЯ является третьей линией терапии [9].
Вместе с тем ряд специалистов считают последовательную тактику лечения бесплодия у больных с СПКЯ устаревшей в современных условиях, когда возраст пациенток приближается к позднему репродуктивному. Аргументами являются более быстрое достижение беременности при проведении экстракорпорального оплодотворения (ЭКО), возможность провести генетическое тестирование полученных эмбрионов, криоконсервация «лишних» эмбрионов для последующего деторождения [10].
Определенные ограничения при стимуляции яичников у больных с СПКЯ, а именно повышенный риск развития синдрома гиперстимуляции яичников, привели к разработке методики получения незрелых ооцитов в нестимулированном цикле и их «доращивания» in vitro (IVM). Приверженцы этой методики аргументируют свой выбор ее безопасностью и низкой затратностью вследствие отсутствия гонадотропной стимуляции [11, 12]. Однако эффективность IVM оказалась значительно ниже классического ЭКО, а модификации протоколов стимуляции, замена триггера овуляции и криоконсервация всех полученных эмбрионов значительно снизили риски развития синдрома гиперстимуляции яичников [13, 14].
Тем не менее при проведении программ ЭКО у пациенток с СПКЯ возникает ряд сложностей и особенностей как на этапе стимуляции яичников, так и на эмбриологическом этапе. Есть указания на то, что для пациенток с СПКЯ в программах ВРТ характерно получение большего количества ооцитов по сравнению с пациентками с нормальным овариальным резервом. Однако значительная часть полученных ооцитов характеризуются как незрелые. Отмечены нарушения процессов раннего эмбриогенеза и бластуляции, когда при получении достаточного количества зрелых ооцитов и адекватном оплодотворении отсутствуют бластоцисты хорошего качества [15, 16].
Указанные факты, а также возможная генетическая природа формирования СПКЯ обусловливают мнение ряда специалистов о необходимости обязательного проведения преимплантационного генетического тестирования на анеуплоидии (ПГТ-а) пациенткам с СПКЯ в программах ЭКО [17].
В целом вопрос влияния ПГТ-а на эффективность программ ВРТ у пациенток с бесплодием различного генеза до сих пор обсуждается. Что касается пациенток с СПКЯ, то есть данные, что проведение ПГТ-а особенно эффективно у таких пациенток молодого возраста (до 35 лет) [18], а также снижает риск выкидышей у данной категории пациенток [19].
Однако указанные вопросы далеки от окончательного решения, что обусловило актуальность настоящего исследования, целью которого явилось провести сравнительную оценку эффективности программ ВРТ с проведением ПГТ-а и без него у пациенток с СПКЯ.
Материалы и методы
Данное исследование является нерандомизированным клиническим испытанием, проводимым в двух группах испытуемых с целью доказательства эффективности наступления беременности при проведении ПГТ-а у пациенток с СПКЯ. Исследование проводилось на базе НМИЦ АГиП им. В.И. Кулакова Минздрава России. В исследование вошли 80 женщин 18–40 лет с СПКЯ согласно Роттердамским критериям, проходивших лечение бесплодия (при неэффективности терапии первой и второй линии при ановуляторном бесплодии, обусловленном СПКЯ) в 1-м гинекологическом отделении Центра c сентября 2020 г. по март 2022 г. Женщин наблюдали до наступления исходов (до 9 месяцев) – ненаступления беременности, биохимической беременности, выкидыша, неразвивающейся беременности или родоразрешения.
В 1-ю группу (n=40) были включены женщины, проходившие лечение в программе ЭКО/интрацитоплазматической инъекции сперматозоида в яйцеклетку (ИКСИ) c ПГТ-а.
Во 2-ю (контрольную) группу (n=40) вошли женщины, проходившие лечение в программе ЭКО либо ЭКО/ИКСИ без ПГТ-а.
Критериями включения в исследование были: возраст пациенток от 18 до 40 лет, наличие СПКЯ, показания к проведению программ ВРТ. Критериями исключения были противопоказания к проведению программ ВРТ, тяжелый мужской фактор, аномалии развития матки, онкологические заболевания, наличие ВИЧ-инфекции и других иммунодефицитных состояний.
Перед программами ЭКО и ЭКО/ИКСИ были проведены стандартные клинико-лабораторные исследования: ультразвуковое, гормональное, анамнестическое согласно Приказу Минздрава РФ (№ 107н, 803н).
Стимуляция функции яичников в обеих группах проводилась в протоколах с антагонистами гонадотропин-рилизинг-гормона (антГнРГ), начиналась со 2–3-го дня менструального цикла с использованием препаратов рекомбинантного фолликулостимулирующего гормона (ФСГ), человеческих менопаузальных гонадотропинов, содержащих равное количество ФСГ и лютеинизирующего гормона (ЛГ). Выбор стартовой дозы гонадотропинов осуществлялся в зависимости от индивидуальных параметров пациентки – возраста, индекса массы тела, гормонального статуса и овариального резерва (оценивались количество антральных фолликулов (КАФ), уровень антимюллерова гормона (АМГ) и объем яичников) и составлял от 100 до 225 МЕ/сутки.
С целью подавления преждевременного пика ЛГ по достижении диаметра фолликулов 13–14 мм ежедневно вводился препарат антГнРГ в дозе 0,25 мг/сутки подкожно до дня назначения триггера овуляции включительно.
Для финального созревания ооцитов при достижении лидирующим фолликулом диаметра не менее 17 мм назначали триггер овуляции. В качестве триггера овуляции, учитывая наличие СПКЯ и высокий риск развития синдрома гиперстимуляции яичников, у всех пациенток использовался препарат трипторелина ацетата в дозировке 0,2 мг подкожно.
Спустя 36 ч после введения триггера овуляции проводились трансвагинальная пункция яичников и забор ооцитов с оценкой зрелости аспирированных ооцит-кумулюсных комплексов. В группе без ПГТ-а полученные ооциты были оплодотворены спермой партнера методом инсеминации in vitro (n=17, 42,5%) либо методом ИКСИ (n=23, 57,5%) по показаниям (в зависимости от качества спермы). В группе пациенток с ПГТ-а в 100% оплодотворение производилось методом ИКСИ.
На 1-е сутки оценивали оплодотворение по наличию двух пронуклеусов, на 5–6-е сутки культивирования производились биопсия трофэктодермы всех морфологически подходящих эмбрионов (от 3ВВ и 3AB и выше по классификации Гарднера) для проведения последующего ПГТ-а (в 1-й группе пациенток) и криоконсервация бластоцист в обеих группах пациенток.
В лаборатории молекулярно-генетических методов проводилось ПГТ-а по 46 хромосомам методом высокопроизводительного секвенирования следующего поколения NGS.
Все пациентки из обеих групп в следующем менструальном цикле вступали в программу переноса криоконсервированных/размороженных эмбрионов в полость матки на фоне заместительной гормональной терапии. С 4–5-го дня менструального цикла осуществлялся ультразвуковой мониторинг, назначалась циклическая гормональная терапия при условии отсутствия функциональных кист в яичниках и наличия эндометрия толщиной не более 4–5 мм. Подготовка эндометрия проводилась препаратом эстрадиола валерат в дозировке от 6 до 8 мг, с 15–16-го дня менструального цикла добавляли микронизированный прогестерон в дозировке 600 мг либо дидрогестерон в дозировке 30 мг. Перенос эмбриона в полость матки осуществляли на 6-й день приема препаратов прогестерона. Всем пациенткам переносили в полость матки по одному эмбриону лучшего качества. В посттрансферном периоде прием указанных препаратов продолжался. На 14-й день после переноса эмбриона в полость матки определялась концентрация бета-хорионического гонадотропина в сыворотке крови.
Эффективность программ ВРТ оценивалась по количеству наступивших беременностей, количеству биохимических беременностей, количеству эктопических беременностей, количеству выкидышей и неразвивающихся беременностей, показателям живорождения.
Статистический анализ
Обработка полученных данных проводилась одним исследователем с использованием программы Statistica версия 8.0 (StatSoft Inc., США).
Для количественных показателей были рассчитаны: среднее значение (М), среднеквадратическое отклонение (SD), 95% доверительный интервал (ДИ), медиана (Ме), интерквартильный размах (Q25%–Q75%). Для качественных и порядковых показателей – частоты (%).
Все полученные количественные параметры были проверены на соответствие нормальному распределению с помощью критерия Шапиро–Уилка. Предполагалось, что исследуемое распределение не отличается от нормального распределения (нулевая гипотеза – что распределения одинаковые). При полученном р<0,05 нулевую гипотезу отвергали, считали, что исследуемое распределение отличалось от нормального.
Числовые параметры, имеющие нормальное распределение, представлены в формате М (SD), где М – среднее значение, SD – стандартное отклонение среднего значения. Параметры, имеющие распределение, отличное от нормального, представлены в формате Мe (Q25%; Q75%), где Мe – медиана, а Q25% и Q75% – верхний и нижний квартили.
При нормальном распределении данных для нахождения различий между группами пациентов для числовых показателей использовали t-критерий Стьюдента для двух независимых выборок. В случае неподтверждения гипотезы о нормальном распределении для сравнения количественных данных применяли непараметрический U-критерий Манна–Уитни для несвязанных совокупностей.
Для сравнения дихотомических показателей между независимыми выборками и установления статистически значимых различий между ними использовали метод Хи-квадрат (χ2), для вычисления которого прибегали к построению таблиц «2×2», χ2 и двусторонний точный критерий Фишера для небольших выборок. При невозможности применения критерия χ2 (все ожидаемые числа >5) использовался Z-критерий (аналог t-критерия Стьюдента для долей), а для 0% и 100% – с поправкой для концевых точек.
Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
В работе был рассчитан относительный риск (ОР) с 95% ДИ возникновения событий, который вычисляли по методу Woolf.
Для бинарных исходов размер эффекта был рассчитан как отношение рисков и абсолютное снижение риска (95% ДИ).
Проверяемая гипотеза – получение не меньшей эффективности наступления и сохранения беременности. Расчет размера выборки базируется на анализе основной переменной исхода, в данном исследовании – частоты наступления клинической беременности и родоразрешения.
Ранее проведенные исследования продемонстрировали, что частота наступления клинической беременности колеблется от 0 до 50%, а потери составляют до 35%. Считаем, что снижение частоты потерь до 10% будет являться клинически значимым результатом.
Результаты
Клиническая характеристика пациенток исследуемых групп приведена в таблице 1.
Как видно из представленных данных, все пациентки были репродуктивного возраста. Хотя пациентки группы с ПГТ-а были несколько старше и имели больший вес, статистически значимых различий между группами не было выявлено (p>0,05). Группы были репрезентативны по основным клиническим характеристикам.
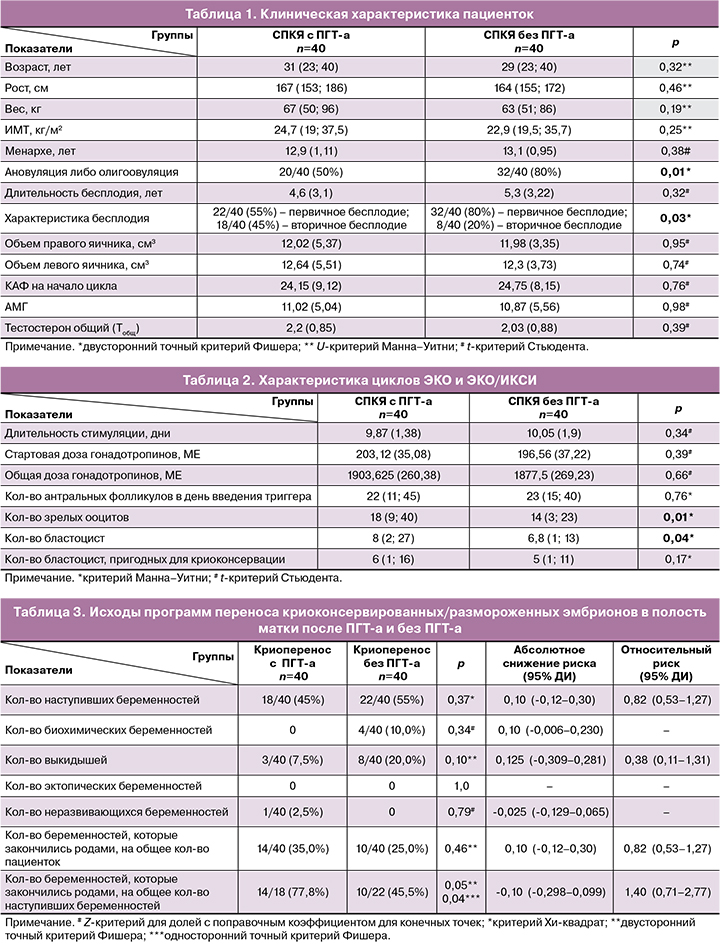
В группе пациенток c ПГТ-а вторичное бесплодие составило 18/40 (45%). Всего в анамнезе было 25 беременностей, 3/25 (12%) из их числа составили выкидыши, 15/25 (60%) – неразвивающиеся беременности, 6/25 (24%) – роды, 1/25 (4%) – аборты.
В группе пациенток без ПГТ-а вторичное бесплодие составило 8/40 (20%). Всего в анамнезе было 10 беременностей, 4/10 (40%) из их числа составили выкидыши, 1/10 (10%) – аборты, 2/10 (20%) – роды, 2/10 (20%) – неразвивающиеся беременности, 1/10 (10%) – внематочные беременности.
Среднюю продолжительность менструального цикла у пациенток обеих групп вычислить не представлялось возможным, поскольку у большей части пациенток отмечалась хроническая ановуляция либо олигоовуляция (менструальный цикл продолжительностью от 28 дней до 6 месяцев) – у 20/40 (50%) женщин в группе с ПГТ-а и 32/40 (80%) женщин в группе без ПГТ-а, и/или имел место длительный прием комбинированных оральных контрацептивов – у 15/40 (35%) женщин в группе с ПГТ-а и 6/40 (15%) женщин без ПГТ-а (р=0,04 двусторонний точный критерий Фишера).
По уровню общего тестостерона гиперандрогения была диагностирована у 25/40 (62,5%) женщин в группе с ПГТ-а и у 17/40 (42,5%) в группе без ПГТ-а (р=0,12 двусторонний точный критерий Фишера).
В группе пациенток с ПГТ-а было зафиксировано статистически значимо большее количество зрелых ооцитов и количество бластоцист (р<0,05).
Все эмбрионы, пригодные для криоконсервации (отличного и хорошего качества), были витрифицированы. В группе пациенток с ПГТ-а биопсии подвергались эмбрионы 5–6-х суток с содержанием клеток в трофэктодерме >120, с хорошо сформированной внутриклеточной массой – биоптат содержал 7–8 клеток. По классификации Гарднера, это были эмбрионы от 3ВВ и 3AB и выше.
В группе пациенток с ПГТ-а среднее (Me) количество эмбрионов, подвергнутых биопсии, составило 5 (1; 12), среднее (Me) количество эмбрионов, рекомендованных к переносу, – 3 (1; 7). Всего 195 эмбрионов было отправлено на генетическое тестирование – 111/195 (56,9%) было рекомендовано к переносу, 13/195 (6,7%) составили мозаичные эмбрионы, перед переносом которых необходима консультация генетика. Остальные 71/195 (36,4%) были не рекомендованы к переносу в полость матки, из них у 53/71 (74,6%) были выявлены анеуплоидии: в 18/53 (33,96%) случаев это были трисомии, в 17/53 (32,08%) случаев – моносомии и в 18/53 (33,96%) – другие анеуплоидии. В 1/53 (1,4%) от всех не рекомендованных к переносу эмбрионов была обнаружена делеция хромосомы. Также 4 эмбриона были исключены из генетического тестирования в связи с отсутствием прохождения сигнала.
В группе пациенток с ПГТ-а количество наступивших беременностей составило 18/40 (45%), а в группе пациенток без ПГТ-а – 22/40 (55%), различие статистически незначимо (ОР 0,82 (95% ДИ 0,53–1,27); р=0,37). Частота наступления беременности в двух исследуемых группах статистически не различалась.
Не было выявлено статистически значимых различий в числе неразвивающихся беременностей между двумя группами (был зафиксирован только 1 случай в группе с ПГТ-а (1/40 (2,5%)), а также в числе биохимических беременностей (было зафиксировано 4 случая в группе без ПГТ-а (4/40 (10,0%)). В обеих группах не было зафиксировано ни одной эктопической беременности. Количество выкидышей в группе пациенток с ПГТ-а составило 3/40 (7,5%), в группе пациенток без ПГТ-а – 8/40 (20%) (ОР 0,38 (95% ДИ 0,08–1,31); р=0,10).
В группе пациенток с ПГТ-а количество беременностей, завершившихся родами, составило 14/40 (35%), а в группе пациенток без ПГТ-а – 10/40 (25%) (ОР 1,40 (95% ДИ 0,71–2,77); р=0,46).
При этом доля беременностей, завершившихся родами, от количества наступивших беременностей выше в группе с ПГТ-а – 14/18 (77,8%) по сравнению с группой без ПГТ-а – 10/22 (45,5%) (ОР 1,71 (95% ДИ 1,02–2,88); р=0,05) (0,05 двусторонний точный критерий Фишера или 0,04 односторонний точный критерий Фишера).
Обсуждение
Анализ результатов проведенного исследования не показал статистически значимых различий в количестве беременностей, завершившихся деторождением, между исследуемыми группами пациенток; тем не менее наблюдалась тенденция увеличения количества живорождений в группе с ПГТ-а, что является конечным результатом лечения.
Такие показатели, как частота биохимических беременностей и выкидышей также статистически не различались, однако имела место тенденция уменьшения указанных осложнений у пациенток после ПГТ-а эмбрионов.
Есть данные, что даже при переносе эуплоидного эмбриона у пациенток с СПКЯ и нормальной массой тела риск ранних репродуктивных потерь выше, чем у пациенток без СПКЯ [20], однако при проведении генетического тестирования риск выкидышей у пациенток с СПКЯ может быть снижен [19].
Несмотря на преимущества метода ПГТ-а, по данным литературы, биопсия только части трофэктодермы может не быть репрезентативной относительно всех клеток и внутриклеточной массы, поэтому проведение генетической диагностики не является гарантией переноса эуплоидной бластоцисты [21]. Это может объяснять относительно небольшой процент ранних репродуктивных потерь в группе пациенток после ПГТ-а.
Результаты недавнего исследования Li Y. et al. показали, что при СПКЯ хромосомные аномалии встречаются чаще на основании исследования ворсин хориона после репродуктивных потерь в программах ВРТ [22].
Также есть данные, что проведение ПГТ-а у пациенток с СПКЯ снижает риск невынашивания беременности и демонстрирует высокую частоту наступления клинической беременности [23].
Заключение
Таким образом, на основании полученных результатов можно сделать вывод, что применение ПГТ-а у пациенток с СПКЯ демонстрирует свою клиническую значимость, однако необходимы дальнейшие исследования на большей выборке пациенток, с изучением факторов эмбриологического этапа, а также исследования, учитывающие не только показатели успешности наступления беременности после программ переноса криоконсервированных/размороженных эмбрионов в полость матки и их эффективность у данной категории пациенток, но и акушерские, и перинатальные исходы.



