Известно, что различные внешние воздействия на материнский организм могут приводить к нарушению окислительно-восстановительных и биоэнергетических реакций, активации перекисного окисления, свободнорадикальных процессов, снижению уровня глутатиона в клетке и возникновению гипоксических состояний у матери, плода и потомства. Важнейшим патогенетическим звеном при действии гипоксии является нарушение энергетического обмена клетки и, в первую очередь, процессов окислительного фосфорилирования в дыхательной цепи митохондрий [1]. В последнее время внимание исследователей привлечено к изучению препаратов из группы естественных метаболитов, которые, наряду с прочим, могут обладать и антигипоксической активностью [2–4]. Очевидно, что восстановление и поддержание нормального энергетического метаболизма клетки при использовании препаратов с полифункциональным действием может не только облегчить общее состояние организма матери в гипоксических условиях, но и существенно снизить риск развития у потомства постгипоксических осложнений. К таким препаратам можно отнести синтезированный в МНПК «Биотики» естественный метаболит элтацин. Он содержит смесь заменимых аминокислот глицина, L-глутаминовой кислоты и L-цистина, обладает регуляторным действием на внутриклеточный пул глутатиона и глутатион-зависимых ферментов, нормализует окислительно-восстановительные процессы и использование кислорода в тканях. Фармакологическое действие препарата связано с избирательной индукцией синтеза глутатиона – одного из основных эндогенных антиоксидантов и кофакторов окислительно-восстановительных ферментов [5]. Элтацин зарекомендовал себя положительно при применении больными с хроническим обструктивным бронхитом, артериальной гипертензией, постинфарктным кардиосклерозом с явлениями хронической сердечной недостаточности. Наблюдалось снижение уровня перекисного окисления липидов и нормализация антиоксидантного статуса организма [6–8]. Ранее в экспериментальных исследованиях было показано, что препараты из группы естественных метаболитов лимонтар и глицин обладают антигипоксическими свойствами в системе мать-плод и могут с успехом использоваться в клинической практике [9, 10].
Учитывая, что метаболическая коррекция энергетических нарушений различного генеза может быть реализована при использовании препаратов, созданных на основе естественных метаболитов, целью настоящего исследования стало экспериментальное изучение элтацина по новым показаниям – в качестве средства профилактики и защиты организма матери, плода и потомства от гипоксических повреждений.
Материал и методы исследования
Экспериментальные исследования по изучению патофизиологических механизмов корригирующего действия элтацина в условиях кислородной недостаточности проведены на 66 неимбредных беременных самках белых крыс массой 250–300 г, 60 плодах и 93 потомках 1-го поколения. Животные были распределены на 2 группы. 1-ю группу составили самки, которым per os вводили водный раствор элтацина в дозе 6 мг/кг с 16 по 20-й дни беременности, ежедневно; 2-я группа служила контролем и получала в те же сроки в эквиобъемном количестве дистиллированную воду.
Исследование антигипоксического влияния элтацина на функционально-метаболическое состояние миокарда в условиях гипоксии выполнено на модели перфузируемого сердца беременных крыс [11]. Для этого на 20-й день гестации часть животных (по 12 крыс в группе) подвергали эвтаназии, извлекали сердце и перфузировали его по методу Лангендорфа [12]. Перфузионный раствор оксигенировали нормоксической (95% О2+5% СО2) и гипоксической (20% О2+75% N2 + 5% СО2) газовыми смесями. Гипоксическое состояние моделировали после стабилизации исследуемых физиологических параметров сердца (через 30 мин после начала перфузии). Этот момент принимали за нулевую точку отсчета и регистрировали частоту и силу сердечных сокращений. Величину «работы», совершаемой сердцем, вычисляли как произведение частоты и силы сердечных сокращений. Скорость потребления кислорода изолированным сердцем определяли полярографически [13].
У второй части животных (12 самок) исследовали индивидуальную резистентность к острой гипоксической (высотной) гипоксии по методу, предложенному Пьюшоттем и Хош [14]. Крыс помещали в приточно-вытяжную барокамеру и моделировали подъем на «высоту» 11 000 м. Измеряли время от момента достижения указанной «высоты» до появления у крыс второго агонального вдоха, так называемое резервное время (РВ), являющееся критерием устойчивости организма к гипоксии. По результатам тестирования животных разделяли на три группы: 1) РВ <3 2="" 3="" 10="" 3="">10 мин – высокоустойчивые. Самок тестировали на 20-й день беременности и оставляли для получения потомства. Резистентность потомства к гипоксии определяли с 1-го по 60-й дни жизни тем же методом, что и их матерей.

Кроме этого, на модели аноксии изолированного плода исследовали состояние компенсаторно-защитных механизмов, после введения элтацина самкам в плодный период беременности, по сравнению с контролем (12 самок). Для этого из каждого рога матки крысы под общим комбинированным наркозом извлекали по одному плоду и после перевязки пуповины и наложения проникающих электродов до первого вдоха помещали в изотонический раствор с постоянной температурой (37,4°С). О функциональном состоянии изолированных плодов судили по частоте сердечных сокращений (ЧСС), числу дыхательных движений, времени наступления глубокой гипоксии (ЧСС=50 уд./мин), а также по времени переживания биопотенциалов сердца плода (до изолинии на ЭКГ). В отдельных опытах у части крыс (18 самок) создавали модель хронической гемической гипоксии и развившегося, как следствие, постгеморрагического состояния, путем дробного забора крови из подъязычных вен на 15, 17 и 19-й дни гестации в общем объеме 30% от объема циркулирующей крови. Элтацин вводили per os с 16-го по 20-й дни беременности в дозе 6 мг/кг.
На 20-й день (также как в опытах без хронической гемической гипоксии) моделировали аноксию изолированного плода. Регистрацию всех исследуемых параметров проводили на электроэнцефалографе. Результаты обрабатывали статистически с использованием критерия t Стьюдента.
Результаты исследования и обсуждение
Результаты исследования физиологических параметров перфузируемого сердца животных в условиях гипоксии, которым вводили элтацин с 16-го по 20-й день беременности, показали, что препарат обладает высокой антигипоксической активностью (табл. 1).
Поскольку «работа» сердца является интегративным показателем, отражающим степень энергизации миокарда, то ее увеличение под влиянием элтацина характеризует энергизирующее действие последнего. Однако указанный эффект препарата, в отличие от действия известных антигипоксантов, не сопровождался увеличением потребления кислорода гипоксическим миокардом – уровень «работы» сердца у крыс в гипоксических условиях после введения элтацина был в 2–3 раза выше, чем у контрольных животных, что свидетельствует о повышении эффективности АТФ-синтезирующих систем. Механизм антигипоксического действия элтацина, по-видимому, заключается в снижении индуцируемым им эндогенным глутатионом гипервосстановленности начального участка дыхательной цепи и восстановлении тем самым способности образования АТФ в первом пункте окислительного фосфорилирования. При этом поток электронов с начального участка дыхательной цепи не направляется к ее терминальным отделам, а используется в специфических для глутатиона реакциях, таких как пероксидазные или глутатион S-трансферазные реакции восстановления гидроперекисей, содержание которых возрастает при гипоксии.
В результате тестирования беременных животных по степени индивидуальной резистентности к острой гипоксии было установлено, что после введения элтацина среднее резервное время крыс заметно превышало уровень контрольных животных и составило соответственно: 8,9±0,9 мин и 5,7±0,6 мин (Р<0,05). Число низкоустойчивых особей в этой группе снижалось вдвое, а высокоустойчивых возросло в 2,5 раза.
Исследование индивидуальных реакций изолированных плодов показало, что препарат элтацин, введенный в плодный период беременности, не оказывал отрицательного влияния и даже несколько улучшал показатели, характеризующие функциональное состояние плодов и их компенсаторно-защитные механизмы в условиях аноксии по сравнению с плодами контрольной группы животных. Время переживания биопотенциалов сердца плодов крыс, получавших элтацин составило 52,6±1,3 мин, в контроле – 47,2±1,2 мин, Р<0,05. Остальные показатели также были выше, чем в контроле, но статистически достоверно от него не отличались. В то же время при хронической гемической гипоксии матери антигипоксические свойства элтацина в отношении организма плода были более выражены, чем в предыдущем эксперименте (табл. 2). После кровопотери у матери на фоне введения препарата происходило выравнивание гомеостаза плодов и повышение их компенсаторно-защитных возможностей с приближением исследованных показателей к показателям плодов контрольных животных. Об этом свидетельствовало увеличение времени до появления аритмий сердечного цикла, глубокой гипоксии и времени переживания организма
Полученные данные указывают на то, что под влиянием препарата организм самки, по-видимому, берет на себя защиту плодов, активизируя их компенсаторно-защитные реакции, предположительно путем триггерного эффекта за счет усиления окислительно-восстановительных процессов в условиях постгеморрагического состояния.
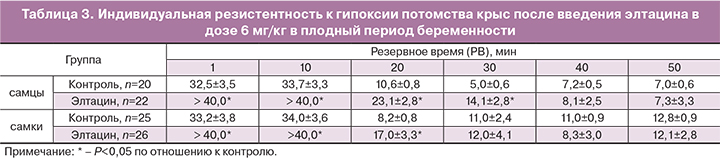
Исследование индивидуальной резистентности потомства крыс к острой гипоксии, путем «подъема на высоту» показало, что новорожденные животные обладают повышенной устойчивостью к кислородной недостаточности, которая сохраняется весь период вскармливания – с 1-х по 16-е сутки (табл. 3). В период отъема (для крыс с 16-х по 20-е дни жизни), когда материнское молоко начинает постепенно замещаться обычной (богатой углеводами) пищей, происходит значительное снижение устойчивости организма крысят к гипоксии. Это проявлялось в резком многократном уменьшении резервного времени у животных контрольной группы. Подобное явление можно объяснить все большей зависимостью их энергетического обмена от окисления углеводов и, связанной с этим, относительной физиологической нестабильностью организма. Наименьший уровень резистентности к гипоксии наблюдался у контрольных крысят-самок на 20-й, а у крысят-самцов – на 30-й день жизни (критические дни периода отъема). После такого снижения резистентности организма к дефициту кислорода происходит постепенное плавное ее повышение, так что к 60-му дню она достигает уровня, характерного для взрослых животных (самцы – 8,5±0,6 мин; самки –
13,4±1,0 мин; взрослые соответственно 8,6±0,8 мин и 15,8±0,7 мин). Введение элтацина беременным животным значительно повышало устойчивость потомства к гипоксии по сравнению с контрольными крысятами (табл. 3). Молодые крысята, даже в период относительной физиологической нестабильности, имели достаточно высокую резистентность к гипоксии. У крысят-самцов повышенная устойчивость к гипоксии под влиянием элтацина сохраняется на протяжении всего периода постнатального развития и к 60-му дню жизни становится равной контрольному уровню взрослых животных. По-видимому, элтацин, вводимый самке в последней трети беременности (когда она имеет минимальную защищенность от гипоксии), стимулирует и у нее, и в организме плода развитие адаптационно-компенсаторных механизмов, направленных на повышение устойчивости к гипоксическому воздействию.
Эти защитные механизмы продолжают активно действовать и в послеродовом периоде, особенно в периоды перинатального и ближайшего постнатального развития, когда вероятность гипоксического поражения особенно велика.
Заключение
Таким образом, результаты, полученные в модельных экспериментах, показали, что элтацин при введении per os крысам в дозе 6 мг/кг в плодный период беременности обладает выраженным антигипоксическим действием в отношении материнского организма, плода и потомства при дефиците кислорода. Это делает его перспективным для использования в акушерской практике в комплексной терапии и профилактике гипоксических состояний в качестве антигипоксанта энергизирующего действия.



