В последние десятилетия протоколы с антагонистами гонадотропин рилизинг гормона (ГнРГ) становятся все более популярными для контролируемой стимуляции яичников. В исследованиях убедительно показаны преимущества использования этих препаратов [1–3]. Отсутствие неблагоприятных побочных эффектов, небольшая продолжительность лечения, меньший расход гонадотропина и низкий риск синдрома гиперстимуляции яичников делают эти препараты привлекательными для лечения пациенток с бесплодием. Однако, несмотря на большую безопасность антагонистов ГнРГ, снижение частоты наступления беременности, выявленное во многих исследованиях, препятствовало их внедрению в клиническую практику на протяжении многих лет [1–3].
Считается, что одной из основных причин снижения частоты наступления беременности в протоколах с антагонистом ГнРГ является отсутствие оптимальных условий для стимуляции яичников [4]. Неоднократно было показано, что высокие концентрации эстрадиола, прогестерона и ЛГ в начале стимуляции неблагоприятно сказываются на качестве получаемых ооцитов и, соответственно, на частоте имплантации и частоте наступления беременности [5]. В связи с этим в настоящее время ведется активный поиск эффективных методов программирования индуцированного цикла с антагонистами ГнРГ с целью оптимизации созревания фолликулярного пула в цикле стимуляции суперовуляции, а также предотвращения возникновения преждевременного пика ЛГ [6–10].
В течение многих лет для планирования циклов ЭКО использовались только комбинированные оральные контрацептивы (КОК) и синтетические прогестагены [11–14]. Эстрогены оказывают ингибирующее действие на секрецию ФСГ, тогда как гестагены в основном участвуют в контроле секреции ЛГ. В нескольких исследованиях изучалась роль предварительной терапии КОК перед началом стимуляции функции яичников. Полученные результаты оказались противоречивыми с точки зрения частоты наступления беременности [15–17]. В недавнем мета-анализе, который подвел итоги 6 рандомизированных контролируемых испытаний, установлено, что частота наступления беременности у пациенток с нормальным ответом на стимуляцию существенно ниже при назначении КОК в цикле перед программой ЭКО [16]. Полученные результаты обусловлены негативным воздействием гестагенного компонента КОК на эндометрий, а также снижением уровня ЛГ, что приводит к ухудшению качества полученных ооцитов и рецептивности эндометрия. Кроме того, предполагается, что предварительное лечение КОК приводит к значительному подавлению секреции ЛГ и ухудшению фолликулогенеза в последующих циклах ЭКО [18–20].
В то же время, в исследовании, проведенном E.E. Hauzman и A. Zapata (2013), в котором был использован только один тип КОК в течение 14 дней менструального цикла перед ЭКО, не было выявлено каких-либо существенных различий в частоте наступления беременности и показателях живорождения [6].
Использование оральных эстрогенов с середины лютеиновой фазы цикла, предшествующего стимуляции яичников, было предложено не так давно в целях программирования индуцированного цикла на основе ингибирующего эффекта эстрадиола на рост фолликула по механизму отрицательной обратной связи. Впервые эффективность назначения 17β-эстрадиола перед проведением процедуры ЭКО по протоколу с антагонистом ГнРГ была изучена R. Fanchin и соавт. (2003). Авторы предположили, что эстрадиол может способствовать синхронизации роста антральных фолликулов, что увеличит количество полученных ооцитов у пациенток с «бедным» ответом на стимуляцию [21].
В крупном рандомизированном исследовании, проведенном Cedrin-Durnerin и A. Guivarc’h-Leveque (2012), в период с 2006 по 2010 год, было проведено сравнение эффективности назначения 17β-эстрадиола в дозе 4 мг/сутки в течение 7 дней до начала менструации [22]. Стимуляция овуляции начиналась через 1 день после отмены 17β-эстрадиола (на 2-й день менструации). Статистически значимых различий в количестве полученных ооцитов и эмбрионов получено не было. Авторы пришли к выводу, что предварительная терапия эстрогенами ассоциирована с необходимостью введения более высоких доз ФСГ и большей продолжительностью стимуляции без существенного увеличения количества полученных ооцитов. По мнению E.E. Hauzman и A. Zapata (2013), полученные результаты обусловлены тем, что интервал между отменой эстрогена и началом стимуляции овуляции был слишком коротким, что привело к значительному подавлению секреции ФСГ [6]. Этими авторами было проведено исследование с участием 100 пациенток, которым рандомизированно назначались КОК и эстрадиола валерат перед проведением процедуры ЭКО по протоколу с антагонистом ГнРГ. В обеих группах стимуляция овуляции была начата через 5 дней после отмены препаратов для синхронизации эндогенных и экзогенных раздражителей ФСГ. Полученные результаты не были статистически значимо различимы в отношении исходов между обеими группами, что обусловлено малым размером выборки. Тем не менее, это первое исследование, в котором непосредственно сравнивались 2 метода планирования цикла ЭКО с антагонистом ГнРГ [6].
В настоящее время одним из наиболее обсуждаемых альтернативных подходов является кратковременное назначение антагониста ГнРГ в раннюю фолликулярную фазу до начала гонадотропной стимуляции функции яичников. Предполагается, что быстрое подавление секреции гонадотропных гормонов приводит к снижению продукции половых гормонов, что способствует синхронизации роста фолликулов перед началом стимуляции яичников [9, 10].
В пилотном исследовании, проведенном C. Blockeel и A. Riva (2011) [10], было показано, что назначение антагониста ГнРГ со 2-го по 4-й день цикла приводит к увеличению показателей имплантации – 26,5% [95% ДИ, 17,1–35,9], частоты наступления беременности на цикл – 39,7% [95% ДИ, 30,1–50,8] и на перенос эмбриона – 42,4% [95% ДИ, 32,3–53,1].
Сходные результаты были получены и рандомизированном исследовании, проведенном J.S. Younis и S. Soltsman (2010). Авторами показано, что назначение антагониста ГнРГ в раннюю фолликулярную фазу с 1-го по 3-й день цикла приводит к значительному улучшению показателей мейотического деления и оплодотворения полученных ооцитов [9]. Кумулятивный показатель зрелых ооцитов в этом исследовании был значительно выше в основной группе по сравнению с контрольной (93 и 85% соответственно); оплодотворение клеток было достигнуто в 85 и 69% в основной и контрольной группах соответственно. С другой стороны, было отмечено увеличение продолжительности лечения и дозы рекомбинантного ФСГ в среднем до 300 МЕ. Авторы также считают, что модификация цикла привела к оптимизации фолликулярного рекрутинга. Кроме того, в начале фолликулярной фазы уровень ЛГ значительно снизился и сохранялся таким на протяжении всей фазы. Однако в этом исследовании не было продемонстрировано значительного увеличения частоты наступления беременности, что, возможно, обусловлено небольшой выборкой пациенток [9].
В проведенных к настоящему времени исследованиях получены противоречивые и неоднозначные результаты, что диктует необходимость проведения дальнейших исследований.
Целью данного исследования стало изучение эффективности программирования индуцированного цикла с использованием КОК, эстрогенов и антагонистов ГнРГ.
Материал и методы исследования
В исследовании приняли участие 135 женщин, которым проводились программы ЭКО/ИКСИ в протоколах с антагонистом ГнРГ на базе НЦАГиП им В.И. Кулакова Минздрава России. Критериями включения были: возраст 18–35 лет, регулярный менструальный цикл (26–30 дней), индекс массы тела (ИМТ) <30 кг/м2, базальный уровень гормонов в сыворотке крови – ФСГ не более 10 МЕ/л, АМГ >1,0 нг/мл), не более 3 попыток ЭКО/ИКСИ в анамнезе. Критерии исключения: наличие наружного и внутреннего эндометриоза 3–4-й степени распространения, интерстициальной и субсерозной миомы матки размером более 4 см, гидросальпинкса и/или тубоовариального образования по данным ультразвукового исследования органов малого таза; пороков развития внутренних половых органов; патозооспермии 3–4-й степени у супруга; соматических заболеваний, являющихся противопоказаниями для вынашивания беременности и родов.
Отобранные для исследования пациентки были разделены методом случайных чисел на три группы:
- I группа – 45 пациенток, которым с целью синхронизации созревания фолликулов перед вступлением в протокол стимуляции яичников с антагонистами ГнРГ назначались КОК (этинилэстрадиол 0,03 мг/дезогестрел 0,15 мг) в режиме 14 дней с первого дня менструального цикла. Стимуляция функции яичников начиналась на 5-й день отмены контрацептивов;
- II группа – 45 пациенток, которым с 25-го дня предыдущего цикла перед стимуляцией функции яичников по протоколу с антагонистами ГнРГ назначались эстрогены (эстрадиола валерат 4 мг) и отменены за день до начала стимуляции;
- III группа – 45 пациенток, которым были назначены антагонисты ГнРГ в раннюю фолликулярную фазу (со 2-го дня цикла) с последующим переходом к стандартной стимуляции гонадотропинами по фиксированному протоколу с антагонистами ГнРГ с 5-го дня цикла.
Со 2-го дня менструального цикла и до дня введения триггера овуляции всем пациенткам вводили препараты рекомбинантного ФСГ или человеческого менопаузального гонадотропина.
Подбор стартовой дозы осуществлялся по стандартной схеме, исходя из возраста женщины и параметров овариального резерва (базальной концентрации ФСГ, эстрадиола, уровня АМГ, числа антральных фолликулов в яичниках). Максимальная стартовая доза не превышала 300 МЕ/день. При достижении фолликулами диаметра 14 мм для предотвращения преждевременного пика ЛГ пациенткам вводился антагонист ГнРГ. Триггер овуляции вводился при наличии в яичниках ≥3 фолликулов диаметром ≥17 мм. В качестве триггера овуляции использовался человеческий хорионический гонадотропин в дозе 10 000 МЕ. Трансвагинальная пункция выполнялась через 35–36 часов после введения триггера овуляции.
В качестве метода оплодотворения яйцеклеток применялись как ЭКО, так и ИКСИ. Культивирование эмбрионов производилось в атмосфере сниженной концентрации кислорода на последовательных средах компании «Origio» (Дания). Перенос эмбрионов осуществлялся на 3-и и 5-е сутки культивирования. Количество эмбрионов на перенос не превышало двух. Перенос производился под ультразвуковым контролем.
Поддержка лютеиновой фазы индуцированного цикла у всех пациенток проводилась по стандартному протоколу: натуральный микронизированный прогестерон в дозе 600 мг/день с 1-х суток после трансвагинальной пункции яичников.
Исследование было одобрено этическим комитетом, у всех пациентов получено письменное информированное согласие.
Статистическую обработку данных производили общепринятыми методами вариационной статистики. Данные представлены как средние ± среднеквадратическое отклонение (М±Σ). Значимость наблюдаемых отклонений оценивали с помощью пакета статистического анализа SPSS 17.0 Statistics. Критерий Краскела–Уоллеса считали значимым при значении менее 0,05.
Результаты исследования
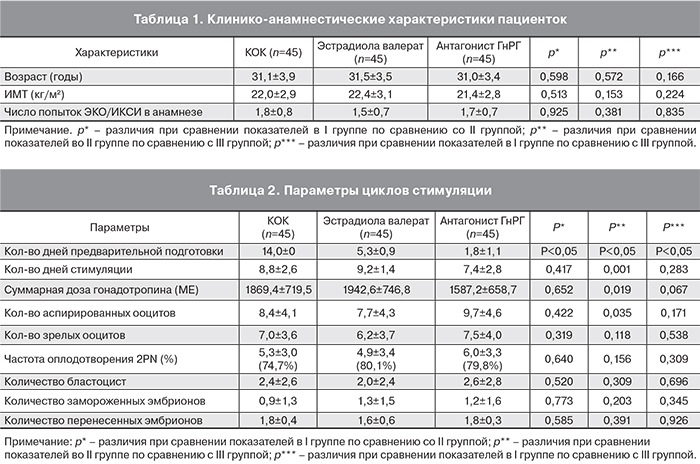
Как показано в табл. 1, все три группы пациентов были сопоставимы по возрасту, ИМТ, числу проведенных ранее программам ЭКО/ИКСИ.
Также были проанализированы параметры циклов стимуляции (табл. 2). Из-за различных схем использованной предварительной подготовки количество дней, предшествующих стимуляции яичников было значительно больше в I группе по сравнению с II и III группами (14,0±0; 5,3±0,9; 1,8±1,1; р<0,05). Выявлена достоверно значимая разница в продолжительности стимуляции (p=0,001) и количестве использованного гонадотропина между II и III группами (р=0,019).
При анализе эмбриологических показателей (табл. 2), таких как количество аспирированных ооцитов, количество зрелых ооцитов, частота оплодотворения (2PN), частота бластуляции, количество замороженных эмбрионов и количество перенесенных эмбрионов статистически достоверных различий между I и II группами не обнаружено. Однако количество аспирированных ооцитов статистически достоверно выше во II группе в сравнении с III группой.
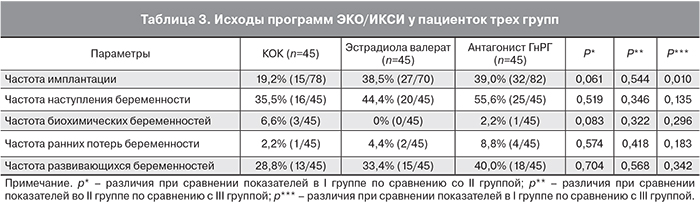
Был проведен сравнительный анализ исходов программ ЭКО/ИКСИ у пациенток трех групп (табл. 3). Выявлено, что в группе, в которой в качестве предварительной подготовки использовался КОК, частота имплантации составила 19,2%, тогда как в группе с антагонистом ГнРГ – 39% (разница статистически значима). Частота имплантации в группе с эстрадиола валератом – 38,5% (р>0,05). В то же время анализ частоты наступления беременности на перенос статистически достоверных различий между группами не показал (р>0,05). Частота наступления клинической беременности в I группе – 30,2%, во II группе – 34,0%, в III группе – 40,0% (р>0,05). В I и III группах были отмечены случаи наступления биохимических беременностей (6,9 и 2,2% соответственно, р>0,05). Частота ранних репродуктивных потерь в группе с КОК составила 2,3%, в группе с эстрадиола валератом – 4,5%, в группе с антагонистом ГнРГ – 8,8%, что статистически не значимо.
Обсуждение
Полученные нами результаты существенных различий между использованием в качестве предварительной подготовки КОК, эстрадиола валерата и антагониста ГнРГ не выявили. В нашем исследовании мы так же, как в исследовании Cédrin-Durnerin и соавт. (2007), показали значительно более высокую потребность в гонадотропинах и большую продолжительность стимуляции в протоколах, где в качестве предварительной подготовки использовались эстрогены. Однако эстрогены не оказывают влияния на исход цикла и, следовательно, могут быть использованы в клинической практике [23]. В более позднем исследовании та же группа авторов предложила гипотезу о том, что в увеличении дозы гонадотропина в циклах с эстрадиола валератом по сравнению с циклами с другими подготовками, главную роль играет короткий однодневный перерыв между отменой препарата и началом стимуляции функции яичников [22]. Исследований с более длинным промежутком не проводилось.
Нами были получены результаты, сходные с результатами исследования, проведенного J.S. Younis и S. Soltsman (2010), где было показано, что назначение антагониста ГнРГ в раннюю фолликулярную фазу с 1-й по 3-й день цикла приводит к значительному улучшению показателей оо- и эмбриогенеза. С другой стороны, было отмечено увеличение продолжительности лечения и дозы гонадотропина. Авторы также считают, что модификация цикла привела к синхронизации фолликулярного пула. Однако в их исследовании не было продемонстрировано значительного увеличения частоты наступления беременности, что, возможно, обусловлено небольшой выборкой пациенток [9].
Наши данные отличаются от результатов, полученных G. Griesinger и соавт. (2008), где отмечено снижение количества зрелых ооцитов, что, возможно, связано с применением КОК в течение 21 дня, а не 14 дней, как в нашем исследовании. Однако снижение клинических результатов отмечено как в работе указанных авторов, так и в нашей [16].
Заключение
Таким образом, все три изученные схемы предварительной подготовки к стимуляции в программах ЭКО в протоколах с антагонистом ГнРГ были эффективны в отношении полученных клинических результатов. Программы с предварительной подготовкой эстрогенами и антагонистом ГнРГ имели практически идентичные показатели по количеству дней стимуляции, суммарной дозе введенных гонадотропинов, наступлению беременности и имплантации эмбрионов. Между тем, подготовка с антагонистом ГнРГ оказалась значимо эффективнее в отношении частоты наступления беременности и имплантации эмбрионов по сравнению с группой, в которой применялась подготовка КОК.



