Распространенность хронического эндометрита (ХЭ) у пациенток с повторными неудачами имплантации, по данным разных авторов, колеблется в диапазоне 15–42% случаев [1]. По результатам гистероскопии ХЭ диагностируется у 57,8% женщин с тремя потерями беременности и более [2]. Фактически ХЭ является заболеванием, которое нельзя игнорировать в контексте выполнения вспомогательных репродуктивных технологий [3].
На сегодняшний день трудно опровергнуть тот факт, что именно микробные агенты выступают спусковым механизмом или являются наиболее значимым модулирующим фактором иммунных, гормональных, гемостазиологических нарушений, влияющих на нормальное функционирование тканей эндометрия. Однако контаминация полости матки микробными агентами не всегда и не у всех пациенток приводит к развитию воспалительной реакции, в связи с чем до настоящего времени нет понимания, какие микробные агенты в данной экологической нише являются комменсалами, резидентами или патогенами [4]. Более того, до 75% всех инфекций человека протекает с формированием биопленок, что часто ведет к хронизации воспалительного процесса, рецидивированию заболевания, развитию осложнений [5].
Полагают, что формирование и персистенция биопленок играют существенную роль в патогенезе целого ряда инфекционных заболеваний, включая ХЭ [6]. Swidsinski A. et al. продемонстрировали, что у половины женщин, страдающих бактериальным вагинозом, в эндометрии обнаруживалась полимикробная биопленка [7]. Поиск и разработка технологий, с помощью которых можно воздействовать на бактерии в биопленке либо напрямую, либо путем обеспечения доступа к бактериям антибиотиков, являются чрезвычайно актуальными задачами [8].
Целью нашего исследования явилась оценка эффективности применения естественного комплекса природных противомикробных пептидов и цитокинов (препарат «Суперлимф») в комплексном лечении ХЭ у пациенток с бесплодием.
Материалы и методы
Общий дизайн исследования
С апреля 2020 г. по июнь 2021 г. включительно проведено проспективное (n=64) рандомизированное плацебо-контролируемое ослепленное исследование по оценке эффективности применения естественного комплекса природных противомикробных пептидов и цитокинов (препарат «Суперлимф», суппозитории вагинальные и ректальные, 25 ЕД) в комплексном лечении ХЭ у пациенток с бесплодием. В исследование были включены 64 пациентки репродуктивного возраста (от 28 до 37 лет, средний возраст 31,88±2,65 года), соответствующие критериям включения и не имеющие критериев невключения. Все включенные в исследование женщины имели диагноз «хронический эндометрит», установленный на основании иммуногистохимического и морфологического методов не ранее чем за 6 месяцев до включения в исследование. При включении в исследование на этапе скрининга проводилось исследование микробиоты эндометрия. После завершения лечения через 1 месяц повторно оценивали микробиоту полости матки пациенток и проводили гистологическое и иммуногистохимическое исследование биоптатов эндометрия, при этом забор материала из полости матки до и после лечения проводили на 19–21-й день менструального цикла.
Критерии включения в исследование: возраст пациентки от 20 до 38 лет в момент включения в протокол; диагноз бесплодия, выставленный в течение не менее одного года до включения в исследование; морфологически и иммуногистохимически подтвержденный ХЭ; наличие беременности и родов в анамнезе; подписание письменного информированного согласия на участие в исследовании.
Критерии невключения в исследование: возраст пациентки моложе 20 лет и старше 38 лет; менее 36 месяцев после родов, аборта или завершения лактации в момент начала прохождения обследования; наличие любого значимого гинекологического заболевания, требующего лечения; наличие хронического болевого синдрома; наличие злокачественных новообразований любой локализации, в том числе и в анамнезе; наличие сахарного диабета или любых других эндокринных заболеваний за исключением аутоиммунного тиреоидита, требующих назначения системной терапии и/или хирургического лечения; индекс массы тела (по Кетле) более 34,9 кг/м2 в момент включения в исследование; положительные результаты анализа на поверхностный антиген вируса гепатита В (HBsAg), антитела к вирусу гепатита С и антитела к ВИЧ-1/2; наличие психиатрических заболеваний, избыточное потребление алкоголя или психотропных веществ в анамнезе; любое состояние организма, которое, по заключению исследователя, может повлиять на прохождение процедур протокола и других мероприятий в рамках исследования.
Критерии исключения из исследования: наступление беременности во время проведения исследования; наличие любого значимого клинического события, которое способно отразиться на данных исследования; отзыв информированного согласия.
Данные включенных в исследование пациенток представлены в таблице 1.
Селекция и рандомизация пациенток, назначение лечения
Рандомизация проводилась после подписания информированного согласия методом закрытых конвертов с учетом критериев включения и исключения. Все женщины получали противомикробную химиотерапию доксициклина моногидратом по 100 мг 2 раза в сутки 10 дней. При необходимости после курса доксициклина назначалась антимикотическая терапия: флуконазол 150 мг однократно или двукратно (с интервалом 2 суток). Пациентки основной группы (n=32) одновременно с началом противомикробной химиотерапии получали препарат «Суперлимф» ректально в виде суппозиториев по 25 ЕД 1 раз в день в течение 20 дней вне зависимости от дня менструального цикла, при этом через 21–24 дня курс лечения иммуномодулятором повторяли. Пациентки группы сравнения (n=32) получали свечи плацебо в аналогичном для препарата «Суперлимф» режиме.
Объем обследования пациенток
Забор материала для исследования
Исследовали эндометрий, полученный при помощи эндобраш (Endobrash Standard For Endometrial Cytology; Laboratorie C.C.D., Франция) до и после лечения. Этап выделения ДНК из полученного биоматериала проводили с использованием комплекта реагентов «ДНК-сорб-АМ» (ООО «НекстБио», Москва, Россия), для постановки реакции амплификации нуклеиновых кислот использовали детектирующие амплификаторы DT-96 и DTprime (ООО «НПО ДНК-Технология», Россия).
Молекулярно-генетические исследования
Молекулярно-генетическое исследование микробиоты в эндометриальном биоптате проводили с использованием модифицированного мультиплексного теста на основе ПЦР в режиме реального времени («ДНК-Технология», Москва), который позволяет определить количество ДНК искомого микроорганизма в образце, выражаемое в геномных эквивалентах (ГЭ). Количество ГЭ пропорционально количеству клеток микроорганизма. С помощью данного теста детектировали общую концентрацию бактериальной ДНК, соответствующую общей бактериальной массе (ОБМ), а также концентрацию (абсолютную и относительную) следующих групп микроорганизмов: Lactobacillus spp., Enterobacteriaceae, Streptococcus spp., Staphylococcus spp., Gardnerella vaginalis, Eubacterium, Sneathia/Leptotrichia/Fusobacterium, Megasphaera/Veillonella/Dialister, Lachnobacterium spp./Clostridium, Mobiluncus spp./Corynebacterium, Peptostreptococcus, Atopobium vaginae. Кроме того, оценивали абсолютную концентрацию Mycoplasma hominis, Ureaplasma spp. и грибов рода Candida. Также с помощью подобной методики проводилась идентификация патогенных бактерий (Neisseria gonorrhoeae), простейших (Trichomonas vaginalis), внутриклеточных агентов (Chlamydia trachomatis, Mycoplasma genitalium) и вирусов (вирус простого герпеса 1/2 типа (HSV1/2), цитомегаловирус (CMV), вирус герпеса человека 6 типа (HHV-6A), вирус Эпштейна–Барр (EBV)). Вирус папилломы человека определяли системой КВАНТ-21 («ДНК-Технология», Москва), выявляющей методом ПЦР в реальном времени ВПЧ высокого (16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82 типы) и низкого (6, 11, 44 типы) онкогенного риска с определением вирусной нагрузки. Определялись как абсолютный – количество копий ДНК ВПЧ в образце, так и относительный результат – количество копий ДНК ВПЧ на количество геномной ДНК человека, т.е. с учетом контроля взятия материала.
Гистологическое и иммуногистохимическое исследования
На этапе селекции у всех пациенток морфологически верифицирован ХЭ. Гистологическое исследование проводили по классической методике на микроскопе Olympus CX31 (Япония) при увеличении ×100, ×400. Для обзорной окраски использовали гематоксилин и эозин. Иммуногистохимическое исследование (ИГХ) проводили на парафиновых срезах, использовали стандартный одноэтапный протокол с использованием первичных антител в стандартных разведениях к провоспалительным маркерам (СD8+, СD20+, СD4+, СD138+) фирмы Dako Cytomation (Дания). Степень выраженности ХЭ определяли по совокупности гистологического и иммуногистохимического исследований (фибропластические изменения, склероз сосудов, мононуклеарная инфильтрация в строме) и количественной оценке комбинации антител цитотоксических Т-лимфоцитов (CD8+), В-лимфоцитов (CD20+), Т-хелперов (CD4+), плазмоцитов (CD138+) по шкале, разработанной Толибовой Г.Х. и соавт. [9].
Статистический анализ
Качественные признаки представлены в виде абсолютных (количество) и относительных (удельный вес/частота, в %) данных, количественные ‒ в зависимости от варианта распределения признака (по W-критерию Шапиро–Уилка) в виде среднего значения ± стандартное отклонение (нормальное распределение) или в виде медианы с границами 25% и 75% перцентиля (отличное от нормального распределение). Значимость различий проверяли в зависимости от вида распределения с использованием t-теста Стьюдента или U-критерия Манна−Уитни соответственно. Соотношение частот при расщеплении признаков в группах проводили с использованием критерия хи-квадрат Пирсона (χ2). Критический уровень значимости нулевой статистической гипотезы (об отсутствии значимых различий или факторных влияний) принимали равным 0,05.
Этические правила и нормы
Исследование выполнено в полном соответствии с принципами Хельсинкской декларации Всемирной ассоциации «Этические принципы научных и медицинских исследований с участием человека», действующими Порядками и Стандартами оказания медицинской помощи и другими регуляторными требованиями к проведению клинических исследований и наблюдательных программ в Российской Федерации. Соотношение пользы и рисков от введения в сравнительное исследование плацебо локальным Этическим комитетом расценено как совокупная польза для участниц исследования, заключающаяся в комплексной диагностике заболевания и назначении противомикробных препаратов.
Результаты
При анализе микробиоты в полости матки у пациенток с ХЭ до лечения следует отметить, что только в 6 (9,23%) образцах эндометрия не было выявлено никаких микроорганизмов. Ни в одном из образцов не были выявлены такие микроорганизмы, как Trichomonas vaginalis, Neisseria gonorrhoeae, Chlamydia trachomatis, HSV-1/2, CMV, EBV, HHV-6. Только лактобациллы были обнаружены в 6/64 (9,23%) пробах эндометрия, а сочетание лактобацилл и бифидобактерий определялось только в 1 пробе (1,54%). В остальных пробах (n=51) было выявлено от 1 (у 13 женщин, 20,3%) до 10 (у 1 женщины, 1,56%) микробных агентов (табл. 2). Несколько микроорганизмов (более 4) было выявлено в полости матки в 17 пробах женщин до лечения (26,15%).
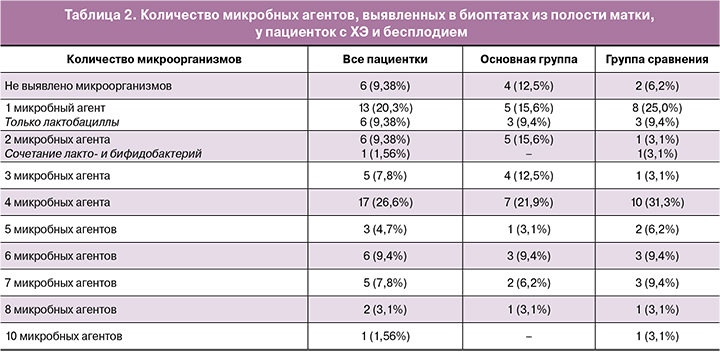
Наиболее часто до лечения в полости матки выявляли Streptococcus spp. − в 88%. Кроме того, у женщин с ХЭ в полости матки выявляли микроорганизмы семейства Bacteroides spp., а также Enterobacteriaceae, Gardnerella vaginalis и Staphyloсoccus spp. в 56, 74, 48 и 26% соответственно.
В таблице 3 представлены данные по частоте обнаружения микроорганизмов в полости матки до и после лечения с использованием препарата «Суперлимф».
Как видно из представленных данных, у пациенток с ХЭ частота обнаружения Streptococcus spp. после лечения составила 26,6%, Bacteroides spp. – 7,8%, бактерий семейства Enterobacteriaceae – 30%, Gardnerella vaginalis – 11%, Staphyloсoccus spp. – 7,8% соответственно.
Элиминация микроорганизмов в полости матки женщин с хроническим эндометритом и бесплодием после лечения в основной группе и группе сравнения представлена на рисунке 1.
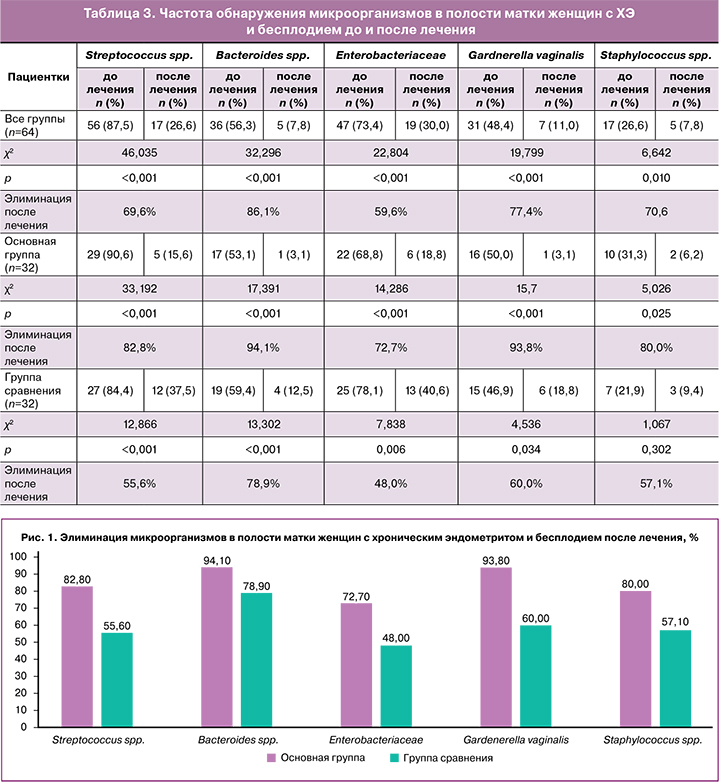
При селекции пациентов в клиническое исследование гистологическое исследование биоптатов эндометрия на 19–22-й день цикла у обследованных пациенток выявило раннюю стадию фазы секреции с наличием диффузной равномерной субнуклеарной вакуолизацией желез и слабо выраженным развитием цитоплазмы в фибробластах стромы у 14 (21,9%) женщин. Средняя стадия фазы секреции характеризовалась извитыми железами с базально расположенными светлыми ядрами в железах эндометрия и хорошо выраженной цитоплазмой в клетках стромы, клубки спиральных артерий крупные, достигающие люминального эпителия у 23 (35,9%) пациенток. Слабо секреторная трансформация эндометрия с отставанием в развитии стромального компонента отмечена у 27 (42,2%) женщин. Наличие мононуклеарной инфильтрации, фибропластических изменений стромального компонента верифицировано в 26 (40,6%) случаях. В 9 (14,1%) случаях отмечены наличие перигландулярного фиброза, склероз сосудистой стенки спиральных артерий и полиморфных фолликулоподобных мононуклеарных инфильтратов. При ИГХ-исследовании эндометрия в 43 (67,2%) случаях верифицирован выраженный ХЭ с 5-кратным увеличением цитотоксических Т-лимфоцитов (CD8+), B-лимфоцитов и плазмоцитов СD138+ (рис. 2).
В 21 (32,8%) случае верифицирован умеренно выраженный ХЭ с 3-кратным увеличением иммунопозитивных клеток (лимфоцитов, моноцитов, плазмоцитов) с очаговым и диффузным расположением клеток.
После проведения комбинированной терапии ХЭ морфологическое исследование проведено во всех случаях. Результаты ИГХ-исследования продемонстрировали снижение количества цитотоксических Т-лимфоцитов (CD8+), В-лимфоцитов (CD20+) в стромальном компоненте эндометрия с мелкоочаговым расположением клеток в 52 (81,3%) случаях (рис. 3).
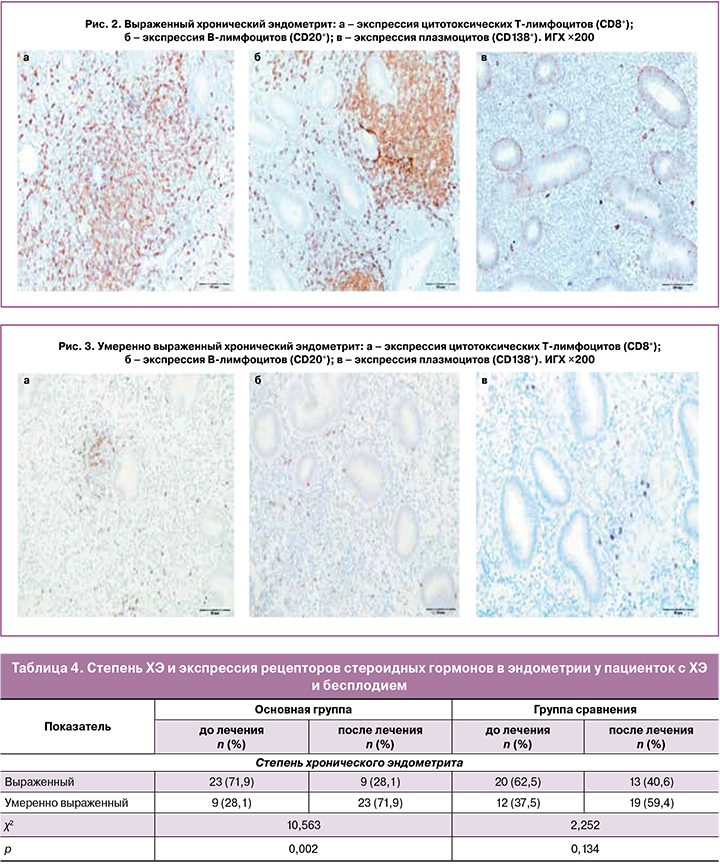
Снижение количества цитотоксических Т-лимфоцитов (СD8+), В-лимфоцитов (СD20+) и увеличение Т-хелперов (СD4+) свидетельствует о снижении степени выраженности ХЭ до умеренно выраженного воспаления (табл. 4), при этом в основной группе после проведения комплексного лечения отмечалось более выраженное снижение удельного веса выраженного ХЭ.
Обсуждение
Все этапы развития воспаления и адекватность иммунного ответа на внедрение инфекта регулируются каскадом цитокиновых реакций, которые направлены на элиминацию чужеродных антигенов, и они же выступают основными игроками, обеспечивающими полноценную регенерацию поврежденных структур тканей [10].
Суперлимф является универсальным стимулятором иммунной системы, содержащим в своем составе комплекс природных противомикробных пептидов и цитокинов: фактор, угнетающий миграцию макрофагов (МИФ), интерлейкин-1 (ИЛ-1), интерлейкин-6 (ИЛ-6), фактор некроза опухоли (ФНО), трансформирующий фактор роста (ТФР), секретируемых лейкоцитами периферической крови свиньи. Суперлимф демонстрирует опосредованные противомикробные эффекты за счет модулирования иммунного ответа, что достигается сбалансированным сочетанием про- и противовоспалительных цитокинов и имеет крайне важное значение в плане профилактики рецидивов инфекции [11]. Препарат также рассматривается в контексте его способности активировать и поддерживать функциональную активность клеток фагоцитарного ряда (моноцитов и нейтрофилов): активирует фагоцитоз, выработку цитокинов (ИЛ-1, ФНО), индуцирует противоопухолевую цитотоксичность макрофагов, способствует гибели внутриклеточных паразитов, регулирует миграцию клеток в очаг воспаления, увеличивает активность естественных киллеров. Суперлимф демонстрирует противовоспалительную, антиоксидантную и регенераторную активность, что проявляется снижением выраженности воспалительных реакций и увеличением скорости эпителизации раневых дефектов [12]. В проведенном нами исследовании назначение препарата «Суперлимф» в адъювантном режиме приводило к усилению элиминации микробных агентов из полости матки (84,04% vs 59,13%; χ2=13,075; p<0,001) и снижению степени выраженности ХЭ, что подтверждено результатами молекулярно-генетических и ИГХ-исследований.
Ранее проведенные исследования продемонстрировали, что включение в состав комплексного лечения ХЭ препарата «Суперлимф» 25 ЕД повышает эффективность терапии путем модулирования локальной экспрессии факторов врожденного иммунитета [13]. Авторами было установлено увеличение числа пиноподий в железистых клетках, а также повышение экспрессии рецепторов половых стероидов в тканях эндометрия. В исследовании Базанова П.А. и соавт. выявлено, что назначение препарата «Суперлимф» в протоколе криопереноса эмбрионов увеличивает шансы успешной имплантации эмбриона [14].
Накопление научных знаний приводит к осознанию того факта, что противомикробная терапия не является достаточной для лечения ХЭ, так как после ее проведения и элиминации инфекционных агентов из полости матки через некоторое время может происходить повторная контаминация эндометрия восходящим и/или лимфогенным путем [15]. Антибактериальная терапия не должна заменять комплексный подход с использованием адъювантных методов лечения.
Заключение
Добавление локальной цитокинотерапии в адъювантном режиме к противомикробной терапии ХЭ приводит к более высокому удельному весу элиминации микробных агентов из полости матки и достоверно снижает степень выраженности ХЭ.



