Число эмбриологических методик, применяемых в программах вспомогательных репродуктивных технологий (ВРТ), неуклонно возрастает [1–10], однако наиболее изученной и широко внедренной в клиническую практику остается криоконсервация эмбрионов [11–14]. В настоящее время криоконсервация является широко распространенным, безопасным, экономически целесообразным методом увеличения кумулятивной частоты наступления беременности [15, 16]. Кроме того, успешная криоконсервация эмбрионов позволяет приблизиться к селективному переносу одного эмбриона с целью снижения рисков, ассоциированных с развитием многоплодной беременности [17, 18].
Несмотря на это, на сегодняшний день не существует единой эмбриологической тактики для проведения переноса размороженного эмбриона (РЭ). Основным критерием эффективности криоконсервации и оттаивания эмбриона является морфологическая интактность эмбрионов и их способность к дальнейшему дроблению. Однако необходимые морфологические параметры для решения вопроса о витрификации эмбриона или переноса РЭ в полость матки четко не определены. Данные относительно оптимального временного промежутка между оттаиванием эмбриона и проведением его переноса в полость матки также противоречивы [19]. Четко не определены показания для использования различных методов вспомогательного хетчинга (ВХ) и других эмбриологических методик в программах криопереноса эмбрионов [20–26].
Цель исследования: оценить эффективность дополнительных эмбриологических методик в программах переноса РЭ.
Материалы и методы
В проспективное исследование были включены 288 супружеских пар, обратившихся для лечения бесплодия в период с 2017 по 2019 гг. в отделение вспомогательных технологий в лечении бесплодия им. проф. Б.В. Леонова ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» Минздрава России (руководитель – проф. Калинина Е.А.) с отсутствием противопоказаний к проведению ВРТ и подписанным информированным согласием на участие в исследовании. Критериями включения явились: нормальный кариотип обоих супругов, отсутствие выраженной патозооспермии (100% тератозооспермия, абсолютная астенозооспермия, все виды азооспермии), наличие витрифицированных эмбрионов. Критериями исключения явились использование донорских гамет или суррогатного материнства, а также отмена переноса РЭ в данном цикле по любым причинам.
Все включенные в исследование супружеские пары были обследованы согласно приказу Минздрава России №107н от 30.08.2012 г. «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» [3].
Оплодотворение ооцитов в цикле экстракорпорального оплодотворения (ЭКО), когда осуществляли витрификацию эмбриона, проводили различными методами: инсеминация ооцитов in vitro («классическое» ЭКО, далее ЭКО, как метод оплодотворения), интрацитоплазматическая инъекция сперматозоида в ооцит (ИКСИ), физиологическая интрацитоплазматическая инъекция сперматозоида в ооцит (ПИКСИ). В качестве культуральных сред для витрификации/размораживания эмбрионов использовали коммерческие культуральные среды. Размораживание эмбрионов проводили за 2–3 ч до переноса эмбрионов (непродолжительное культивирование) или вечером в день, предшествующий дню переноса (за 10–12 ч до переноса эмбриона, пролонгированное культивирование). Качество эмбрионов оценивал эмбриолог с помощью метода световой микроскопии, согласно общепринятой классификации Гарднера [4]. ВХ проводили с использованием лазерного микроманипулятора или путем полного удаления блестящей оболочки (проназный хетчинг). В части циклов осуществляли перенос РЭ в культуральной среде, обогащенной гиалуроновой кислотой (ГК).
Подготовка эндометрия для переноса криоконсервированных эмбрионов проводилась с использованием циклической гормональной терапии (эстрогены+гестагены) или в спонтанном овуляторном менструальном цикле. Мониторинг состояния эндометрия и фолликулогенеза осуществляли с помощью ультразвукового исследования в динамике. Перенос эмбрионов осуществляли на 7-е сутки после пика эндогенного лютеинизирующего гормона (ЛГ) в спонтанном цикле или на 5–6-й день приема препаратов прогестерона в цикле с использованием циклической гормональной терапии.
Ведение посттрансферного периода осуществлялось согласно принятым в клинической практике протоколам. Через 14 дней после переноса эмбриона в полость матки определялась концентрация β-субъединицы хорионического гонадотропина в сыворотке крови пациентки. При визуализации сердцебиения эмбриона через 5 недель после переноса эмбриона регистрировали клиническую беременность, после чего разделяли пациенток на группы и определяли частоту наступления беременности.
Статистический анализ
Для статистического анализа использовался пакет статистических программ Statistica 10.0 (США). Для определения нормальности распределения использовали критерий Шапиро–Уилка. Данные с нормальным распределением представлены как среднее значение (стандартное отклонение).
Определяли влияние различных методов работы с эмбрионами на частоту наступления клинической беременности. При оценке массива данных не учитывали оператора протокола; также не была произведена стратификация по производителю препарата и клиническим параметрам цикла овариальной стимуляции.
Статистический анализ проводился с применением χ2-теста для сравнения категориальных переменных. Мерой ассоциации для сравнения бинарных данных было отношение шансов (ОШ) с доверительным интервалом 95% (95% ДИ). Различия между статистическими величинами считали статистически значимыми при уровне значимости р<0,05.
Исследование было одобрено комиссией по этике ФГБУ «НМИЦ АГП им. акад. В.И. Кулакова» Минздрава России.
Результаты
В исследование были включены 288 пациенток, проходивших цикл переноса РЭ в ФГБУ НМИЦ АГП с января 2017 г. по март 2019 г. Средний возраст пациенток составил 33,5 (4,6) года. Частота наступления клинической беременности составила 31,9% (n=92).
Рутинное использование различных методов ВХ, культуральной среды, обогащенной ГК, а также изменение времени культивирования эмбриона после оттаивания не оказывало влияния на частоту наступления беременности. Полученные данные представлены в таблицах 1 и 2.

Дальнейший анализ данных был посвящен поиску подгрупп пациенток, в которых данные методики приводят к увеличению частоты наступления беременности. Для этого были проанализированы следующие показатели:
- возраст пациентки;
- индекс массы тела (ИМТ) пациентки, наличие или отсутствие ожирения;
- наличие неудач ВРТ в анамнезе;
- наличие и вид патозооспермии, метод оплодотворения ооцитов.
На первом этапе оценили эффективность различных методов ВХ в вышеуказанных подгруппах. Вначале была проанализирована ВХ у пациенток разных возрастных групп. Обнаружено, что полное удаление зоны пеллюцида было более эффективно у более молодых пациенток, а частичная диссекция зоны пеллюцида – наоборот, была более эффективной у пациенток более старшего возраста. Путем проведения ROC-анализа был найден пороговый уровень эффективности проназного хетчинга, который составил 33 года. В таблице 3 представлена частота наступления беременности при использовании ВХ в различных возрастных группах.
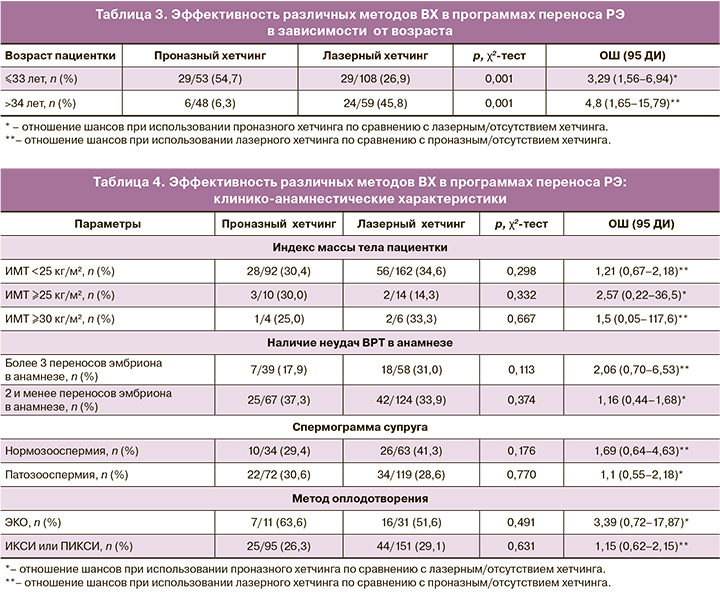
Таким образом, в подгруппе пациенток до 33 лет полное удаление зоны пеллюцида увеличивало вероятность наступления беременности в 3,3 раза, а в подгруппе пациенток 34 лет и старше применение частичной диссекции зоны пеллюцида увеличивало вероятность наступления беременности в 4,8 раза.
Далее провели анализ эффективности различных методов ВХ в зависимости от ИМТ пациентки, наличия неудач ВРТ в анамнезе, метода оплодотворения ооцитов (табл. 4).
При разделении пациенток на группы в зависимости от ИМТ, анамнеза лечения бесплодия, наличия или отсутствия патозооспермии, а также метода оплодотворения не было выявлено значимых отличий по эффективности разных методов ВХ (табл. 4).
На втором этапе была проанализирована эффективность среды, обогащенной ГК, в программах ВРТ с переносом РЭ в полость матки. Использование среды с ГК не увеличивало эффективность ВРТ у пациенток раннего и позднего репродуктивного возраста, а также у пациенток с нормальным ИМТ и с избыточной массой тела (табл. 5). Однако в подгруппе пациенток, имеющих в анамнезе не менее 3 неудачных переносов эмбриона в полость матки, использование среды с ГК приводило к увеличению частоты наступления беременности: 47,1% по сравнению с 11,4%. ОШ наступления беременности при использовании среды с ГК при наличии 3 и более переносов эмбриона в анамнезе составило 6,89 (95% ДИ 1,62–30,47) (табл. 5).
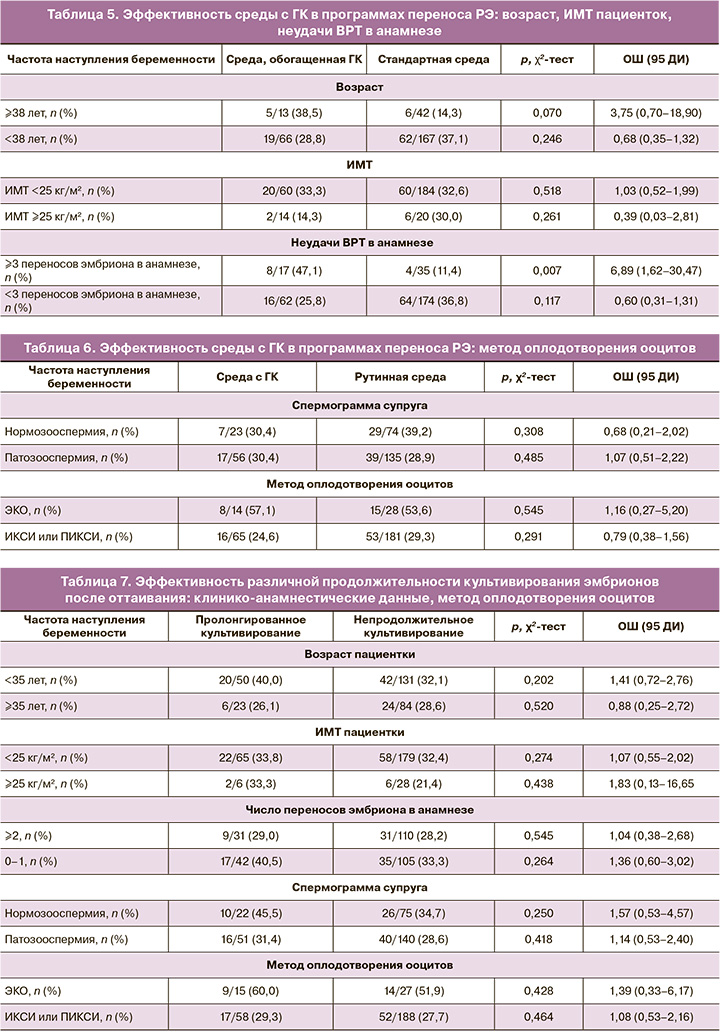
Метод оплодотворения ооцитов, а также наличие патозооспермии у супруга не влияли на эффективность использования среды с ГК (табл. 6).
На третьем этапе проанализировали эффективность различной продолжительности культивирования эмбрионов после оттаивания и до переноса: размораживание эмбрионов за 10–12 ч до переноса эмбриона (пролонгированное культивирование) и размораживание эмбриона за 3–4 ч до переноса эмбриона (непродолжительное культивирование) (табл. 7).
Частота наступления беременности при использовании различных методик культивирования эмбриона после размораживания не различалась в целом, а также в различных подгруппах пациенток. Аналогичные данные были получены при анализе эффективности различных методов культивирования эмбрионов в зависимости от качества спермы при оплодотворении и метода оплодотворения (табл. 7).
Обсуждение
Согласно данным, полученным в исследовании, использование различных методов ВХ, культуральной среды, обогащенной ГК, а также изменение времени культивирования эмбриона после оттаивания не оказывало влияния на частоту наступления беременности. Таким образом, ни одна из изученных эмбриологических методик не должна рутинно применяться для всех групп пациентов или назначаться только по желанию пациента, что согласуется с большинством имеющихся в литературе научных данных [7–10].
Дальнейший анализ был посвящен поиску подгрупп пациенток, в которых данные методики приводят к увеличению частоты наступления беременности. Согласно полученным ранее данным, эффективность проназного и лазерного хетчинга может различаться [24, 25]. С учетом вышеизложенного мы проанализировали эффективность различных методов ВХ в различных подгруппах пациенток.
В группе пациенток до 33 лет (пороговый возраст, собственные данные) применение проназного хетчинга увеличивает эффективность ВРТ и является более целесообразным, чем проведение лазерного хетчинга. Напротив, у пациенток 34 лет и старше применение проназного хетчинга снижает частоту наступления беременности, а лазерный хетчинг является более целесообразным, поскольку позволяет увеличить частоту наступления беременности в 4,8 раза. С возрастом происходит снижение качества гамет и эмбрионов, нарастает степень и тяжесть генетических аномалий и других нарушений эмбрионального развития [27–30]. Таким образом, если ВХ (особенно проназный) полностью безопасен для бластоцисты отличного качества, то при выполнении на бластоцисте со сниженными компенсаторными возможностями он может привести к снижению ее имплантационного потенциала. Принципиальным отличием проназного хетчинга является полное удаление зоны пеллюцида (в отличие от частичной ее диссекции при лазерном хетчинге), что может быть фактором, объясняющим отличие данных методов в различных группах пациенток. Возможно, в эмбрионах не отличного качества изменяется качество межклеточных связей между отдельными бластомерами, что снижает эффективность проназного хетчинга.
Применение культуральной среды, обогащенной ГК (EmbryoGlue), увеличивает частоту наступления беременности в подгруппе пациенток в возрасте 38 лет и старше, а также при наличии 3 и более неэффективных циклов переносов эмбриона в анамнезе, что соответствует данным мировой литературы [26].
Заключение
Ни одна из дополнительных эмбриологических методик не показала своей эффективности при рутинном применении. Более того, использование таких методик при отсутствии показаний может приводить к снижению эффективности ВРТ. Дальнейшие исследования должны быть направлены на выявление групп пациентов, которым однозначно должны быть рекомендованы те или иные современные эмбриологические методики, а также их комбинации.



