Трансплантация органов и тканей является одной из сложных и актуальных медико-биологических, социальных проблем. При многих тяжелых заболеваниях внутренних органов для спасения жизни пациента единственным лечением является трансплантация донорских органов. Число различных пересадок органов и тканей, проводимых в мире, измеряется десятками тысяч в год, постоянно увеличивается и, согласно прогнозам, в ближайшие десятилетия доля трансплантаций в общем количестве производимых операций будет возрастать. В США производится около 28 тысяч трансплантаций в год. Из них примерно 17 тысяч – это пересадка почки. Количество трансплантаций в России постепенно увеличивается. По данным регистра Российского трансплантологического общества, в 2014 г. было выполнено 1522 трансплантации органов, из них 1026 трансплантаций почки, больше чем в 2013 г. (935), в 2012 г. (941); 162 трансплантации сердца, что соответствует уровню 2013 г. (164), на 30 (22,7%) больше, чем в 2012 г.; 302 трансплантации печени, на 30 трансплантаций (11,0%) больше, чем в 2013 г., и на 59 (24,3%) больше, чем в 2012 г. Выполняются и комплексные пересадки: поджелудочная железа одновременно с почкой – 18 случаев в 2014 г. [1]. По данным литературы, первое место среди трансплантированных органов занимает почка, второе – печень, третье – сердце и дальше по убывающей встречаются трансплантация комплекса почка-поджелудочная железа, легких, сердца-легких, поджелудочной железы [2].
Большинство пациентов десятилетиями живут полноценной жизнью после пересадки сердца, почки, печени, создают семьи и имеют хорошее качество жизни. При этом одним из аспектов качества жизни у пациентов молодого возраста является возможность реализовать репродуктивную функцию.
Первая в истории клинической трансплантологии успешная беременность у больной с пересаженной почкой наблюдалась в 1958 г: пациентке Эдит Хелм аллотрансплантация почки была выполнена в Бостоне в мае 1956 г. (в 22-летнем возрасте). Это была третья успешная трансплантация от однояйцевого близнеца. В последующем Эдит благополучно родила двух детей, прожила с трансплантированной почкой 55 лет и умерла в возрасте 76 лет от причин, не связанных с нарушением функции трансплантата [3].
Поскольку донором почки выступала сестра-близнец пациентки, не было необходимости в приеме иммуносупрессивных препаратов, беременность была связана с гораздо меньшим количеством рисков, чем у женщин с трансплантированным органом от неродственного донора. Длительное время наличие в анамнезе трансплантации органов являлось противопоказанием к беременности.
Согласно проведенному опросу 152 женщин, перенесших трансплантацию печени, почки или поджелудочной железы в возрасте от 18 до 45 лет (2000–2012 г., кафедра акушерства и гинекологии Университета штата Мичиган, США), при консультировании женщины – носительницы трансплантата врачом-трансплантологом и акушером-гинекологом в 63% случаях не рекомендовалось планировать беременность. В 31% случаев беременность разрешали, но женщины не решались на беременность, и лишь в 3% случаев беременность наступала при поддержке врачей [4].
Впервые в России ведение беременных женщин, перенесших трансплантацию органа, в том числе и от неродственного донора, происходило на базе Научного центра акушерства, гинекологии и перинатологии имени академика В.И. Кулакова Министерства здравоохранения Российской Федерации (МЗ РФ) совместно с НИИ трансплантологии и искусственных органов МЗ РФ в 1995 году. Беременность у женщин с пересаженными органами является провоцирующим фактором для развития осложнений, таких как артериальная гипертензия, гестационный сахарный диабет, преэклампсия, отторжение трансплантата [2].
Для изучения этой проблемы и получения объективных данных по состоянию здоровья как матери, так и ребенка необходимо вести учет и регистрацию всех случаев беременности после трансплантации. Существует несколько регистров, в которых зафиксированы исходы беременностей после трансплантации: Регистр Объединенного Королевства (1997–2002), Европейский регистр Ассоциации трансплантологов и Национальный реестр беременностей после трансплантации (NTPR), созданный в 1991 г. в Северной Америке [2]. В России в настоящее время еще не существует полноценного регистра беременностей после трансплантации.
Частота беременностей после трансплантации
Встречаемость беременностей после пересадки органов по данным разных стран различна. В Германии в одной клинике с октября 1988 г. по август 2010 г. наступило 115 беременностей у 71 женщины с трансплантированными печенью или почкой [5]. В Португалии ретроспективно (1983–2009 гг.) выявлено 25 беременностей у 24 женщин, перенесших трансплантацию почки [6]. В Турции (2004–2014 гг.) выявлено 18 беременностей у 14 реципиентов почек [7]. В больнице Чарльза Николса (Тунис, 1986–2006 гг.) выполнено 312 операций по пересадке почки от живого родственного донора и 54 случая трупной пересадки. У 7 женщин наступила беременность – спонтанная и незапланированная [8]. В Корее (Сеул, 1991–2012 гг.) наступило 88 беременностей у 75 реципиентов почечного трансплантата (случаи спонтанных абортов и выкидышей не учитывались) [9]. По данным группы авторов из США на 2010 год в стране проживает приблизительно 14 тысяч женщин репродуктивного возраста, перенесших трансплантацию печени [10]. По данным NTPR, на 31 декабря 2014 г. зарегистрировано 2474 беременности у 1402 женщин, перенесших трансплантацию, 1347 беременностей у женщин, которые забеременели от 873 мужчин, перенесших трансплантацию. За 2014 год произошла 141 беременность после трансплантации в Северной Америке [2].
Осложнения беременности у пациенток с трансплантированной почкой
Одной из важных проблем у пациентов молодого возраста после трансплантации является восстановление нормального гормонального фона и возможность реализации своей репродуктивной функции, что становится возможным благодаря современным иммуносупрессивным препаратам, применение которых делает риск отторжения трансплантата во время беременности минимальным [11].
По результатам оценки осложнений у женщин после трансплантации почки в центре третьего уровня (Сингапур, 2001–2012 гг.) выявлено 11 беременностей у 9 женщин. Средний возраст на момент родов составил 34,6 года, средний интервал от пересадки до зачатия – 69 месяцев (38–97 месяцев). Отторжение трансплантата произошло в 1 случае после родов из-за нарушения приема иммуносупрессивных препаратов. Остальные 10 беременностей завершились рождением живых новорожденных, 70% из них – недоношенные дети, средний вес при рождении 2353 г (1811–2648 г) [12]. По данным NTPR в США частота эпизодов отторжения трансплантата во время беременности за 2014 год составила: 1–2% для почечного трансплантата, 3–6% для печени, 4–7% для комплекса почка-поджелудочная железа, 2–15% для сердца, 13,5% для легких. Процентный диапазон обусловлен различием в базовых иммуносупрессивных препаратах [2]. В период с 1967 по 2009 г. в Норвегии родились 492 новорожденных у матерей от мужчин после трансплантации паренхиматозных органов. Авторы ретроспективного исследования на базе данных Медицинской регистрации новорожденных в Норвегии сообщают о высоком риске развития преэклампсии у женщин, беременных от мужчин с трансплантированными органами, по сравнению с беременностями от этих же мужчин до трансплантации [13].
После пересадки паренхиматозного органа овуляция может наступить уже через 1 месяц, поэтому очень важны планирование беременности, подбор схемы и дозировки иммуносупрессивной терапии, необходимой для нормального функционирования трансплантата и обладающей минимальным риском для развивающегося плода [11].
За последние несколько лет изменилось отношение к пациентам, желающим забеременеть после трансплантации. В литературе появляются рекомендуемые сроки наступления беременности после трансплантации. До 2005 года рекомендовался 2-летний период ожидания после трансплантации, но в последнее время появились сведения о возможности зачатия через 1 год после пересадки паренхиматозного органа. В первый год высок риск отторжения, поэтому проводится иммуносупрессивная терапия в высоких дозировках, что может неблагоприятно воздействовать на плод [14].
Пациенты после трансплантации органов должны пожизненно получать иммуносупрессивную терапию; она может оказывать неблагоприятное влияние и в более поздние сроки после трансплантации, что вызывает необходимость изучения этого влияния на развивающийся плод и новорожденного. И хотя тысячи женщин с трансплантированными органами в большинстве случаев рожают здоровых детей, появилось множество новых вопросов, связанных с приемом иммуносупрессивных препаратов.
Иммуносупрессивные препараты, используемые для предупреждения отторжения трансплантата при беременности
Присутствие в организме трансплантированного чужеродного органа неизбежно вызывает иммунный ответ, поэтому условием существования и функционирования пересаженного органа является подавление развивающихся иммунологических реакций. В связи с этим беременность у таких пациентов протекает на фоне действия вводимых иммуносупрессивных препаратов, и ее исход зависит как от выраженности иммунного ответа, так и от влияния иммуносупрессивных препаратов на развитие плода.
Схемы иммуносупрессивной терапии, часто используемые при пересадке органов, могут оказывать вредное воздействие на фертильность пациента, течение беременности и ее исходы; не до конца изучено влияние данных препаратов на развивающийся плод [15].
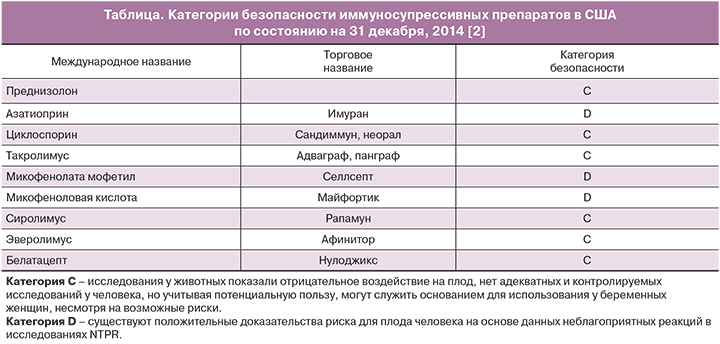
По последним результатам, согласно Управлению по контролю качества продуктов и лекарств США (Food and Drug Administration, FDA), все иммуносупрессивные препараты, которые получают пациенты после трансплантации, относятся к категории безопасности ниже В (таблица) [16].
Преднизолон – глюкокортикоид, который может проникать через плаценту. Не выявлено серьезных последствий для фертильности женщин, которые получают лечение кортикостероидами. Но частота задержки внутриутробного развития, низкой массы при рождении, преэклампсии, гипертензии, сахарного диабета и недоношенности увеличивается в группе пациентов, получавших данный препарат, по сравнению с населением в целом, независимо от дозировки и типа кортикостероида. Также высокие дозы глюкокортикоидов во время беременности могут приводить к развитию неонатальной недостаточности надпочечников, дисфункции гипоталамо-гипофизарно-надпочечниковой оси и «фетальному программированию» неблагоприятного метаболического профиля [15]. Среди врожденных пороков развития наблюдалось повышение частоты орально-лицевой расщелины у новорожденных детей [17], однако недавний анализ данных, полученных на базе реестра Дании за 12 лет, показал отсутствие связи между приемом кортикостероидов во время беременности матерью и повышением частоты расщелин у их новорожденных детей [18]. В основном авторы приходят к выводу, что при использовании в терапевтических дозах преднизолон представляет минимальный риск для развивающегося плода [17, 18].
Азатиоприн – иммуносупрессивный препарат цитотоксического и цитостатического действия. Является ингибитором пуриновых оснований, после поступления в организм быстро превращается в активный метаболит 6-меркаптопурин. Применяется с 1962 г. при трансплантации органов [15]. Тератогенность азатиоприна связана с появлением фетальных аномалий при исследованиях на животных в дозах, сходных с таковыми у людей, в связи с этим данный препарат относится к категории D. При применении данного препарата у женщин отмечено повышение частоты преждевременных родов и задержки внутриутробного развития плода, однако корреляции с пороками развития плода не выявлено [17, 19]. Проведенные немногочисленные андрологические исследования описывают хромосомные нарушения сперматозоидов во время лечения азатиоприном и спустя год после его прекращения. В связи с этим рекомендуется прекращение лечения азатиоприном, если это возможно, за 3 месяца до зачатия. Немногочисленные исследования о влиянии азатиоприна на фертильность женщины не подтверждают вредное воздействие. Также применение азатиоприна не является абсолютным противопоказанием для грудного вскармливания, так как его активный метаболит 6-меркаптопурин плохо проникает в грудное молоко и определяется в нем в низких концентрациях [15]. В связи с дефицитом фермента инозинатпирофосфорилазы в печени у плода преобразование 6-меркаптопурина в компоненты, влияющие на ДНК делящихся клеток, маловероятно [15, 20]. Таким образом, азатиоприн может применяться при беременности, если это необходимо для нормального функционирования трансплантата и предупреждения его отторжения.
Циклоспорин и такролимус – ингибиторы кальциневрина, обладают узким терапевтическим окном, в связи с чем требуется контроль их концентрации в крови [21]. Токсичность циклоспорина при превышении дозировки проявляется нефротоксичностью, артериальной гипертензией, тремором, гипертрихозом, гиперлипидемией [20]. По данным литературы, у мужчин дозы больше чем 2 мг/кг/день приводили к астенотератозооспермии. Но при сравнении частоты астенотератозооспермии у мужчин, получавших более низкие дозы циклоспорина, и популяции в целом не выявлено значимой разницы. Поэтому не рекомендуется прекращать лечение циклоспорином даже если наступление беременности желательно. По данным литературы, отмечено ограниченное проникновение циклоспорина через плаценту (5–20%), что не приводит к тератогенным эффектам [15]. Клинические данные не продемонстрировали увеличение частоты врожденных пороков развития среди детей у матерей, получавших циклоспорин, и хотя есть умеренный риск задержки роста плода, данный препарат может применяться во время беременности [2]. В 30% случаев происходят преждевременные роды, имеют место – низкий вес при рождении (ниже 50-го центиля) в 32%, врожденные пороки развития – от 5 до 6%, редкие случаи переходных гиперкалиемий и почечной недостаточности у ребенка [15].
Микофенолата мофетил (ММФ) является пролекарством, гидролизуется в печени с образованием активного метаболита микофеноловой кислоты. Микофеноловая кислота – мощный селективный неконкурентный и обратимый ингибитор инозинмонофосфатдегидрогеназы (ИМФДГ), который подавляет синтез гуанозиновых нуклеотидов, Т- и В-лимфоцитов [15]. В 2007 г. согласно решению Управления по контролю качества продуктов и лекарств США (FDA) изменена категория микофенолата мофетила с С на D на основе данных NTPR, которые показывают более высокую частоту выкидышей (от 32 до 45%) и множественных врожденных дефектов у новорожденных (26%) [2]. В литературе отсутствуют данные о воздействии микофенолата мофетила на мужскую фертильность. Так, при обследовании 205 детей, рожденных у матерей от 152 мужчин, получавших микофенолат мофетил, частота недоношенности (10%) и врожденных пороков развития (3%) такая же, как в общей популяции [22]. Таким образом, данный препарат не рекомендуется назначать женщинам молодого возраста, которые впоследствии могут забеременеть [23]. Необходимо отменить лечение микофенолом с его заменой на другой препарат за 6 недель до предполагаемого зачатия [22].
Сиролимус и эверолимус – оба препарата ингибируют клеточную пролиферацию за счет блокирования перехода клеточного цикла в фазе G1, блокируют пролиферацию Т- и В-лимфоцитов, а также гладкомышечных клеток [24], не обладают выраженной нефротоксичностью, по сравнению с ингибиторами кальциневрина. Также данные препараты обладают противовирусным эффектом (снижение частоты цитомегаловирусной инфекции) и противоопухолевым действием. Молодые женщины, которые получали сиролимус и такролимус, имеют повышенный риск аменореи и кист яичников (от 50 до 62% случаев) в течение первого года после трансплантации. При исследовании на животных не было зарегистрировано снижения массы тела при рождении и тератогенных эффектов [20]. По последним данным NTPR, зарегистрировано 19 реципиентов почечного трансплантата, которые в течение беременности получали сиролимус в комбинации с такролимусом (n=11), циклоспорином (n=6) и азатиоприном (n=2). Беременности завершились 5 выкидышами, 1 замершей беременностью и рождением 18 детей. Среди новорожденных у двух выявлены врожденные дефекты: у одного – тетрада Фалло, у другого – гипоплазия мозжечка. Все дети были на искусственном вскармливании и в настоящее время здоровы и развиваются соответственно возрасту [2, 25, 26]. Таким образом, в настоящее время опыт применения данных препаратов ограничен, в связи с чем необходима хорошо подобранная контрацепция в течение 12 недель после отмены препарата; следует избегать их назначение пациентам молодого возраста [2, 15, 17, 25].
Белатацепт – селективный блокатор пути костимуляции T-лимфоцитов CD28 – CD80/86, за счет чего угнетается активация Т-лимфоцитов [27]. По данным NTPR на 2014 г. сообщалось о двух беременностях на фоне приема белатацепта, одна из них завершилась спонтанным абортом в 11 недель, вторая беременность еще не была завершена [2].
Таким образом, иммуносупрессивная терапия, по-видимому, не имеет неблагоприятного долгосрочного эффекта на исход беременности или выживаемость трансплантата у большинства пациентов после трансплантации, хотя есть более высокая частота преждевременных родов, задержки внутриутробного роста плода и низкого веса у новорожденных. Не было отмечено увеличения доли врожденных пороков развития среди новорожденных, матери которых получали во время беременности азатиоприн, преднизолон, сиролимус и ингибиторы кальциневрина, за исключением микофенолата мофетила [17].
Результаты проведенного обследования группой авторов из Австралии показали, что на исходы беременности не влияет время наступления почечной недостаточности и трансплантации, длительность иммуносупрессивной терапии. В исследовании участвовали женщины, которым выполнена трансплантация почки до 18 лет (n=66) и после 18 лет (n=401). Срок наступления беременности после трансплантации составил 10 лет для первой группы (n=101) и 6 лет для второй (n=626) Несмотря на длительность иммуносупрессивной терапии беременность завершилась рождением живых детей в 76% случаев в первой группе и в 77% – во второй. Частота встречаемости недоношенности, задержки внутриутробного роста, средний гестационный возраст детей при рождении не отличались в обеих группах [28]. Отчет NTPR за 2014 год также не выявил существенных различий в течении беременности у реципиентов почек, забеременевших через 2, 5 или 10 лет после трансплантации [2].
Состояние здоровья детей, рожденных у матерей с трансплантированными органами
Одним из важных аспектов развития здорового ребенка является грудное вскармливание на первом году жизни. Но женщины, принимающие иммуносупрессивные препараты, лишены такой возможности. В настоящее время продолжается изучение влияния иммуносупрессивных препаратов на течение беременности и развивающийся плод, меняются категории безопасности данных препаратов в зависимости от результатов исследований. Также меняется отношение к возможности грудного вскармливания данной категорией женщин.
В 2013 году группа авторов из Филадельфии опубликовала статью, в которой согласно рекомендациям Американской академии Педиатрии указана возможность грудного вcкармливания на фоне приема кортикостероидов, так как не более 0,1% препарата определяется в грудном молоке, что не имеет терапевтического эффекта на новорожденного. Никаких неблагоприятных воздействий кортикостероидов во время грудного вскармливания не зарегистрировано [2, 29].
Sau и соавт. сообщили об отсутствии клинических и иммунологических признаков иммуносупрессии у детей в неонатальном периоде, получавших грудное молоко матерей, находящихся на иммуносупрессивной терапии [29].
Отдаленные последствия азатиоприна изучались Angelberger и соавт., которые проводили контрольное исследование матерей, получавших (n=11) и не получавших (n=12) азатиоприн в течение 3 и 6 месяцев после родов [30]. Средняя суточная дозировка азатиоприна составляла 150 мг. Продолжительность кормления составила 6 месяцев (1–18 месяцев) для первой группы и 8 месяцев (3,5–23 месяца) для второй. Средний возраст детей на момент написания статьи составил 3,3 и 4,7 года соответственно. Никаких существенных различий в частоте госпитализаций, развития инфекционных заболеваний не было обнаружено [29].
Таким образом, возможность грудного вскармливания для матерей-реципиентов трансплантата остается до конца не определенной. И хотя грудное вскармливание не рекомендовано во время лечения иммуносупрессивными препаратами, NTPR получает данные от многочисленных реципиентов, которые решались на грудное вскармливание своих детей во время приема этих лекарств; за последние 20 лет наблюдается тенденция к росту данной категории матерей. В 2014 году NTPR опубликовал обзор случав грудного вскармливания после трансплантации и пришел к выводу о безопасности кормления грудью при приеме обычных поддерживающих доз преднизолона, азатиоприна, циклоспорина и такролимуса. Из-за отсутствия данных грудного вскармливания следует избегать при принятии микофенолата мофетила, сиролимуса, эверолимуса и белатацепта. Предварительные результаты обнадеживают, но дальнейшие наблюдения детей, получавших грудное молоко от матерей, принимавших иммуносупрессивную терапию, продолжаются и в настоящее время [2].
По последним данным литературы, длительное внутриутробное воздействие иммуносупрессивной терапии не приводит к возникновению серьезных нарушений функции почек и печени у детей, рожденных у матерей с трансплантированной печенью [31]. Неврологическое развитие данной категории детей не отличается от неврологического развития детей того же гестационного возраста от матерей, не получавших во время беременности иммуносупрессивные препараты [32].
По результатам пятилетних наблюдений других авторов, почти у 26% детей, рожденных от матерей с пересаженной почкой, выявляются значительные неврологические, эндокринные, кардиальные и почечные нарушения [33].
При беременности, протекающей на фоне действия иммуносупрессивных препаратов, развитие плода происходит в условиях измененной иммунной системы матери. Остается недостаточно изученным вопрос, касающийся состояния иммунной системы ребенка на момент рождения и в более старшем возрасте. В литературе встречаются данные о серьезном истощении В-клеток [34], ухудшении развития Т-, В- и NК-клеток, низких уровнях сывороточных иммуноглобулинов [35] у детей, рожденных у матерей с трансплантированными органами. В одном из последних исследований, выполненном группой авторов из Бразилии, получена более высокая частота госпитализаций данной категории детей в первые месяцы жизни по сравнению с контрольной группой [36]. Таким образом, на сегодняшний день остается актуальным изучение клеточного и гуморального звеньев иммунной системы новорожденных, внутриутробно подвергавшихся влиянию иммуносупрессоров.
Заключение
Благодаря последним достижениям медицины беременность после трансплантации возможна, но необходима комплексная работа трансплантологов, акушеров-гинекологов, иммунологов, педиатров, включающая планирование беременности, подбор дозы иммуносупрессивных препаратов, стабилизацию функции трансплантата, взвешенную оценку рисков развития осложнений со стороны матери и плода. Отдаленные последствия внутриутробного влияния иммуносупрессивной терапии на развивающийся плод требуют дальнейшего изучения.



