Вопросы изучения патогенеза, ранней диагностики и терапии анафилактоидного синдрома беременности (АСБ) как одного из тяжелейших патологических состояний, встречающихся в акушерской практике, продолжают оставаться весьма актуальными во всех странах мира. Согласно обобщенным данным, частота АСБ варьирует от 1 на 20 000–80 000 родов, а смертность остается высочайшей в высокоразвитых странах [1].
АСБ (эмболия околоплодными водами) – это редкое и обычно катастрофическое патологическое состояние в акушерской практике, которое возникает при попадании амниотической жидкости в материнский кровоток и характеризуется кардиореспираторным коллапсом, тяжелой коагулопатией и тромбоцитопатией потребления [1–3].
Впервые данный синдром был описан в 1926 г. J. Meyer [4], но систематическое описание АСБ было представлено в 1941 г. Paul Steiner и C.C. Lushbaugh [5]. Эти авторы сообщили о 32 случаях смерти женщин от «акушерского шока» во время родов. Тщательное патологоанатомическое исследование 8 женщин показало наличие сквамозных клеток и других тканей (предположительно, элементы плода) в легочном круге кровообращения. Несмотря на варьирующие клинические проявления, эти авторы, основываясь на сходных гистологических изменениях в легких, пришли к выводу, что все пациентки погибли от единого клинического синдрома. В связи с этим они пришли к выводу, что пациентки умерли в результате «легочной эмболии околоплодными водами», что привело вскоре к появлению современного термина «эмболия околоплодными водами». Однако данное осложнение беременности встречается крайне редко, и точные патофизиологические механизмы развития до сих пор остаются неясными.
Синдром, как правило, развивается во время родов, вскоре после вагинального родоразрешения или кесарева сечения (КС) или во время медицинского аборта во II триместре [6]. Несмотря на осведомленность клиницистов и улучшенную интенсивную терапию пациенток, пострадавших от этого жизнеугрожающего состояния, смертность от эмболии околоплодными водами в значительной степени не изменилась.
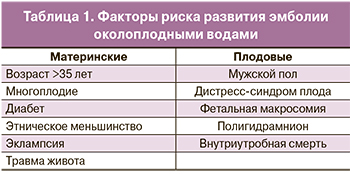 До настоящего времени АСБ считается непредсказуемым и непредотвратимым осложнением. Последние данные литературы свидетельствуют о том, что синдром развивается не во всех случаях, когда амниотическая жидкость попала в кровоток, так как, во-первых, околоплодные воды не могут вызвать эмболизацию сосудистой сети легких, во-вторых, амниотическая жидкость полностью растворима в крови. Вместо этого считается, что ключевыми факторами в развитии АСБ являются гуморальные явления, вызывающие анафилактоидные реакции и/или активацию системы комплемента [3, 7]. В литературе также описаны примеры развития данного синдрома и в послеродовом периоде, и во время амниотрансфузии [8, 9]. К предрасполагающим факторам развития эмболии околоплодными водами относятся: 1) низкое венозное давление у роженицы при гипотонии; 2) бурная, дискоординированная родовая деятельность; 3) необоснованная стимуляция сократительной активности матки; 4) особенно опасны быстрое, неравномерное внутривенное введение окситоцина в целях родовспоможения, введение окситоцина с неравномерным интервалом или резкая его отмена; 5) переношенная многоплодная беременность; 6) роды крупным или мертвым плодом; 7) введение растворов в межворсинчатое пространство; 8) прерывание на поздних сроках беременности методом вливания растворов за оболочки [1]. Особенно важно подчеркнуть, что имеются факторы риска, которые увеличивают риск развития АСБ (табл. 1) [10].
До настоящего времени АСБ считается непредсказуемым и непредотвратимым осложнением. Последние данные литературы свидетельствуют о том, что синдром развивается не во всех случаях, когда амниотическая жидкость попала в кровоток, так как, во-первых, околоплодные воды не могут вызвать эмболизацию сосудистой сети легких, во-вторых, амниотическая жидкость полностью растворима в крови. Вместо этого считается, что ключевыми факторами в развитии АСБ являются гуморальные явления, вызывающие анафилактоидные реакции и/или активацию системы комплемента [3, 7]. В литературе также описаны примеры развития данного синдрома и в послеродовом периоде, и во время амниотрансфузии [8, 9]. К предрасполагающим факторам развития эмболии околоплодными водами относятся: 1) низкое венозное давление у роженицы при гипотонии; 2) бурная, дискоординированная родовая деятельность; 3) необоснованная стимуляция сократительной активности матки; 4) особенно опасны быстрое, неравномерное внутривенное введение окситоцина в целях родовспоможения, введение окситоцина с неравномерным интервалом или резкая его отмена; 5) переношенная многоплодная беременность; 6) роды крупным или мертвым плодом; 7) введение растворов в межворсинчатое пространство; 8) прерывание на поздних сроках беременности методом вливания растворов за оболочки [1]. Особенно важно подчеркнуть, что имеются факторы риска, которые увеличивают риск развития АСБ (табл. 1) [10].
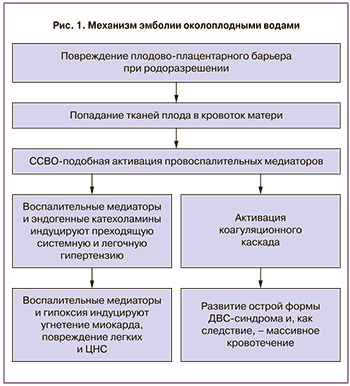 Лежащие в основе АСБ патофизиологические механизмы до конца не изучены, но имеется ряд различных теорий. Benson M. в своей работе [11] предположил, что гипотеза об анафилаксии как механизме развития синдрома АСБ (предложенная в 1956 г. Attwood) может быть доказана путем тестирования больных женщин на сывороточную триптазу. На данный момент предполагается, что поступление амниотической жидкости (содержащей клетки плода и другой антигенный материал) в системный материнский кровоток происходит при разрушении плодово-плацентарного барьера, при повреждении стенок эндоцервикальных вен, которые расширяются во время родов, на фоне травмы матки или при преждевременной отслойке нормально расположенной плаценты. Это приводит к патологической активации гуморальных и иммунологических процессов и к высвобождению вазоактивных и прокоагулянтных веществ, сходных с синдромом системного воспалительного ответа [10]. В результате этого давление в легочном стволе резко повышается, давление в правом желудочке увеличивается, что приводит к правожелудочковой недостаточности, формированию легочного сердца, уменьшению наполнения левого желудочка (ЛЖ), снижению сердечного выброса. Следствием этого становятся тканевая гипоксия, ишемия, метаболический ацидоз и кардиогенный шок [1, 12]. Вероятность повреждения эндотелиально-альвеолярной мембраны и синдрома повышенной проницаемости капилляров подтверждается тем, что имеется высокая концентрация белка в отечной жидкости, а также наличием остатков околоплодных вод в мокроте и альвеолярных пространствах этих пациенток [13–16]. Предполагаемые механизмы эмболии околоплодными водами представлены на рис. 1 [10].
Лежащие в основе АСБ патофизиологические механизмы до конца не изучены, но имеется ряд различных теорий. Benson M. в своей работе [11] предположил, что гипотеза об анафилаксии как механизме развития синдрома АСБ (предложенная в 1956 г. Attwood) может быть доказана путем тестирования больных женщин на сывороточную триптазу. На данный момент предполагается, что поступление амниотической жидкости (содержащей клетки плода и другой антигенный материал) в системный материнский кровоток происходит при разрушении плодово-плацентарного барьера, при повреждении стенок эндоцервикальных вен, которые расширяются во время родов, на фоне травмы матки или при преждевременной отслойке нормально расположенной плаценты. Это приводит к патологической активации гуморальных и иммунологических процессов и к высвобождению вазоактивных и прокоагулянтных веществ, сходных с синдромом системного воспалительного ответа [10]. В результате этого давление в легочном стволе резко повышается, давление в правом желудочке увеличивается, что приводит к правожелудочковой недостаточности, формированию легочного сердца, уменьшению наполнения левого желудочка (ЛЖ), снижению сердечного выброса. Следствием этого становятся тканевая гипоксия, ишемия, метаболический ацидоз и кардиогенный шок [1, 12]. Вероятность повреждения эндотелиально-альвеолярной мембраны и синдрома повышенной проницаемости капилляров подтверждается тем, что имеется высокая концентрация белка в отечной жидкости, а также наличием остатков околоплодных вод в мокроте и альвеолярных пространствах этих пациенток [13–16]. Предполагаемые механизмы эмболии околоплодными водами представлены на рис. 1 [10].
В литературе, посвященной патофизиологии АСБ, значительное место отводится обсуждению нарушения системы гемостаза и развитию тяжелой коагулопатии, а также тромбоцитопатии потребления. Амниотическая жидкость содержит вещества с высокой тромбопластиноподобной активностью, усиливающейся со сроком беременности. Кроме того, амниотическая жидкость имеет антифибринолитическую активность, которая также увеличивается со сроком гестации.
Патогенетические механизмы, через которые амниотическая жидкость активирует прокоагулянтную систему, включают в себя непосредственную активацию альтернативного пути фактора свертывания X (фактор Стюарта–Прауэра) в присутствии молекул кальция в активную форму фактора Х (FXa, протромбиназа). Вот такая прямая активация X-фактора имеет место только при данном патологическом состоянии, исключением является рак, так как опухолевые клетки выделяют «раковый прокоагулянт». Фактор Ха в присутствии акцелератора-глобулина и фосфолипидов (в том числе амниотической жидкости и поверхности тромбоцитов) непременно конвертирует протромбин в тромбин.
Таким образом, у пациенток с АСБ формируются микротромбы, которые состоят из тромбоцитов и фибрина. Это внутрисосудистое свертывание сопровождается тромбозами микроциркуляторного русла, тромбоэмболиями и кровотечением (рис. 2).
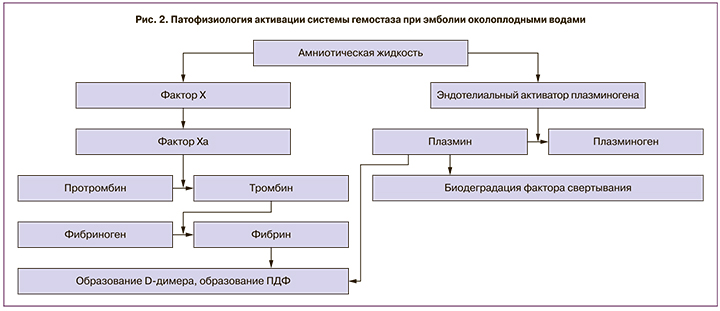
Активация фактора VII и тромбоцитов и высвобождение медиаторов воспаления активируют коагуляционный каскад, приводящий к ДВС-синдрому, что, в свою очередь, приводит к нарушению перфузии органов и полиорганной недостаточности [1, 17, 18]. Сквамозные клетки плода в амниотической жидкости высвобождают эндотелин-1, вазо- и бронхоконстрикторы, что еще больше усугубляет гемодинамические нарушения.
АСБ проявляется целым рядом клинических симптомов (табл. 2) [19]. Данное состояние необходимо заподозрить в первую очередь при внезапном развитии острой дыхательной недостаточности во время нормальных родов. Малозаметные и неспецифические симптомы, такие как беспокойство, возбуждение, боль в груди, головокружение, транзиторная гипоксия и одышка, могут возникнуть перед кардиоваскулярным коллапсом [2]. Схематически клиническую картину АСБ можно разделить на 3 фазы. Начальная фаза характеризуется транзиторной пульмонарной и системной гипертензией, приводящей к нарушению вентиляционно-перфузионных отношений, гипоксемии и развитию правожелудочковой сердечной недостаточности. Вторая фаза включает снижение функции ЛЖ и развитие острого отека легких. Третья фаза характеризуется сердечной недостаточностью, острым респираторным дистресс-синдромом (ОРДС) и коагулопатией [18].

Гипотензия и кардиоваскулярный коллапс развиваются у 80–90% пациенток с классической эмболией околоплодными водами [19]. При сборе данных, полученных с помощью чреспищеводной эхокардиографии (Эхо-КГ), выявляются легочная гипертензия и легочный вазоспазм, приводящие к правожелудочковой недостаточности [20–22]. А левожелудочковая сердечная недостаточность, желудочковая аритмия и/или внезапная остановка сердца могут возникнуть из-за ишемического повреждения миокарда или вследствие подавляющего воздействия циркулирующих медиаторов воспаления, обладающих кардиодепрессорным эффектом [18].
Острая легочная вазоконстрикция приводит к развитию гипоксии, тахипноэ, диспноэ и дыхательной недостаточности. Незначительные проявления АСБ могут привести к транзиторной гипоксии и одышке [1, 19]. Патогенез острого отека легких и ОРДС, по всей вероятности, многофакторный. Согласно одной из гипотез, острый отек легких и ОРДС развиваются вторично, как следствие массивной местной дегрануляции тучных клеток в легочной ткани. Это приводит к резкому повышению проницаемости легочных капилляров и формированию альвеолярного выпота. Также играют свою роль в патогенезе острого отека легких и ОРДС нарушение сократительной функции ЛЖ и объемная перегрузка сосудистого русла [23].
Одними из отличительных признаков АСБ являются неконтролируемое кровотечение и развитие тяжелой коагулопатии вместе с тромбоцитопатией потребления. Гематологические нарушения, вероятнее всего, развиваются из-за наличия медиаторов в околоплодных водах, которые достигают кровообращения матери или являются результатом активации системного воспалительного каскада. У некоторых пациентов атоническое кровотечение или коагулопатия может развиться еще до системного кардиоваскулярного коллапса. На данный момент существует неопределенность, связана ли эта коагулопатия с избыточным потреблением, или с фибринолизом, или присутствует и то и другое. Амниотическая жидкость обладает тромбопластиноподобной активностью, также содержит урокиназоподобный активатор плазминогена, комплекс тромбин-антитромбин III, ингибитор активатора плазминогена 1 типа. Для эмболии околоплодными водами характерны коагулопатия потребления и гиперфибринолиз [1, 24, 25].
Измененное психическое состояние, возбуждение, судороги связаны с развитием гипоксически-ишемической энцефалопатии из-за кардиопульмонарного коллапса и нарушения перфузии и диффузионной способности легких. До 80% выживших пациенток в дальнейшем могут страдать из-за гипоксического повреждения мозга, судорог [10].
В табл. 3 представлены заболевания, с которыми необходимо проводить дифференциальный диагноз [20].
Важно помнить, что АСБ – диагноз исключения. Данный диагноз ставится на основании клинической картины. Начальные признаки часто можно увидеть на основании электрокардиограммы (признаки синусовой тахикардии с острым легочным сердцем, гипоксия миокарда), а пульсоксиметрия может показать резкое падение насыщения кислородом. Это сопровождается гипотензией и кардиоваскулярным коллапсом, связанным с тяжелыми дыхательными расстройствами. Имеются данные литературы, что первым признаком могут быть тяжелые неконтролируемые кровотечения с ДВС-синдромом [10]. Однако окончательный диагноз ставится на основании демонстрации материала околоплодных вод в кровотоке матери и в мелких артериях, артериолах и капиллярах легочных сосудов. У живого пациента диагноз может быть поставлен на основании идентификации лануго или волос плода и сквамозных клеток в аспирате крови из правых отделов сердца [26].
В некоторых случаях в мокроте матери были обнаружены сквамозные клетки плода. Дополнительными диагностическими инструментами для подтверждения диагноза считаются: рентгенография грудной клетки (увеличенные правые отделы сердца, отек легких), пульмоскан (пониженная радиоактивность в области легких), центральное венозное давление (первоначально повышение из-за легочной гипертензии, в конце – глубокое падение из-за сильного кровотечения), коагулограмма (в норме при беременности повышаются факторы свертывания, однако при эмболии околоплодными водами имеются признаки ДВС (тромбоцитопения, удлинение активированного частичного тромбопластинового времени (АЧТВ) и протромбинового времени, высокий уровень D-димера, гипо- афибриногенемия, резкое снижение гемоглобина) [24, 25]. Удлинение АЧТВ в сочетании с очень высоким D-димером и сниженным протромбиновым индексом являются предсказателями или признаками развившейся коагулопатии потребления. Некоторые исследователи использовали иммунное окрашивание антимуциновых моноклональных TKH-2 антител в сыворотке и ткани легкого матери [27].
Другим описанным методом было измерение цинк-копропорфирина (компонент мекония), обнаруженного в сыворотке крови матери, который повышен при АСБ [28]. Также диагностическую ценность представляют моноклональные антитела (CD61-GPIIIa, Beta-HCG-FVIII-vWhPL-антитела), которые позволяют определить наличие мегакариоцитов плода и клеток синцитиотрофобласта в микрососудах легких матери [1]. Недавно был предложен анализ материнской плазмы на IGFBP-1 (белок-1, связывающий инсулиноподобный фактор роста) для диагностирования АСБ [10]. IGFBP-1, фетальный фактор роста, синтезируемый клетками хориона, присутствует в высокой концентрации в амниотической жидкости и в низкой концентрации – в материнской плазме. Детекция IGFBP-1 используется у многих беременных в чувствительных полосках, что позволяет диагностировать разрыв оболочки плода. Для исследования было взято 25 случаев АСБ. Повышенный уровень IGFBP-1 в плазме позволил диагностировать АСБ с высокой чувствительностью и специфичностью (92 и 97% соответственно, при концентрации 104 мг/л) для пациенток с соответствующей клинической картиной; уровень был низким в случае контрольных пациенток (с симптомами, связанными с другими причинами, нормальными родами, тромбоэмболией). К сожалению, данный метод диагностики не является еще общедоступным [10].
Решающими факторами в успешном лечении АСБ являются своевременное распознавание симптомов, быстрые реанимационные мероприятия и рождение ребенка [29]. При подозрении на АСБ необходима быстрая скоординированная совместная междисциплинарная реакция, независимо от условий оказания медицинской помощи [10]. Междисциплинарная команда, которая включает в себя акушеров, анестезиологов, реаниматологов, гематологов и неонатологов, как правило, должна существовать в каждом родильном учреждении [30]. Так как АСБ разовьется с большой вероятностью в условиях акушерского стационара, активация заранее определенного «экстренного кода» позволяет мобилизовать бригаду быстрого реагирования и своевременно начать комплекс реанимационных мероприятий [31, 32]. Когда родильница требует перевода в другое учреждение для оказания расширенной медицинской помощи, откладывание может привести к летальному исходу [33]. Легкодоступная передовая система охраны материнства способствует улучшению результатов. Необходимо знать, что сужение верхних дыхательных путей может обусловливаться гормональными изменениями, что может затруднить интубацию. Остаточная емкость легких снижается, при этом повышается риск аспирации из-за высокого стояния диафрагмы [30]. Уменьшенный запас кислорода делает беременную женщину очень восприимчивой к развитию дыхательной недостаточности.
Если женщина еще не родила и наступила смерть, то посмертное КС, безусловно, улучшает исход для ребенка [34, 35]. Важно знать, что КС следует проводить в течение 5 минут после остановки сердца [29]. Таким образом, планирование посмертного КС целесообразно начинать сразу после остановки сердца и в палате отделения патологии беременных, чтобы избежать ненужных задержек. Наличие неонатологов для ухода за новорожденным имеет большое значение [36]. После того, как у женщины отмечается восстановление самостоятельного кровообращения, основное внимание в лечении уделяется коррекции гипоксии и гипотензии [29]. Введение артериального катетера позволяет осуществлять непрерывный мониторинг артериального давления и обеспечивает легкий доступ для анализа газов крови для определения эффективности вентиляции легких и степени гипоксемии, а также для выявления метаболических нарушений [37]. Для предотвращения резистентности легочных сосудов, усугубляющих правожелудочковую сердечную недостаточность, следует избегать гипоксии, гиперкапнии и ацидоза [31]. Пульсоксиметрия и анализ газов артериальной крови определяют стратегию инвазивной вентиляции [19]. Также могут возникнуть некардиогенный отек легких и ОРДС, которые немедленно требуют применения вентиляции легких с низким газопотоком, высоким положительным давлением в конце выдоха и повышенной частотой дыхания [10].
Для целенаправленной жидкостной реанимации и введения инотропных и вазопрессорных препаратов для коррекции гипотензии и оптимизации преднагрузки рекомендуется применение двух больших внутривенных канюль и центрального венозного доступа [37]. Следует обратить внимание на то, что физиологические изменения во время беременности приводят к увеличению сердечного выброса до 50%, поэтому внутривенное введение жидкости должно проводиться под тщательным мониторированием гемодинамики [30]. Катетер легочной артерии целесообразно использовать для мониторинга сердечного выброса, центрального венозного давления, давления в концевых легочных капиллярах и давления в легочной артерии [38, 39]. Очень важно избегать чрезмерного введения жидкости, так как это может привести к перегрузке правого желудочка, повышая риск развития инфаркта миокарда и острого повреждения легких. Трансторакальная и чреспищеводная ЭхоКГ могут быть полезны при оценке работы желудочков [10]. Контроль диуреза происходит с помощью постоянного мочевого катетера со скоростью более 0,5 мл/кг/ч, а инотропная поддержка обеспечивается с помощью инфузии норадреналина. Добутамин и милринон являются альтернативными препаратами, которые снижают сопротивление сосудов легких, тем самым снимают нагрузку с правого желудочка и увеличивают сократимость ЛЖ [37].
Коагулопатические кровопотери ожидаются у женщин, у которых подозревается АСБ [21]. Базовые тесты включают в себя общий анализ крови, электролиты, коагулограмму, международное нормализованное отношение (МНО) и фибриноген и проводятся до тех пор, пока коагулопатия не разрешится. Активация протокола массивной трансфузии обеспечивает быструю доставку эритроцитарной массы и других препаратов крови. Лечение острой формы ДВС-синдрома направлено на поддержание уровня тромбоцитов свыше 50 000/мм3, нормального значения АЧТВ и МНО. Также дается комбинация струйного введения свежезамороженной плазмы, криопреципитата и тромбоцитов [21]. Назначение эритроцитарной массы восстанавливает кислородную емкость крови при продолжающейся кровопотере. Целесообразно использование устройств для тромбоэластографии, которые обеспечивают в местах оказания медицинской помощи мониторинг уровня фибриногена. Назначение транексамовой кислоты рекомендуется для терапии гиперфибринолиза [40].
Атония матки с чрезмерным коагулопатическим маточным кровотечением выходит на первый план проявления АСБ. Атония матки развивается из-за высокого уровня продуктов распада фибрина/фибриногена, так как они обладают большим влиянием на сократительные белки матки [7]. Окситоцин является универсальным средством, который уменьшает воспаление и проницаемость капилляров [41]. Мизопростол и метилэргоновин также используются для сокращения матки. При неэффективности баллонной тампонады в ряде случаев успешно применяется эмболизация маточных артерий. В конечном итоге почти 20% женщин, у которых развивается АСБ, нуждаются в гистерэктомии [42].
Появляются новые данные литературы о целесообразности применения атропина, ондансетрона и кеторолака. Было высказано предположение, что применение атропина и ондансетрона ведет к ингибированию серотонина и вагусной стимуляции, тем самым улучшая функцию кардиоваскулярной деятельности и системный сосудистый тонус, а кеторолак, в свою очередь, ингибирует образование тромбоксана, что блокирует предполагаемую причину тяжелой коагулопатии [43].
Заключение
Таким образом, многие вопросы диагностики и лечения АСБ остаются дискутабельными, что подтверждает актуальность и важность данной патологии. Частота развития АСБ невысока, но необходимо знать, что появление данного симптомокомплекса представляет серьезную угрозу для жизни матери и плода. Учитывая исключительное значение нарушений в системе гемостаза в патогенезе АСБ, эта проблема представляет научный интерес и требует дальнейших клинических исследований. Понимание патогенетических механизмов развития АСБ играет ключевую роль в формировании грамотных и доказательных подходов к профилактике, дифференциальной диагностике и своевременно назначенной терапии данного осложнения беременности.



