Артериальная гипертензия (АГ) в настоящее время является одной из наиболее распространенных форм патологии у беременных. По данным Минздрава России, АГ и ассоциированные с ней осложнения занимают 3–4-е место в структуре причин материнской смертности на протяжении последнего десятилетия [1, 2]. АГ увеличивает риск таких акушерских осложнений беременности, как преждевременная отслойка нормально расположенной плаценты, плацентарная недостаточность, синдром задержки развития плода, преэклампсия и эклампсия [2–5].
АГ во время беременности объединяет различные клинико-патогенетические формы, которые существенно различаются не только по эпидемиологическим характеристикам, но и по патофизиологическим механизмам их развития и степени риска неблагоприятного прогноза для матери и плода [6–8]. На сегодняшний день все авторы констатируют, что точные причины и механизмы развития АГ у беременных и ассоциированных с ней акушерских осложнений окончательно не установлены [6–9]. В их возникновении предполагается роль приобретенных факторов сердечно-сосудистого риска во взаимосвязи с мультифакторными генетическими дефектами системы гемостаза, фолатного цикла, ренин-ангиотензин-альдостероновой системы, оксида азота, которые реализуются за счет дисфункции эндотелия [4–11].
Интерес представляет изучение ассоциации различных генетических и приобретенных факторов риска с осложнениями беременности при различных формах АГ.
Цель исследования: оценка взаимосвязи генетических и приобретенных факторов риска, состояния гемостаза с осложненным течением беременности при различных формах АГ.
Тип исследования: когортное с проспективной когортой.
Материал и методы исследования
Наблюдались беременные в городском отделе патологии гемостаза на базе МБУЗ Городская клиническая больницы № 11 г. Челябинска за период 2009–2012 гг. Метод выборки: сплошной по мере обращаемости.
Критерии включения: беременность на момент включения до 20 недель; возраст от 18 до 45 лет; наличие АГ; информированное согласие пациентки на участие в исследовании.
Критерии исключения: симптоматические АГ (почечные, эндокринные); тяжелая сопутствующая патология печени и желудочно-кишечного тракта в фазе обострения и декомпенсации; системные заболевания соединительной ткани; ментальные расстройства и психические заболевания; хронический алкоголизм, наркомания.
Ход исследования. Начальная точка включения в исследование – регистрация АГ при первом визите в женскую консультацию. АГ устанавливалась на основании национальных рекомендаций Всероссийского научного общества кардиологов (2010) и клинического протокола ведения беременных с АГ (2012): повышение систолического артериального давления (САД) ³140 мм рт. ст. и/или диастолического артериального давления (ДАД) ³90 мм рт. ст., зарегистрированного при двух и более последовательных измерениях с интервалом ³4 часов [1, 2].
Точкой окончания наблюдения являлся период как минимум 12 недель после завершения беременности независимо от ее исхода.
В соответствии с критериями включения/исключения в исследование вошли 300 беременных, которые были разделены на 3 группы: группа 1 – 127 женщин с хронической АГ, из них подгруппа 1а (без протеинурии после 20 недель) – 106 женщин, подгруппа 1б (с протеинурией после 20 недель – хроническая АГ + преэклампсия) – 21 женщина; группа 2 – 73 женщины с индуцированной беременностью АГ, из них подгруппа 2а (гестационная АГ без протеинурии) – 63 женщины, подгруппа 2б – (гестационная АГ с протеинурией – преэклампсия) – 10 женщин; в группу 3 (группа контроля) вошло 100 женщин, не имеющих отягощенного акушерско-гинекологического и/или тромботического анамнеза.
Проводилось клиническое обследование и наблюдение, анализ медицинской документации, стандартное лабораторно-инструментальное обследование, гемостазиологическое исследование, оценка маркеров генетической тромбофилии, предрасположенности к АГ и эндотелиальной дисфункции. Коагуляционные исследования (активированное частичное тромбопластиновое время (АЧТВ), тромбиновое время (ТВ), протромбиновое время (ПВ), фибриноген, антитромбин III) выполнялись на коагулометре Sysmex CA-560 (Япония); уровень растворимых фибринмономерных комплексов (РФМК) и показатели фибринолиза оценивались с помощью мануальных методик, уровень плазминогена – на реактивах ООО Технология-стандарт (Россия). Спонтанная и индуцированная агрегация тромбоцитов (с АДФ 5 мкМ/мл, адреналином 10 мкг/мл, коллагеном 20 мг/мл) исследовались на лазерном агрегометре «Биола LA 230-2» (Россия) [10, 12]. Изучались полиморфизмы в генах факторов свертывания (FV Leiden G1691A, F II G20210A, Fgb G455A), фолатного цикла (MTHFR С677Т), тромбоцитарного звена (GPIIIa T1565С), фибринолиза (PAI-1 4G6755G), а также в генах, ассоциированных с артериальной гипертензией (I/D полиморфизм гена ангиотензинпревращающего фермента (ACE), ангиотензиногена-II (AGT) T174M, рецептора ангиотензиногена-II типа 1 (ATR1) A1166C) и с эндотелиальной дисфункцией (NO-синтетазы (NOS3) C786T), методом полимеразной цепной реакции с использованием реактивов НПО «Литех» (Москва).
Статистический анализ данных проводился при помощи пакета статистических программ MedCalc® версия 11.5.0 (2011). Данные в тексте представлены в виде средней арифметической и ее среднеквадратичного отклонения (M±σ). Применялись критерии Стьюдента, Краскелла–Уоллиса, критерий c2 в зависимости от типа данных и характера распределения. Для оценки ассоциации генотипов и аллелей с событиями рассчитаны отношения шансов (ОШ) с 95% доверительным интервалом (95% ДИ). Распределение генотипов проверяли на соответствие равновесию Харди–Вайнберга с помощью критерия χ2. Для оценки независимой ассоциации генетических и приобретенных факторов с артериальной гипертензией у беременных использовался метод множественной логистической регрессии с расчетом отношения шансов для каждого из статистически значимых факторов и 95% доверительного интервала. Для всех видов анализа статистически достоверными считались значения p<0,05.
Результаты исследования
Возраст обследованных беременных составил 31±4,7 года у женщин с хронической АГ без протеинурии, 30±5,1 года у женщин с хронической АГ с протеинурией, 26±4,4 года – у женщин с гестационной АГ без протеинурии, 25±3,6 года – у женщин с преэклампсией и 26±4,4 года – в контроле (р1а,б-2а,б,3<0,001). В группе 1 чаще встречались женщины старше 30 лет (64,2, 52,4% – в подгруппах 1а и 1б, 22,2 и 10% в подгруппах 2а и 2б и 20% в группе 3, р1а,б-2а,б,3<0,001).
Наиболее распространенными факторами риска во всех группах оказались избыточная масса тела и ожирение (индекс Кетле ≥25 кг/м2) в сравнении с контролем (83,0, 76,2, 73, 50 и 15% соответственно, р1а,б,2а,б-3<0,001), а также курение до беременности (26,4, 14,3, 20,6, 20 и 6% соответственно, р1а-3<0,001, р2а-3=0,01). У беременных в группах 1 и 3 чаще, чем в группе 2 и контроле отмечена отягощенная наследственность по АГ (71,7, 71,4, 42,9, 10 и 21% соответственно, р1а,б,2а-3<0,001) и по венозным и артериальным тромбозам (17,9, 19, 20, 3,2 и 9% соответственно, р1а-2б=0,03).
При анализе акушерско-гинекологического анамнеза первородящие пациентки чаще встречались в группе с гестационной АГ (14,2, 14,3, 25,4, 10 и 12%). У женщин в подгруппах с хронической АГ в анамнезе чаще отмечались самопроизвольные выкидыши до 10 недель (21,7% – в группе 1а, 19% – в группе 1б, 14,3% – в группе 2а и отсутствие таковых в группе 2б и контроле, р1а,б-3<0,001, р2-к<0,001), преждевременные роды (11,3, 23,8, 3,2, 10 и 0% соответственно, р1а-3=0,002, р1б-2а=0,02, р1б-3<0,001), а также синдром поликистозных яичников – в сравнении с группой 2а и контролем (10,4, 19, 0, 10 и 0% соответственно, р1а-2а=0,02, р1б-2а=0,003, р1а,1б-3<0,001).
При анализе особенностей течения беременности в I триместре установлено, что у женщин во всех подгруппах с АГ чаще отмечалась угроза прерывания беременности (39,6, 33,3, 31,7, 40 и 25%, р1а-к=0,037) и низкое расположение хориона (27,4, 38,1, 27, 0 и 14%) по сравнению с контролем. При динамическом наблюдении установлено, что нарушения маточно-плацентарного кровотока различной степени во II триместре (20–22 недели) одинаково часто регистрировались во всех подгруппах с АГ (19,8% – в подгруппе 1а, 19% – в подгруппе 1б, 17,5% – в подгруппе 2а, 20% – в подгруппе 2б) по сравнению с контролем (2%, р1а,б-3<0,001, р2а-3=0,001, р2б-3=0,04). Нарушения маточно-плацентарного кровотока в III триместре (32–34 недели) чаще отмечались в группе 1 в сравнении с другими группами (24,5% – в подгруппе 1а, 33,3% – в подгруппе 1б, 9,5% – в подгруппе 2а, 0% – в подгруппе 2б, 3% – в группе 3, р1а,б-3<0,001). Синдром задержки развития плода (менее 10 центиля) чаще отмечался во всех подгруппах с АГ, особенно с преэклампсией, при отсутствии такового у беременных без АГ (6,7, 19, 7,9 и 20%, р1а-3=0,03, р1б-3<0,001, p2б-3=0,001). Признаки внутриутробной гипоксии плода (по данным кардиотокографии) также чаще отмечались у женщин с преэклампсией в сравнении с контролем (12,3, 9,5, 12,7, 20 и 3% соответственно, р1а-3=0,03, р2а-3=0,04).
По частоте таких осложнений, как ранний токсикоз (10,4, 23,8 9,5, 20 и 9% соответственно), истмико-цервикальная недостаточность (10,4, 4,8, 3,2, 0 и 5% соответственно), угрожающие преждевременные роды во II триместре (38,1, 17, 20,5, 19 и 15% соответственно) и в III триместре беременности (1,9, 4,8 7,9, 0 и 6% соответственно) значимых различий не обнаружено. Структура экстрагенитальных заболеваний, таких как анемия беременных (34,9, 38,1 44,4, 20 и 47% соответственно), гестационный пиелонефрит (17, 14,3, 19, 0 и 15% соответственно), гестационный сахарный диабет (4,7% в подгруппе 1а и 9,5% в подгруппе 1б) в группах и подгруппах также не отличалась.
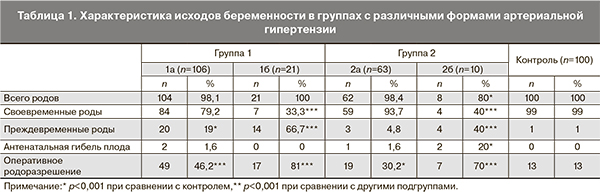
Данные об исходах беременности в группах сравнения представлены в табл. 1. В подгруппах беременных с хронической АГ (подгруппа 1а), с хронической АГ с преэклампсией (подгруппа 1б), а также с преэклампсией (подгруппа 2а) было больше преждевременных родов в сравнении с беременными с гестационной АГ и без АГ. У женщин с преэклампсией чаще отмечалась антенатальная гибель плода в сравнении с контролем. Родоразрешение путем операции кесарева сечения чаще проводилось у женщин с хронической АГ с присоединившейся преэклампсией (81%), с преэклампсией без предшествующей АГ (70%), несколько реже – с хронической АГ (46,2%) и гестационной АГ (30,2%).
В подгруппе беременных с хронической АГ и преэклампсией (1б) в преобладающем большинстве (88,2%) кесарево сечение проводилось по экстренным показаниям, у женщин с хронической АГ (1а) – примерно в половине случаев (49,5%). У беременных с преэклампсией во всех случаях кесарево сечение проводилось в экстренном порядке, а у женщин с гестационной АГ – в 73,5% случаев.
Масса детей при рождении составила 3172±638 г в подгруппе 1а, 2364±719 г в подгруппе 1б, 3355±392 г – в подгруппе 2а, 2310±1297 г – в подгруппе 2б и 3503±326 г – в контроле (р1а,б,2б-3<0,001, р1б,2б-1а,2а<0,001). Рост новорожденных составлял 50±3,5 см в подгруппе 1а, 45±5,3 см – в подгруппе 1б, 52±2,3 см – в подгруппе 2а, 44±9,1 см – в подгруппе 2б и 52±2,1 см – в группе контроля (р1а,б,2б-3<0,001, р1б,2б-1а,2а<0,001). При оценке по шкале Апгар на 1-й и 5-й минуте суммарный балл от 8 до 10 чаще отмечался у новорожденных в подгруппе с гестационной АГ (59,4%, р1б,2б-2а=0,01) и без АГ (79%, р1а,б,2а,б-3<0,01); суммарный балл от 6 до 7 чаще встречался в подгруппах с преэклампсией (50%) и с хронической АГ+преэклампсией (66,7%, р1б-3<0,001), в этих же подгруппах чаще отмечался балл по шкале Апгар 5 и ниже – 40% (р2б-3<0,001) и 23,3% соответственно (р1б-3<0,001).
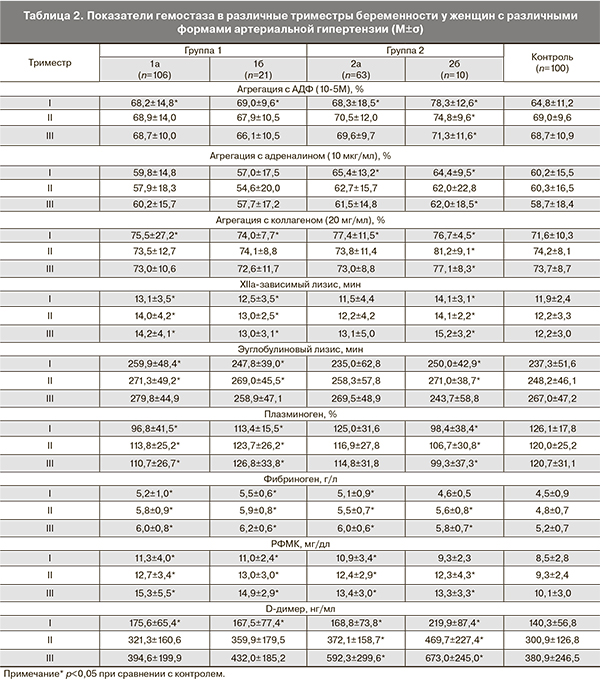
При анализе показателей гемостаза (табл. 2) более высокие показатели агрегации тромбоцитов со всеми индукторами отмечались у женщин с преэклампсией во все триместры беременности, а у женщин с различными формами хронической АГ (подгруппы 1а и 1б) – агрегация тромбоцитов с АДФ и коллагеном в I триместре беременности. У беременных с хроническими формами АГ и преэклампсией (подгруппы 1а, 1б, 2б) также наблюдалось более выраженное замедление эуглобулинового и XIIа-зависимого лизиса сгустков, а уровень плазминогена оказался ниже во все триместры беременности в сравнении с женщинами с гестационной АГ и контролем. Уровни фибриногена и РФМК были выше во всех подгруппах с АГ в сравнении с контролем во все триместры беременности. У беременных с преэклампсией (подгруппа 2б) превышение фибриногена и РФМК отмечено только со второго триместра беременности в сравнении с контролем. Наиболее высокий уровень D-димера отмечен у пациенток с преэклампсией во всех триместрах беременности с максимальным уровнем в III триместре беременности в сравнении и с контролем, и с другими подгруппами беременных с АГ.
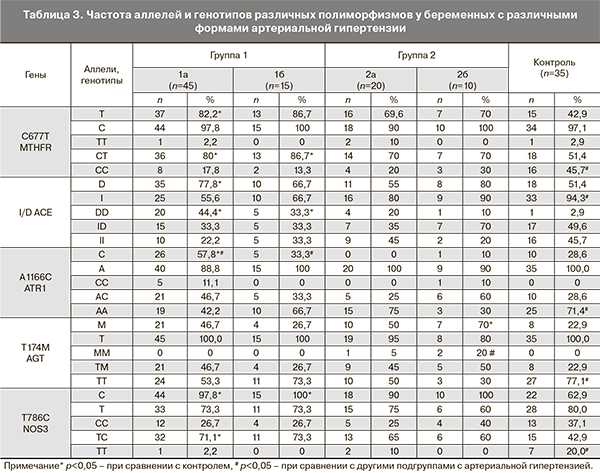
Исследование генетических полиморфизмов проведено у 45 женщин с хронической АГ (подгруппа 1а), у 15 женщин с хронической АГ и преэклампсией (подгруппа 1б), у 20 женщин – с гестационной АГ (подгруппа 2а), у 10 женщин – с преэклампсией (подгруппа 2б) и у 35 женщин в группе 3 (табл. 3). При наличии АГ (все подгруппы с АГ) повышалась вероятность наличия аллеля D гена ACE (OШ=2,32; 95% ДИ 1,04-5,20; p=0,04), генотипа TM гена T174M AGT (ОШ=2,47; 95% ДИ 1,01-6,02; p=0,048), аллеля 5G гена PAI-1 (OШ=2,77; 95% ДИ 1,02-7,55; p=0,046), а также генотипа TС гена NOS3 (ОШ=2,95; 95% ДИ 1,32-6,60; p=0,008) в сравнении с пациентками без АГ. При наличии хронической АГ (подгруппы 1а и 1б) выявлена более высокая частота встречаемости аллеля D и генотипа DD гена АПФ; аллеля C гена рецептора ангиотензиногена-II типа 1; аллеля Т и генотипа СT гена MTHFR, а также аллеля Т и генотипа TC гена NO-синтетазы в сравнении с пациентками без АГ (контролем). С преэклампсией ассоциированы аллель М и МM-генотип гена ангиотензиногена-II.
Наиболее значимыми генетическими факторами, ассоциированными с преэклампсией (ОШ≥3), в нашем исследовании оказались: TC-генотип гена эндотелиальной NO-синтетазы (ОШ=4,71; 95% ДИ 3,53-6,27; p<0,001) и CT-генотип гена метилентетрагидрофолатредуктазы (ОШ=6,12; 95% ДИ 4,44-8,43; p<0,001). Наиболее значимыми генетическими факторами, ассоциированными с синдромом задержки развития плода, были: TM-генотип гена ангиотензиногена II (ОШ=3,35; 95% ДИ 2,62-4,28; p<0,001), TC-генотип гена эндотелиальной NO-синтетазы (ОШ=5,65; 95% ДИ 4,28-7,46; p<0,001) и CT-генотип гена метилентетрагидрофолатредуктазы (ОШ=7,25; 95% ДИ 5,29-9,93; p<0,001).
С целью изучения независимой связи клинических и лабораторных факторов с АГ при беременности применен метод логистической регрессии. По результатам логистического регрессионного анализа (χ2=84,9; р<0,001) факторами, независимо ассоциированными с АГ во время беременности (группы 1, 2 и 3) в сравнении с пациентками без АГ (группа 4), были возраст (ОШ=1,15; 95% ДИ 0,99-1,33, p=0,07), индекс массы тела ≥25 кг/м2 (ОШ=1,83; 95% ДИ 1,42-2,36; p<0,001), АС-генотип ATR (A1166C) (ОШ=5,13; 95% ДИ 1,17-22,5; p=0,03) и TM-генотип AGT (T174M) (ОШ=6,72; 95% ДИ 1,57-28,07; p=0,01).
Обсуждение
В нашем исследовании у беременных с АГ чаще встречались избыточная масса тела, ожирение и курение в сравнении с беременными без АГ. При этом следует отметить, что у женщин с хронической АГ и преэклампсией в сравнении с пациентками с индуцированной беременностью АГ и без АГ чаще отмечались отягощенная наследственность не только по АГ, но и по венозным и артериальным тромбозам.
Сочетание АГ с избыточной массой тела и ожирением как компонентов метаболического синдрома может составлять дополнительную основу для развития акушерских осложнений [13, 14]. Высокая частота отягощенной наследственности по АГ и тромбозам, особенно у беременных с хронической АГ, может быть клиническим маркером генетической детерминанты АГ во время беременности.
Течение беременности у женщин с хронической АГ чаще осложнялось угрозой прерывания беременности и низким расположением хориона в I триместре беременности в сравнении с беременными без АГ. Хроническая плацентарная недостаточность и синдром задержки развития плода одинаково часто осложняли течение беременности у женщин с АГ, а в исходе беременности чаще встречались преждевременные роды и более низкие весо-ростовые показатели новорожденных, особенно с хронической АГ и преэклампсией, по сравнению с беременными без АГ. Более высокая частота вышеуказанных осложнений может быть ассоциирована с ДНК-полиморфизмами генов ренин-ангиотензиновой системы, фолатного цикла и эндотелиальной функции при различных формах АГ во время беременности.
При оценке состояния гемостаза у беременных с хронической АГ, хронической АГ и преэклампсией, а также с преэклампсией отмечалась наиболее выраженная активация тромбоцитарного и коагуляционного звеньев гемостаза в течение всей беременности по сравнению с беременными без АГ. Параллельно в этих группах отмечалось замедление фибринолитической системы на фоне сниженной активности плазминогена уже с I триместра беременности, что может быть обусловлено активацией системы ингибиторов активатора плазминогена, особенно I типа, часто ассоциирующейся с метаболическим синдромом [14].
Нами выявлены различия по спектру ДНК-полиморфизмов в генах, контролирующих ренин-ангиотензиновую систему, фолатный цикл и функцию эндотелия, в зависимости от наличия АГ и ее генеза во время беременности. У женщин с хронической АГ (подгруппы 1а и 1б) отмечена более высокая частота встречаемости аллеля D и генотипа DD гена АПФ; аллеля C гена рецептора ангиотензиногена-II типа 1; аллеля Т и генотипа СT гена MTHFR, а также аллеля Т и генотипа TC гена NO-синтетазы, в сравнении с пациентками без АГ. У беременных с преэклампсией отмечена более высокая частота встречаемости М-аллеля и ММ-генотипа гена T174M ангиотензиногена.
Изучаемые полиморфизмы также ассоциировались с акушерскими осложнениями беременности. Так, с преждевременными родами ассоциировались TC-генотип гена эндотелиальной NO-синтетазы и CT-генотип гена метилентетрагидрофолатредуктазы, а с синдромом задержки развития плода – TM-генотип гена ангиотензиногена, TC-генотип гена эндотелиальной NO-синтетазы и наиболее значимо – CT-генотип гена метилентетрагидрофолатредуктазы.
Нами была построена модель логистической регрессии, отражающая независимую ассоциацию различных клинико-лабораторных и генетических факторов с АГ во время беременности. Результаты построенной модели показали, что увеличение возраста на 1 год достоверно увеличивает шанс иметь АГ во время беременности в 1,2 раза, повышение индекса Кетле на 1 кг/м2 – в 1,8 раз, TM-генотип ангиотензина-II (T174M) – в 5,1 раза, а АС-генотип гена рецептора ангиотензина-II 1-го типа (A1166C) – в 6,7 раз.
Таким образом, выделение генетических и клинических предикторов позволяет улучшить прогнозирование развития различных форм АГ при беременности и своевременно сформировать группы риска для предупреждения ассоциированных с АГ гестационных осложнений.