Введение
Spina bifida – порок развития позвоночника, характеризующийся неполным закрытием позвоночного канала. Самыми распространенным проявлениями заболевания после рождения остаются развитие синдрома Арнольда-Киари, гидроцефалия, нарушение функции тазовых органов, а также парезы и плегии в нижних конечностях. В патогенезе развития неврологических проявлений заболевания важную роль играет не только наличие дефекта позвоночного столба, но также внутри-утробное разрушение нервных клеток под воздействием на них амниотической жидкости. В условиях НМИЦ АГП им. акад. В.И. Кулакова на сегодняшний день проводятся операции по внутриутробной коррекции spina bifida. В большинстве случаев новорожденным после внутриутробной коррекции не требуется длительное лечение в условиях ОРИТН.
Клиническое наблюдение
Женщина С., 36 лет. При проведении УЗИ во II триместре на сроке 21 нед был выявлен врожденный порок развития плода – spina bifida, отмечался специфический ультразвуковой признак мальформации Арнольда-Киари II типа: голова плода в форме лимона, а также двухсторонняя вентрикуломегалия. Было произведено пренатальное молекулярное кариотипирование на ДНК-микроматрицах, установлен нормальный женский кариотип. По результатам МРТ плода отмечалась картина опущения миндалин мозжечка в большое затылочное отверстие, сохранялась вентрикуломегалия, была локализована spina bifida posterior в пояснично-крестцовом отделе позвоночника, наиболее вероятно с формированием менингорадикулоцеле, что могло соответствовать аномалии Киари II типа. На сроке 23 нед в условиях НМИЦ АГП им. акад. В.И. Кулакова была проведена внутриутробная коррекция spina bifida. При участии детского нейрохирурга было проведено закрытие дефекта и коррекция спинномозговой грыжи. Операция прошла успешно, женщина была выписана под наблюдение домой.
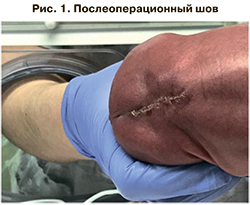 Однако на сроке 26 нед 4 дня отмечалось развитие отслойки плаценты, что послужило поводом для экстренного оперативного родоразрешения женщины путем кесарева сечения. Была извлечена живая, глубоко недоношенная девочка массой тела 992 г, длиной 35 см. Оценка по шкале Апгар – 4/6 баллов. В родильном блоке проводилась ИВЛ, потребовалось введение сурфактанта. При осмотре кожи спины в области поясницы отмечался состоятельный послеоперационный шов (рис. 1). Двигательная активность и чувствительность в нижних конечностях была сохранена, анус смыкался. В отделении состояние ребенка оставалось тяжелым за счет крайней незрелости, дыхательной и сердечно-сосудистой недостаточности.
Однако на сроке 26 нед 4 дня отмечалось развитие отслойки плаценты, что послужило поводом для экстренного оперативного родоразрешения женщины путем кесарева сечения. Была извлечена живая, глубоко недоношенная девочка массой тела 992 г, длиной 35 см. Оценка по шкале Апгар – 4/6 баллов. В родильном блоке проводилась ИВЛ, потребовалось введение сурфактанта. При осмотре кожи спины в области поясницы отмечался состоятельный послеоперационный шов (рис. 1). Двигательная активность и чувствительность в нижних конечностях была сохранена, анус смыкался. В отделении состояние ребенка оставалось тяжелым за счет крайней незрелости, дыхательной и сердечно-сосудистой недостаточности.
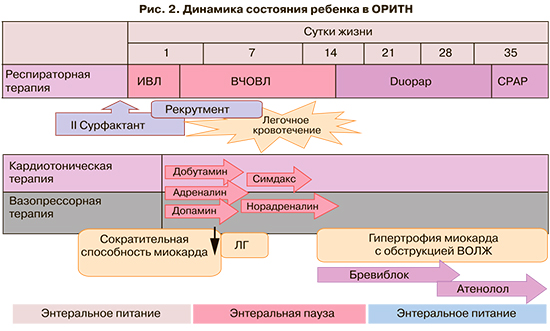
В отделении была продолжена ИВЛ, произведено повторное введение сурфактанта. Несмотря на это, потребовался перевод ребенка на ВЧОВЛ, был применен маневр рекрутмента. С первых суток жизни у ребенка отмечалась нестабильность гемодинамики в виде артериальной гипотензии, выраженного снижения сократительной способности миокарда, признаков легочной гипертензии. Кардиотоническая и вазопрессорная терапия подбирались индивидуально с учетом клинического состояния и данных динамической фокусной ЭХО-КГ. Подбиралась кардиотоническая терапия, титровалась доза добутамина 1,25%, с вазопрессорной целью проводилась инфузия допамина 4%, затем в терапию был включен адреналин 0,1%. К 3 сут жизни была проведена пошаговая смена терапии. Для начала была начата инфузия норадреналина 0,1%, направленная на повышение тонуса сосудов, нормализацию артериального давления. Затем на фоне повышения постнагрузки, принимая во внимание признаки легочной гипертензии и потребность в поддержании сократительной способности миокарада, была начата инфузия левосимендана. На фоне данной терапии удалось стабилизировать показатели гемодинамики, и к 6 сут жизни кардиотоническая и вазопрессорная терапии были завершены. На 7 сут жизни течение неонатального периода осложнилось развитием легочного кровотечения, что потребовало продолжения ВЧОВЛ с ужесточением параметров. Потребность в проведении ВЧОВЛ сохранялась до 10 сут жизни, затем ребенок был экстубирован и переведен на неинвазивную ИВЛ методом Duopap. Потребность в проведении респираторной поддержки сохранялась до 35 сут жизни (рис. 2). При проведении ультразвукового обследования на 11 сут жизни были выявлены признаки гипертрофии миокарда с утолщением межжелудочковой перегородки и с высоким внутриполостным градиентом. Была назначена терапия бета-адреноблокатором эсмололом внутривенно с коррекцией дозы под контролем ЭХО-КГ. В данном клиническом случае перевод на пероральный прием бета-блокатора атенолола был затруднен ввиду длительно сохраняющейся интолерантности к энтеральной нагрузке. Энтеральное питание ребенку было начато с 6 ч жизни в трофическом объеме, кроме этого, в первые минуты жизни ребенок получил сцеженное материнское молозиво. Однако за время наблюдения отмечались признаки дискинезии ЖКТ, что проявлялось рецидивирующими желудочными кровотечениями. Ребенок кормился исключительно грудным молоком. Лишь в возрасте 1 мес жизни впервые удалось выйти за пределы трофического объема питания, что дало возможность перевести ребенка на пероральный прием бета-блокаторов. На фоне проводимой терапии отмечалась положительная динамика размеров стенок миокарда и градиента на выносящем отделе левого желудочка. За время наблюдения по данным НСГ сохранялась вентрикулодилатация, однако значимого нарастания размеров боковых желудочков и показаний к нейрохирургическому вмешательству не было. В возрасте 40 сут жизни в постконцептуальном возрасте (ПКВ) 32 нед ребенок был переведен на второй этап выхаживания. На 87 сут жизни при достижении ПКВ 38 нед ребенок был выписан домой.
Никонец А.Д., Ионов О.В., Киртбая А.Р., Балашова Е.Н., Шмаков Р.Г., Зубков В.В.
ОРИТН им. А.Г. Антонова, НМИЦ АГП им. акад. В.И. Кулакова, Москва



