Синдром поликистозных яичников (СПЯ) ассоциирован с высоким риском репродуктивных и метаболических нарушений, которые в свою очередь могут являться факторами риска сердечно-сосудистых заболеваний. У женщин с СПЯ чаще встречаются ожирение, артериальная гипертензия, дислипидемия, нарушения углеводного обмена. Примерно у 50–70% женщин с СПЯ имеют место инсулинорезистентность и гиперинсулинемия. Было показано, что инсулин непосредственно стимулирует ряд ферментов, участвующих в стероидогенезе в яичниках – CYP 17, 3β-HSD, StAR протеина. Продемонстрированная в ряде исследований способность антимюллерова гормона (АМГ) нарушать ранний рост фолликулов и увеличение его уровней при СПЯ позволяют предполагать участие этого фактора в развитии ановуляции при СПЯ [1]. В ряде исследований было продемонстрировано, что в сыворотке крови уровни АМГ положительно коррелируют с уровнями андрогенов [2–5]. Однако в исследовании Carlsen и соавт., несмотря на прямую корреляцию между уровнями АМГ и андрогенов исходно, супрессия последних посредством назначения дексаметазона в течение 6 месяцев не сопровождалась снижением уровня АМГ [6].
Другим кандидатом на роль фактора, определяющего повышение уровня АМГ при СПЯ, является инсулин. В ряде исследований наблюдалась прямая корреляция между АМГ и нарушением чувствительности к инсулину [7, 8]. В то же время другие исследования не выявили прямой корреляции между концентрациями инсулина и АМГ [2, 4].
Ввиду того что инсулинорезистентность характерна для большинства пациенток с СПЯ, для его терапии были предложены инсулинсенситайзеры – препараты, увеличивающие чувствительность тканей к инсулину, к которым относятся бигуаниды (метформин) и тиазолидиндионы (пиоглитазон, росиглитазон). Положительный эффект метформина при СПЯ основан на смягчении влияния избытка инсулина в яичнике, а также за счет прямого действия на яичник.
Улучшая чувствительность к инсулину, метформин снижает активность CYP17. Кроме того, метформин подавляет продукцию андростендиона за счет непосредственного действия в тека-клетках яичников, также снижает ФСГ-стимулированную активность 3β-HSD, StAR протеина, CYP11A1 в клетках гранулезы крыс и женщин с СПЯ (что сопровождается снижением как базальных, так и ФСГ-стимулированных уровней эстрадиола и прогестерона). Молекулярные механизмы действия метформина непосредственно на яичник остаются невыясненными, однако в последних исследованиях было показано, что метформин увеличивает активность 5’АМФ-активируемой протеинкиназы в клетках гранулезы крыс, приводя тем самым к снижению синтеза стероидов [9].
 В последнем систематическом обзоре Cochrane 38 клиническими исследованиями было показано, что прием метформина приводит к снижению уровней андрогенов в сыворотке крови, увеличению частоты менструаций, а также овуляторных менструальных циклов [10]. В систематическом обзоре и мета-анализе рандомизированных контролируемых исследований, сравнивавших пиоглитазон и метформин, было показано, что эффект данных препаратов на гликемию натощак, уровень тестостерона, количество баллов по шкале Ферримана–Голлвея достоверно значимо не отличался, однако прием метформина сопровождался более выраженным снижением массы тела [11].
В последнем систематическом обзоре Cochrane 38 клиническими исследованиями было показано, что прием метформина приводит к снижению уровней андрогенов в сыворотке крови, увеличению частоты менструаций, а также овуляторных менструальных циклов [10]. В систематическом обзоре и мета-анализе рандомизированных контролируемых исследований, сравнивавших пиоглитазон и метформин, было показано, что эффект данных препаратов на гликемию натощак, уровень тестостерона, количество баллов по шкале Ферримана–Голлвея достоверно значимо не отличался, однако прием метформина сопровождался более выраженным снижением массы тела [11].
В исследовании Carlsen и соавт. снижение концентрации инсулина в результате терапии не сопровождалось параллельным снижением концентрации АМГ [6]. В то же время Fleming и соавт. показали, что концентрация АМГ незначительно, однако достоверно значимо снижается через 8 месяцев терапии метформином [12]. В исследовании Piltonen и соавт. прием метформина также приводил к небольшому, но достоверно значимому снижению уровня АМГ через 6 месяцев терапии [13].
Цель исследования – оценить клиническую эффективность препарата редуксин мет («Промомед», Россия) на уровень АМГ, углеводный и липидный обмены у пациенток с СПЯ и метаболическим синдромом.
Материал и методы исследования
Проводилось местное, открытое, с активным контролем, в параллельных группах исследование по изучению клинической эффективности, безопасности и переносимости препарата редуксин мет («Промомед», Россия) у женщин в репродуктивном периоде с СПЯ и метаболическим синдромом.
Обследованы 60 женщин с СПЯ и верифицированным метаболическим синдромом. Нарушенная толерантность к глюкозе (НТГ) была диагностирована у всех пациенток. Диагноз СПЯ устанавливался на основании критериев консенсуса ESHRE/ASRM, 2003 г. [14]. С целью исключения врожденной дисфункции коры надпочечников при наличии уровней 17-гидроксипрогестерона (17ОНП) ≥5 нмоль/л проводили анализ наиболее частых мутаций гена CYP21 методом аллель-специфической полимеразной цепной реакции. Наличие овуляции устанавливали на основании фолликулометрии и по уровню прогестерона >16 нмоль/л в лютеиновой фазе менструального цикла [15]. Перед началом участия в исследовании все пациентки подписали форму информированного согласия.
Всем пациентам в течение двух недель отменялась сахаропонижающая терапия, после чего определялся исходный уровень нарушений углеводного обмена и соответствие критериям включения и исключения. Больные, ранее не получавшие сахаропонижающей терапии, отмывочный период не проходили.
Пациентки 1-й группы (20 человек) с СПЯ и верифицированным метаболическим синдромом получали редуксин мет («Промомед», Россия) (сибутрамина гидрохлорида моногидрат 10 мг + целлюлоза микрокристаллическая капс. + метформина гидрохлорид 850 мг таб.) по 1 таблетке и 1 капсуле однократно, ежедневно, перорально 3 месяца. Пациенткам 2-й группы (20 человек) назначался метформина гидрохлорид – сиофор («Берлин-Хеми», Германия) в дозе 850 мг/сутки.
Пациенткам 3-й группы (20 человек) назначалось стандартная «модификация образа жизни». Оценка исследуемых параметров проводилась исходно и через 3 месяца лечения.
В связи с тем, что пациентки находились в репродуктивном возрасте, они были предупреждены о необходимости использования надежных методов контрацепции на протяжении всего периода приема препаратов.
Всем пациенткам проводилось комплексное обследование, включавшее оценку антропометрических данных (индекс массы тела (ИМТ) вычислялся по формуле: масса тела, кг/рост, м2; рассчитывалось соотношение объема талии к объему бедра (ОТ/ОБ)), гирсутизма по шкале Ферримана–Голлвея, алопеции по шкале Людвига, ультразвуковое исследование (УЗИ) органов малого таза (определялся объем яичника как среднее объема обоих яичников), а также исследование концентрации гормонов в сыворотке крови. Определяли уровни 17-ОНП, общего тестостерона (Т), сексстериодсвязывающий глобулин (СССГ), дегидроэпиандростерона сульфата (ДГАс), пролактина и тиреотропного гормона (ТТГ) в сыворотке крови методом хемилюминесцентного иммуноанализа на аппарате «Immulite 2000» с использованием диагностических наборов «Siemens Medical Solutions Diagnostics». Забор крови для гормонального анализа проводился в 8.00 на 3–7-й день менструального цикла, уровень прогестерона определяли в лютеиновую фазу цикла или же при отсутствии ультразвуковых признаков овуляции в любой день. Индекс свободных андрогенов (ИСА) рассчитывали по формуле: ИСА=общий Т/СССГх100. Уровень АМГ в сыворотке крови определяли иммуноферментным методом с использованием наборов фирмы BECKMAN COULTER, США. Уровень гликированного гемоглобина (HbA1c%) определялся с помощью жидкостной хроматографии под давлением (нормальный уровень – 4,5–6,2%).
Содержание общего холестерина (ОХС) и триглицеридов (ТГ) в сыворотке крови определяли иммуноферментными методами. Содержание холестерина липопротеинов низкой плотности (ЛПНП) и холестерина липопротеинов очень низкой плотности (ЛПОНП) рассчитывали по формуле W.T. Friedewald и соавт. (1972). Для оценки атерогенных свойств крови использовали холестериновый индекс атерогенности, предложенный А.Н. Климовым (1977). Гиперлипидемию выявляли с помощью критериев Американской ассоциации сердца (1994) и критериев, содержащихся в рекомендациях ВОЗ (1995, 1998). Тип гиперлипидемии определялся с использованием классификации, предложенной D. Fredrickson и соавт. (1967) и одобренной ВОЗ (J. Beaumont и соавт., 1970). Риск прогрессирования сосудистых осложнений сахарного диабета в зависимости от уровня липидов крови выявлялся с помощью критериев European Diabetes Policy Group (1998).
Лабораторно-инструментальные исследования выполнялись в лабораториях ФБГУ ЭНЦ МЗ РФ.
Критерии исключения: беременность, лактация, индивидуальная непереносимость метформина, гиперпролактинемия; гипотиреоз; другие эндокринные или системные заболевания, потенциально оказывающие влияние на физиологию репродукции человека, прием лекарственных препаратов, способных нарушать нормальную функцию оси гипоталамус-гипофиз-яичники, а также метформина, в течение 6 месяцев, предшествующих исследованию, заболевания печени и почек, артериальная гипертония 3-й степени (АД 180/11 мм рт. ст.), симптоматические артериальные гипертензии, ишемическая болезнь сердца, острое нарушение мозгового кровообращения или преходящее нарушение мозгового кровообращения в анамнезе, сахарный диабет 1-го типа, инсулинотерапия, курение, сопутствующие заболевания, требующие дополнительной терапии и затрудняющие оценку эффективности переносимости препарата, креатинин сыворотки крови 200 мкмоль/л и выше, калий сыворотки крови более 5,0 ммоль/л, а также наличие противопоказаний к приему исследуемых препаратов в соответствии с инструкцией по медицинскому применению.
Критерии безопасности: все пациентки прошли динамическое обследование: осмотр гинеколога, УЗИ органов малого таза (первый визит, 3 месяца), УЗИ молочных желёз и/или маммография (первый и последний визиты), коагулограмма (в начале исследования, через 3 месяца); лабораторные критерии безопасности (через 2 недели и 3 месяца терапии).
В ходе исследования регистрировались все нежелательные явления: фиксировалось время их развития, продолжительность, связь с лечением, исход.
Все отклонения в лабораторных анализах были интерпретированы.
Критерии оценки переносимости:
- отличная – отсутствие побочных эффектов и отклонений в лабораторных анализах;
- хорошая – появление кратковременных побочных эффектов легкой степени или незначимых отклонений в лабораторных анализах, не требующее коррекции лечения;
- удовлетворительная – развитие умеренно тяжелых побочных эффектов или значимых отклонений в лабораторных анализах, требующее коррекции лечения;
- плохая – развитие среднетяжелых или тяжелых побочных эффектов или значимых отклонений в лабораторных анализах, требующих отмены препарата.
Оценка эффективности сахаропонижающего действия препаратов оценивалась по дневникам самоконтроля и уровню HbA1c%. В дневниках самоконтроля анализировался показатель гликемии в течение суток. До и через 3 месяца терапии всем больным проводился пероральный глюкозо-толерантный тест (ПГТТ).
Статистический анализ осуществляли с помощью пакета программ Statistica 6.0 (StatSoftInc). Количественные показатели представлялись в виде среднего значения ± стандартное отклонение. Изменения количественных показателей на фоне лечения оценивали при помощи критерия Вилкоксона. Сравнение количественных показателей в группах осуществляли при помощи U-теста Манна–Уитни. Для изучения взаимосвязи между количественными показателями применяли метод ранговой корреляции Спирмена.
Результаты исследования и обсуждение
Возраст пациенток составил от 22 до 35 лет (средний возраст 28,7±5,2 года); ИМТ – 32,5±1,3 кг/м2; ОТ – 98,5±2,3 см.
Концентрация АМГ достоверно значимо коррелировала с длительностью менструального цикла (r=4,5; p<0,001), а также с объемом яичника (r=3,7; p<0,001).
На фоне приема препаратов редуксин мет, сиофор, а также модификации образа жизни отмечалось снижение ИМТ, OТ/ОБ (p<0,05), снижение концентрации Т, а также ИСА (р<0,01), более выраженное в группе, получавшей редуксин мет (р<0,01). Снижение ИМТ в группе пациенток, получавших редуксин мет, к 3-му месяцу наблюдения составило 8,4%; в группе пациенток, получавших сиофор – 5,8%; в группе модификации образа жизни – 6%. ОТ в группе пациенток, получавших редуксин мет, к 3-му месяцу наблюдения уменьшилась в среднем на 8,2±0,5 см (р<0,01); в группе пациенток, получавших сиофор – на 5,0±0,8 см (р<0,01); в группе модификации образа жизни – на 6,1±0,6 см (р<0,01).
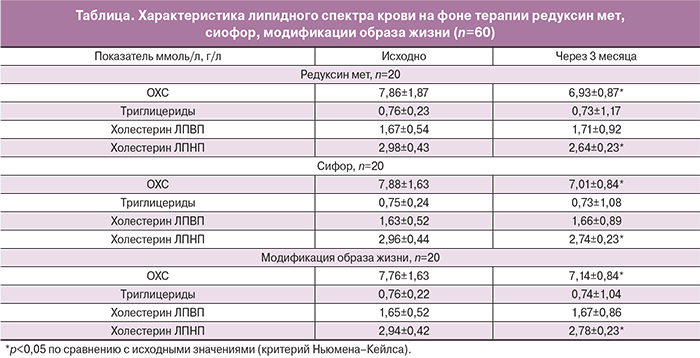
На фоне терапии препаратом редуксин мет значения АМГ снизились с 8,8±1,6 исходно до 5,4±1,2 нг/мл через 3 месяца терапии (p<0,01), что составило 39% исходных значений; на фоне терапии препаратом сиофор – с 8,1±1,8 исходно до 6,9±1,6 нг/мл через 3 месяца терапии, что составило 15% (p<0,01); в группе модификации образа жизни значения АМГ не изменились: 8,6±1,2 исходно, через 3 месяца – 8,4±1,4 нг/мл (p<0,5) (рисунок). Данные изменения сопровождались уменьшением объема яичника, который в группе редуксина мет исходно составил 18,9±2,7 мл, после окончания лечения – 11,7±2,7 мл (p<0,01), что составило снижение на 38% исходных значений; в группе сиофора исходно – 17,9±1,9 мл, после окончания лечения – 16,7±2,6 мл (p<0,01), что составило 7%; в группе модификации образа жизни объем яичника не изменился: исходно – 19,2±1,5 мл, через 3 месяца терапии – 18,9±2,4 мл (p<0,01) .
На фоне проводимой терапии нежелательных явлений со стороны медикаментозных препаратов выявлено не было. У 4 пациенток в начале терапии препаратом редуксин мет появились жалобы на сухость в ротовой полости и снижение аккомодации, исчезнувшие самостоятельно на 15–21-й день приема препарата.
Данные нашего исследования согласуются с данными Romualdi и соавт., которые также отметили снижение уровня АМГ у женщин с гиперинсулинемией на фоне терапии метформином, что позволяет сделать вывод о том, что монотерапия метформином однозначно влияет на уровень АМГ и овуляторную дисфункцию через инсулин-опосредованные механизмы [16, 17].
При сравнительном анализе показателей липидного обмена у 46 (77%) женщин с метаболическим синдромом была выявлена гиперлипидемия IIа типа, уровень ОХС составил в среднем 7,01±1,86 ммоль/л. Также была выявлена положительная корреляционная зависимость между длительностью заболевания и уровнем ОХС в сыворотке крови: чем больше длительность заболевания, тем выше уровень данного показателя.
Последующий анализ показателей липидного обмена у 77% женщин с метаболическим синдромом выявил умеренную положительную статистически значимую корреляционную зависимость между уровнями ОХС и HbA1C (r=0,53; р<0,001); а также между холестерином ЛПНП и HbA1C (r=0,62; р<0,001). При этом у 69% женщин повышение уровня HbA1C коррелировало с увеличением содержания ОХС в сыворотке крови и холестерина ЛПНП.
Необходимо отметить, что гиперлипидемия IIа типа выявлялась у 46 (77%) женщин с метаболическим синдромом. Уровень ОХС для данной подгруппы составил 6,85±0,93 ммоль/л; а холестерина ЛПНП – 5,13±1,75 ммоль/л. В связи с вышеперечисленным, содержание HbA1C имело умеренную статистически значимую корреляционную взаимосвязь с уровнем ОХС (r=0,48, p<0,05); сильную статистически значимую корреляцию с уровнем холестерина ЛПВП (r=0,84, p<0,05, p<0,01); а также умеренную корреляцию с высоким содержанием холестерина ЛПНП (r=0,53, p<0,01).
Как видно из таблицы, использование препарата редуксин мет приводило к статистически значимому снижению уровня ОХС и холестерина ЛПНП через 3 месяца приема. Таким образом, редуксин мет способствует нормализации липидного спектра крови через 3 месяца использования за счет уменьшения уровня ОХС и его атерогенных фракций.
Анализ показателей углеводного обмена выявил, что до начала исследования у 60 (100%) пациенток выявлялась НТГ; через 3 месяца терапии препаратом редуксин мет и метформином показатели углеводного обмена соответствовали критериям здорового человека, выявленные в рамках проведения ПГТТ. В группе модификации образа жизни на фоне снижения ИМТ на 6% показатели углеводного обмена улучшились лишь у 8 (40%) пациенток; у 12 (60%) пациенток через 3 месяца наблюдения верифицировалась НТГ.
При этом работ, проводящих анализ влияния сибутрамина в сочетании с метформином на вышеуказанные показатели, ни в отечественной, ни в зарубежной литературе мы не встретили. Поэтому данное исследование «пилотное» и требует проведения дальнейшего изучения, а именно оценки циркадного ритма ЛГ на фоне препаратов центрального действия в сочетании с активаторами глюконеогенеза. Однако гипотеза о том, что снижение уровня АМГ является следствием снижения только ИМТ, нам не кажется убедительной ввиду того, что при проведении исследования в группе женщин «здорового образа жизни» было выявлено снижение ИМТ, которое, однако, не сопровождалась уменьшением концентрации АМГ и объема яичника. Кроме того, некоторыми зарубежными исследователями также ранее было показано, что снижение ИМТ не приводит к уменьшению уровня АМГ [18]. Наилучшие результаты были продемонстрированы в группе женщин, получавших препарат редуксин мет («Промомед», Россия), обладающий сочетанным механизмом действия за счет того, что содержит два отдельных лекарственных средства в одной упаковке: гипогликемическое средство для перорального применения группы бигуанидов в лекарственной форме таблетки – метформин, и средство для лечения ожирения в лекарственной форме капсулы, содержащее в своем составе сибутрамин и целлюлозу микрокристаллическую.
Пероральный гипогликемический препарат из группы бигуанидов снижает гипергликемию, не приводя к развитию гипогликемии; в отличие от производных сульфонилмочевины, не стимулирует секрецию инсулина и не вызывает гипогликемического эффекта у здоровых лиц; повышает чувствительность периферических рецепторов к инсулину и утилизацию глюкозы клетками. Метформин тормозит глюконеогенез в печени; задерживает всасывание углеводов в кишечнике; стимулирует синтез гликогена, воздействуя на гликогенсинтазу; увеличивает транспортную емкость всех типов мембранных переносчиков глюкозы. Кроме того, препарат оказывает благоприятный эффект на метаболизм липидов: снижает содержание ОХС, ЛПНП и ТГ. При этом на фоне монотерапии приема метформина масса тела пациента либо остается стабильной, либо умеренно снижается.
Сибутрамин же является пролекарством и проявляет свое действие in vivo за счет метаболитов (первичных и вторичных аминов), ингибирующих обратный захват моноаминов (серотонина, норадреналина и дофамина). Увеличение содержания в синапсах нейротрансмиттеров повышает активность центральных 5НТ-серотониновых и адренергических рецепторов, что способствует увеличению чувства насыщения и снижению потребности в пище, а также увеличению термопродукции. Опосредованно активируя β3-адренорецепторы, сибутрамин воздействует на бурую жировую ткань. Снижение массы тела сопровождается увеличением концентрации в сыворотке крови липопротеинов высокой плотности (ЛПВП) и понижением количества ТГ, ОХС, ЛПНП и мочевой кислоты. Сибутрамин и его метаболиты не влияют на высвобождение моноаминов, не ингибируют моноаминооксидазу: не обладают сродством к большому числу нейромедиаторных рецепторов, включая серотониновые (5-HT1, 5-HT1А, 5-HT1B, 5-НТ2C), адренергические (β1, β2, β3, α1, α2), допаминовые (D1, D2), мускариновые. гистаминовые (H1), бензодиазепиновые и глутаматные NMDA-рецепторы. Благодаря своему механизму действия сибутрамин не вызывает привыкания и синдрома отмены. А целлюлоза микрокристаллическая является энтеросорбентом, обладает сорбционными свойствами и неспецифическим дезинтоксикационным действием. Связывает и выводит из организма различные микроорганизмы, продукты их жизнедеятельности, токсины экзогенной и эндогенной природы, аллергены, ксенобиотики, а также избыток некоторых продуктов обмена веществ и метаболитов, ответственных за развитие эндогенного токсикоза.
Одновременное применение метформина и сибутрамина с целлюлозой микрокристаллической увеличивает терапевтическую эффективность используемой комбинации на углеводный, липидный обмены, а также уровень АМГ у пациентов с избыточной массой тела и сахарным диабетом 2-го типа, а по данным нашего исследования – и у пациенток с СПЯ в сочетании с метаболическим синдромом и имеющейся НТГ.
Исходя из вышеизложенного, необходимо проведение дальнейших исследований, которые позволят прояснить, является снижение концентрации АМГ в процессе терапии сибутрамином в сочетании с метформина гидрохлоридом (препарат редуксин мет, «Промомед», Россия) маркером эффективности не только в отношении уровня АМГ, но и овариальной дисфункции.



