В условиях пандемии новой коронавирусной инфекции важное научное и практическое значение приобретают исследования влияния COVID-19 на репродуктивное здоровье женщин. Особый научный интерес представляют исследования воздействия вируса SARS-CoV-2 на оогенез и эмбриогенез человека. Установлена высокая экспрессия белковых рецепторов к SARS-CoV-2 (ACE2, TMPRSS2, CD147) в гранулезных и эпителиальных клетках яичников, тека-клетках и лютеиновых клетках [1]. Предполагается, что SARS-CoV-2 может оказывать негативное влияние, проникая в ткани яичников и ооциты посредством данных рецепторов [2]. На животных моделях показано, что экспрессия и активность ACE2 повышается в матке и в плаценте во время беременности [3]. На основании этого репродуктивные органы рассматриваются в качестве потенциальных мишеней SARS-CoV-2.
Проведены единичные научные исследования, в которых изучалось влияние COVID-19 на репродуктивную систему женщин, но при этом получены противоречивые данные [4–7]. Также недостаточно данных, доказывающих потенциальную возможность заражения эмбрионов человека SARS-CoV-2 через ооциты и вертикальной передачи инфекции от матери плоду во время беременности [8–10]. COVID-19 может увеличивать риск таких осложнений беременности, как самопроизвольные выкидыши и преждевременные роды. Частота преждевременных родов у беременных женщин с COVID-19 была выше, чем у женщин без COVID-19 и составляла от 11,5% [11] до 17% [12]. Частота раннего самопроизвольного выкидыша у беременных женщин, инфицированных SARS-CoV-2 в I триместре, достигала 14% и была выше, чем у неинфицированных женщин (8%) [13]. Показано, что на частоту осложнений (выкидыши, преждевременные роды) могут оказывать влияние возраст женщин и тяжесть течения COVID-19 [14].
Исследований по оценке исходов программ ВРТ в зависимости от COVID-19 также недостаточно. В метаанализе 2022 г. не было отмечено влияния коронавирусной инфекции на результаты программ вспомогательных репродуктивных технологий (ВРТ) [15]. Тогда как в другом исследовании наблюдалась тенденция негативного влияния перенесенного COVID-19 на выход яйцеклеток в программах ВРТ [16]. Показано, что постковидный синдром ассоциируется с осложнениями со стороны сердечно-сосудистой системы, хронической усталостью, неврологическими нарушениями [17]. Одним из проявлений этого синдрома могут быть нарушения репродуктивной функции, приводящие к снижению фертильности и невынашиванию беременности [18]. Таким образом, изучение репродуктивной функции у женщин, перенесших COVID-19, является важной и актуальной задачей.
В связи с вышеизложенным, цель настоящего исследования: оценить исходы программ ВРТ у пациенток, перенесших COVID-19 разной степени тяжести.
Материалы и методы
Исследование было проведено на базе ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России. Всего в проспективное обсервационное исследование были включены 240 пациенток с бесплодием. Пациентки были стратифицированы на 2 группы в зависимости от наличия COVID-19 в анамнезе: группа 1 – пациентки, не болевшие COVID-19 (n=105), группа 2 – пациентки, перенесшие COVID-19 (n=135) за 12 и менее месяцев до вступления в программу ВРТ. Группа 2 была дополнительно стратифицирована на 2 подгруппы: подгруппа 2а – пациентки, перенесшие COVID-19 в легкой форме (n=85), подгруппа 2б – пациентки, перенесшие COVID-19 в среднетяжелой форме (n=50).
Критериями включения явились: возраст 18–40 лет, нормальный овариальный резерв (антимюллеров гормон (АМГ)≥1,2 нг/мл, фолликулостимулирующий гормон (ФСГ))<12 мМЕ/мл, количество антральных фолликулов (КАФ)≥5 в обоих яичниках), перенесенный COVID-19 за 12 и менее месяцев до вступления в программу ВРТ для пациенток группы 2. Критериями невключения явились: вакцинация от COVID-19 в анамнезе, противопоказания к ВРТ, морбидное ожирение (индекс массы тела ≥40,0 кг/м2), донорские программы, программа суррогатного материнства, ВИЧ-инфекция.
Данные о перенесенном COVID-19 получали со слов пациенток, подтверждали информацией, внесенной в ЕГИСЗ, и дополнительным определением уровня IgG к SARS-CoV-2 в сыворотке крови выше индекса позитивности (ИП). Критерием легкой формы COVID-19 была субфебрильная температура (<38°С) при отсутствии клинических проявлений среднетяжелого течения инфекции. В качестве критериев среднетяжелой формы COVID-19 учитывали наличие температуры выше 38°С, одышки при физической нагрузке, признаков пневмонии с минимальным или средним объемом поражения легких (КТ 1–2), отсутствие клинических проявлений тяжелого течения инфекции [19].
Все пациентки были обследованы в соответствие с клиническими рекомендациями «Женское бесплодие» (2021) [20].
Для определения антител к SARS-CoV-2 в сыворотке крови использовали «Набор реагентов для выявления антител класса G к spike белку SARS-CoV-2 методом иммуноферментного анализа» («ДС-ИФА-АНТИ-SARS-CoV-2-G(S)», производства НПО «Диагностические системы» (Россия)), предназначенный для качественного выявления антител в сыворотке (плазме) крови человека методом иммуноферментного анализа (ИФА). Результат анализа оценивали по величине ИП, рассчитанного по формуле: ИП=ОП образца/Cut-off, где ОП образца – значение оптической плотности образца. Результат считался положительным при значении ИП>1,2, отрицательным – при значении ИП <0,8, сомнительным (неопределенным) – при значении ИП в диапазоне от 0,8 до 1,2.
Проведение овариальной стимуляции осуществляли по протоколу с использованием антагонистов гонадотропин-рилизинг-гормона (ант-ГнРГ), рекомбинантного ФСГ (рФСГ) и/или препаратов, содержащих лютеинизирующий гормон (ЛГ): комбинированного препарата рФСГ/рЛГ или человеческого менопаузального гонадотропина. Пациенткам, перенесшим COVID-19, овариальную стимуляцию проводили через 6 (2–9) месяцев после заболевания. При этом индивидуально подбирали дозу гонадотропинов с учетом возраста, анамнеза и параметров овариального резерва. Введение гонадотропинов осуществлялось со 2–3-го дня менструального цикла, ант-ГнРГ вводили по достижении диаметра лидирующего фолликула 14 мм ежедневно до дня введения триггера овуляции (включительно), когда диаметр лидирующего фолликула достигал 19 мм. В качестве триггера овуляции применяли хорионический гонадотропин (ХГ) (8000–10 000 МЕ) однократно или комбинацию ХГ с агонистом гонадотропин-рилизинг-гормона (а-ГнРГ). Трансвагинальную пункцию (ТВП) фолликулов проводили через 36 ч после введения триггера овуляции под контролем ультразвукового исследования (УЗИ).
Оценка аспирированной фолликулярной жидкости осуществлялась эмбриологом с использованием стереомикроскопа. Определялось число полученных ооцит-кумулюсных комплексов (ОКК), после проведения денудирования ооцитов оценивалась их степень зрелости. Параллельно проводилось центрифугирование, флотирование и обработка спермы партнера. Оплодотворение всех зрелых ооцитов осуществлялось с помощью метода экстракорпорального оплодотворения (ЭКО) или интрацитоплазматической инъекции сперматозоида в ооцит (ИКСИ). Нормальное оплодотворение регистрировали по наличию двух симметричных по размеру пронуклеусов в цитоплазме через 16–18 ч после оплодотворения. После оплодотворения зиготы переносили в культуральную среду (COOK, Австралия) для дальнейшего культивирования. Через 120–122 ч (на 5-е сутки) культивирования проводилась морфологическая оценка эмбрионов с учетом морфологических характеристик эмбрионов по классификации Гарднера: степени зрелости бластоцист, качества трофэктодермы и внутриклеточной массы [21].
На 5-е сутки культивирования осуществляли перенос одного или двух эмбрионов в полость матки с использованием мягкого катетера в стимулированном цикле. Для поддержки посттрансферного периода назначалось вагинальное введение микронизированного прогестерона (600 мг в день) или пероральный прием дидрогестерона (30 мг в день).
Наступление беременности определялось по сывороточному уровню β-ХГ через 14 дней после переноса эмбрионов в полость матки. При уровне β-ХГ, превышающем 20 МЕ/л, тест на беременность считали положительным. Через 21 день после переноса эмбрионов при визуализации плодного яйца в полости матки с помощью УЗИ регистрировали клиническую беременность.
Статистический анализ
Для анализа полученных данных применяли пакет статистических программ Statistica 10 (США). При оценке качественных данных рассчитывали доли (%). Для сравнения категориальных данных и оценки значимости различий использовали тест χ2. Вид распределения количественных данных в группах определяли с помощью теста Колмогорова–Смирнова и графического анализа данных. При нормальном распределении данные были представлены средней арифметической и стандартным отклонением (M (SD)). При распределении данных, не соответствующем нормальному, применяли методы непараметрической статистики: определение медиан с интерквартильным размахом (Mе (Q25–Q75)), тесты Манна–Уитни и Краскела–Уоллиса для сравнения данных в несвязанных совокупностях. Для оценки корреляционной зависимости между переменными рассчитывали коэффициент корреляции Спирмена. Для сравнения бинарных данных определяли отношение шансов (ОШ) с 95% доверительным интервалом (95% ДИ). Метод логистической регрессии применяли при расчете ОШкор для контроля конфаундеров. Различия между статистическими величинами считали статистически значимыми при уровне р<0,05.
Результаты
Средний возраст пациенток в двух группах составлял 34 года, ¼ часть пациенток были позднего репродуктивного возраста (37 лет и старше) (табл. 1). Анализ клинико-анамнестических данных показал, что пациентки, перенесшие COVID-19, отличались от не болевших пациенток более высоким индексом массы тела (ИМТ), большей долей женщин, принимающих алкоголь, большей частотой заболеваний ЛОР-органов и аллергических заболеваний. У пациенток двух групп с высокой частотой диагностировались эндокринные заболевания (>20%).
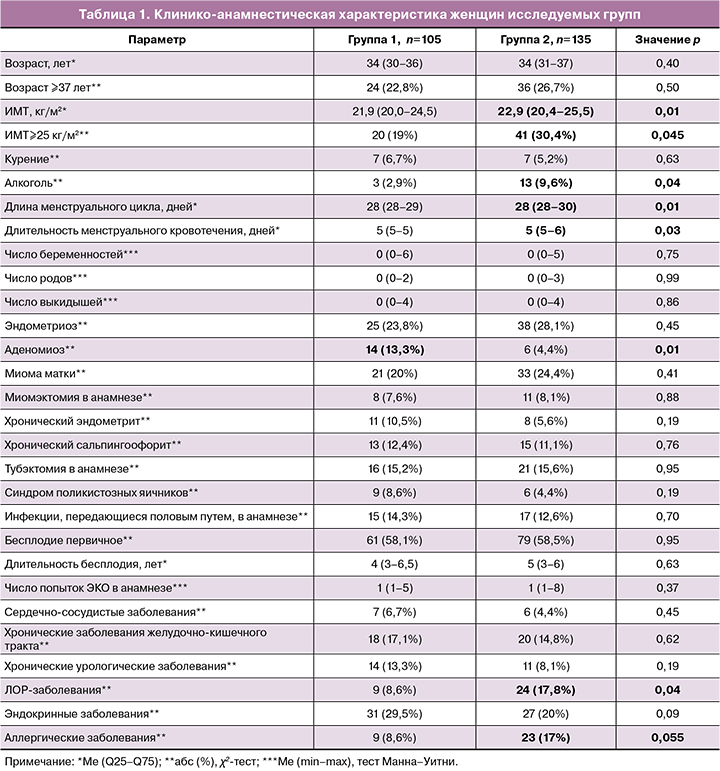
Женщины в группах 1 и 2 не различались по среднему числу беременностей, родов и выкидышей, а также по частоте выкидышей (3/105(2,9%) и 9/135(6,7%); p=0,18). Женщины группы 2 имели значимо большую длину менструального цикла и длительность менструального кровотечения. Среди гинекологических заболеваний наиболее часто у женщин обеих групп диагностировались эндометриоз и миома матки (≥20%); значимо реже в группе 2 выявлялись хронический эндометрит, сальпингоофорит и синдром поликистозных яичников (p<0,01). Анализ гинекологической заболеваемости показал, что группы 1 и 2 значимо различались только по частоте выявления аденомиоза, который диагностировался в группе 1 чаще, чем в группе 2.
Использованные схемы и длительность назначения препаратов для овариальной стимуляции не различались в сравниваемых группах. Данные сперматогенеза, оогенеза и раннего эмбриогенеза представлены в таблице 2. Не было выявлено разницы в доле пациентов с любыми формами патоспермии. Параметры оогенеза и эмбриогенеза были сопоставимы по абсолютным и относительным показателям у пациенток в двух группах и подгруппах группы 2, хотя в группе 1 отмечались несколько более высокие значения показателей зрелых ооцитов и отношения зрелых ооцитов к общему числу ооцитов. Доля ИКСИ была высокой в группах 1 и 2, что было обусловлено большим числом пар с патоспермией у партнера, соответственно у 72/105 (68,6%) и 86/135 (63,7%) (p=0,43).

При определении специфических противовирусных антител в сыворотке крови пациенток с помощью ИФА и расчете ИП, средние значения ИП составляли в группах 1 и 2 соответственно 0,16 (0,13) и 6,8 (4,1). В группе 2 ИП антител был значимо выше, чем в группе 1 (p<0,001). Была проанализирована корреляционная связь между уровнем специфических противовирусных антител и параметрами оогенеза и эмбриогенеза у пациенток (табл. 3). Была выявлена значимая отрицательная корреляционная связь слабой силы между уровнем специфических противовирусных антител и числом полученных ооцитов, зрелых ооцитов, зигот и бластоцист, т.е. у пациенток с более высоким уровнем антител наблюдалось меньшее число полученных ооцитов и эмбрионов.
Также у пациенток, перенесших COVID-19, был проведен анализ зависимости параметров оогенеза и эмбриогенеза от величины интервала времени от болезни до ТВП. В соответствии с показателем интервала времени от COVID-19 до ТВП пациентки были разделены на 2 подгруппы: 1-я подгруппа – с интервалом более 180 дней (n=50); 2-я подгруппа – c интервалом 180 дней и менее (n=85).
Показано, что у пациенток, перенесших COVID-19 давностью менее 6 месяцев до ТВП, параметр отношения числа бластоцист плохого качества (категория С) к общему числу бластоцист значимо выше, чем у пациенток с большим временным интервалом до ТВП. Установлена обратная корреляционная связь между этим показателем и фактором времени (величиной интервала от заболевания COVID-19 до ТВП) с r=-0,22 (р=0,01).
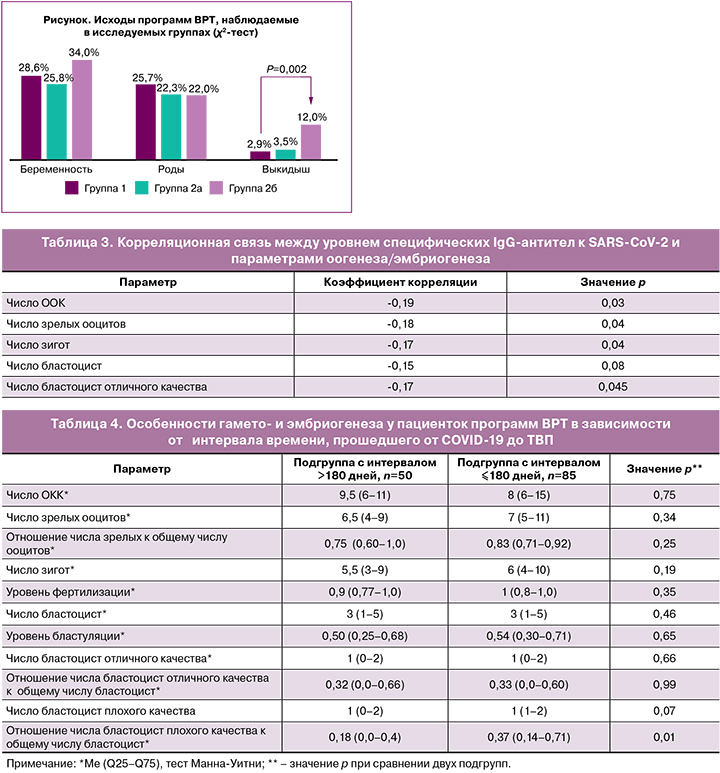
При анализе исходов программ ВРТ было выявлено, что частота наступления беременности и частота родов значимо не различались в группе 1 и подгруппах 2а и 2б (рисунок). Важно отметить, что в подгруппе 2б у пациенток, перенесших COVID-19 в среднетяжелой форме, отмечалась самая высокая частота самопроизвольных прерываний беременности до 12 недель. При этом все 6 выкидышей в подгруппе 2б произошли при одноплодных беременностях, в подгруппе 2а один выкидыш был при двухплодной и два – при одноплодной беременности. Значение ОШ развития выкидыша в подгруппе 2б по сравнению с группой 1 составило 2,1 (95% ДИ 1,05–4,4). При учете аденомиоза в качестве конфаундера значение ОШ развития выкидыша в подгруппе 2б по сравнению с группой 1 составило 2,2 (95% ДИ 1,07–4,7).
Обсуждение
Имеющиеся в научной литературе данные в большей степени предполагают отсутствие негативного влияния COVID-19 на исходы программ ВРТ [5, 15, 22]. Об этом также свидетельствуют исследования, в которых сравнивались результаты программ ВРТ в доковидный и ковидный периоды [23, 24]. Однако также имеются публикации, в которых обсуждается возможное негативное влияние перенесенной инфекции на репродуктивную функцию женщин [18]. Одним из механизмов такого влияния может быть психологический стресс, испытанный женщинами в период пандемии. По данным популяционного исследования, в период пандемии у 46% опрошенных женщин отмечается нарушение менструального цикла, а у 53% опрошенных – усиление предменструальных симптомов [25]. Youngster M. et al. (2022) по результатам исследования сделали предположение о том, что выход ооцитов в программах ВРТ может зависеть от временного фактора, т.е. периода времени, прошедшего после перенесенного COVID-19 [16]. Хотя коронавирусная инфекция, вызванная SARS-CoV-2, не влияла на результаты лечения, включая выход яйцеклеток, оплодотворение, скорость созревания и частоту клинической беременности в циклах ВРТ, наблюдалась возможность отсроченного негативного влияния инфекции на выход яйцеклеток.
Постковидный синдром (long-covid) ассоциируется со многими осложнениями, включающими различную сердечно-сосудистую патологию, хроническую усталость, неврологические нарушения [17]. Одним из проявлений этого синдрома могут быть нарушения репродуктивной функции, проявляющиеся в снижении фертильности и невынашивании беременности [18]. Описаны отдельные случаи снижения качества яйцеклеток и функции яичников после заражения COVID-19, а также случаи развития бесплодия или преждевременной недостаточности яичников у фертильных пациенток молодого возраста после перенесенного COVID-19 [26, 27].
Показано, что COVID-19, перенесенный во время беременности, увеличивает риск самопроизвольного выкидыша. Частота раннего самопроизвольного выкидыша у беременных с COVID-19 выше в 1,7 раза, по сравнению с неинфицированными женщинами [13]. На частоту осложнений (выкидыши, преждевременные роды) может оказывать влияние возраст женщин и тяжесть течения COVID-19 [14]. Женщины с выраженными симптомами заболевания, особенно в возрасте старше 35 лет, имеют тенденцию к более высокой частоте осложнений беременности.
В нашем исследовании были получены результаты, согласующиеся с упомянутыми выше данными. Было выявлено, что параметры оогенеза, эмбриогенеза, частота наступления беременности и частота родов не различались в группах у пациенток, переболевших и не болевших COVID-19. Однако отмечалась статистически значимая слабая отрицательная корреляционная связь между уровнем специфических противовирусных антител и числом полученных ооцитов, зигот и бластоцист, что предполагает наличие обратной зависимости между напряженностью специфического противовирусного иммунного ответа, который в значительной степени определяется тяжестью заболевания, и выходом ооцитов и эмбрионов в программе ВРТ.
Полученные результаты согласуются с недавно опубликованными данными Herrero Y. et al. (2022), согласно которым в группе женщин с высоким уровнем специфических противовирусных антител наблюдалось более низкое число полученных и зрелых ооцитов, по сравнению с группой женщин с низким уровнем или отсутствием этих антител [28]. В данном исследовании показано присутствие антител к SARS-CoV-2 в фолликулярной жидкости у переболевших COVID-19 женщин, изменение ее состава, в частности снижение интерлейкина (IL)-1β и сосудисто-эндотелиального фактора роста (VEGF), и возможное влияние фолликулярной жидкости на экспрессию белков в клетках гранулезы. Предполагается, что инфекция SARS-CoV-2 отрицательно влияет на микроокружение фолликулов и, тем самым, нарушает регуляцию функции яичников.
Важно отметить, что выявленная в настоящем исследовании значимая обратная корреляционная связь между показателем отношения числа бластоцист плохого качества к общему числу бластоцист и интервалом времени, прошедшим с момента COVID-19 до ТВП, также свидетельствует о негативном влиянии вируса SARS-CoV-2 на ооциты, эмбрионы и их качество и имеет важное значение для решения вопроса о сроках вступления в программу ВРТ женщин, перенесших COVID-19 в тяжелой форме.
Кроме того, результаты настоящего исследования показывают, что при ведении беременности у пациенток, перенесших COVID-19 в среднетяжелой форме за 12 и менее месяцев до беременности, важно учитывать более высокий риск самопроизвольного прерывания беременности на ранних сроках по сравнению с женщинами, не болевшими COVID-19, что может быть связано, в частности, с активацией аутоиммунных процессов в постковидном периоде.
Заключение
Таким образом, COVID-19, перенесенный менее чем за 12 месяцев до наступления беременности, особенно в среднетяжелой форме, может оказывать негативное влияние на репродуктивные исходы, повышать риск самопроизвольного прерывания беременности на ранних сроках, приводить к получению меньшего числа ооцитов, эмбрионов в программах ВРТ и снижению качества ооцитов в раннем постковидном периоде. Перенесенный COVID-19 давностью менее 6 месяцев ассоциируется с повышением доли бластоцист плохого качества. Для изучения механизмов этого негативного влияния новой коронавирусной инфекции и постковидного синдрома необходимо проведение дальнейших исследований.



