Высокое потребление кальция особенно важно в первые два десятилетия жизни человека, когда масса кальция тела увеличивается до максимального. В последующие годы абсорбция кальция относительно скромна, и потребление кальция снижается, чтобы свести к минимуму вероятность минерализации скелета [1]. Остеотропные минералы необходимы для формирования коллагенового матрикса, который удерживает кальций в костной ткани и останавливает его возрастную потерю. Отмечено участие цинка в синтезе щелочной фосфатазы крови, меди в синтезе коллагена и эластина в достижении препятствия деминерализации костей [2]. Соотношение маркеров костной резорбции и синтеза позволяет судить о состоятельности синтеза и ремоделирования костного матрикса. Взаимодействие кальция с коллагеновыми фибриллами дополняется участием ионов фосфора, влияющих на активность костно-формирующих и костно-резорбирующих клеток, созревание остеоцитов, продукцию фактора роста фибробластов. Среди микроэлементов кальций (Ca) и фосфор (P) являются двумя основными составляющими, усиливающими механическую устойчивость костной матрицы. Кость содержит около 99% и 80% всей массы тела Ca и P соответственно, соотношение массы Ca/P составляет 2,2. Ключевой дуэт для поддержания минералов кости на протяжении всей жизни контролируется транспортными и гормональными системами, которые служат обеспечению надлежащего снабжения Ca и P для здоровья костей [3].
Гипокальциемия ассоциируется не только с гипокалиефосфатемией, но и дефицитом магния. Последний до 53% концентрируется в костной ткани. Регулирует обмен магния и играет существенную роль в поддержании катионного гомеостаза соотношения Ca2+/Mg2+ чувствительный к концентрации катионов рецептор (ген CASR) – G-белок–связанный рецептор плазматической мембраны, который экспрессируется в паращитовидной железе и в почечных канальцах [4]. Дефекты в этом гене связаны как с гипер-, так и с гипокальциемией [5]. Активация гена CASR Ca2+/Mg2+–чувствительного рецептора уменьшает активность белковой киназы А, что приводит к уменьшению фосфорилирования клаудина-16 и его транслокации в лизосомы, а в результате – к уменьшению реабсорбции магния в почечных канальцах [6, 7].
Дефицит магния в соединительной ткани приводит к замедлению синтеза всех структурных молекул (включая протеогликаны, гликозаминогликаны, коллаген и эластин). Поскольку синтез структурных молекул, столь необходимых для восстановления («ремонта») соединительной ткани, замедляется, то процессы восстановления также тормозятся, и это приводит к ухудшению механических характеристик ткани. Трансглутаминаза – фермент, формирующий поперечные глутамин–лизиновые сшивки, соединяющие вместе цепи эластина, активизируется Ca2+ и ингибируется Mg2+ [8, 9].
Ремоделирование костной ткани невозможно без участия ионов кальция, магния, цинка, уровни которых в плазме крови необходимо определять у пациентов с риском остеопороза.
Каждая третья женщина и один из двенадцати мужчин в возрасте старше 55 лет страдают от остеопороза [10]. Это заболевание является одной из основных проблем общественного здравоохранения, поскольку частота переломов бедра, запястья и позвонков, связанных с потерей костной ткани, высока. Наиболее уязвимыми оказываются женщины в постменопаузе, имеющие ускоренную потерю костной массы в менопаузе и более низкое содержание минералов в костях в сравнении с мужчинами. Вместе с тем, недостаточное потребление и сниженная абсорбция кальция в кишечнике у них с возрастом служат более раннему манифесту остеопороза [11, 12]. Для пациенток с наследственными нарушениями соединительной ткани (ННСТ), в геноме которых определяются мутации генов, ответственных за синтез или распад белков экстрацеллюлярного матрикса (коллаген различных типов, фибриллин, тенаскин), рецепторов ростовых факторов, матриксных металлопротеиназ, доказана сниженная секреторная функция желудочно-кишечного тракта, что способствует замедленной абсорбции кальция [13, 14].
Низкое содержание кальция в диете наряду с врождённой дефектностью коллагенового матрикса, синдромом Марфана, несовершенным остеогенезом, мышечной дистрофией, сколиозом считается фактором риска развития остеопороза [15, 16, 17]. Развитие пиковой костной массы и скорость ее потери определяется эндогенными и экзогенными факторами, обусловливающими многофакторность патогенеза остеопороза [18].
Наибольшую значимость имеет дефицит витамина D, который сопровождается нарушением проницаемости клеточных мембран и процессов пролиферации в тканях, активацией фосфолипаз и увеличением концентрации ионизированного кальция.
К факторам риска развития остеопороза относится также гипогонадизм, аменорея, преждевременная менопауза, гиперпролактинемия, семейный анамнез остеопороза, предшествующие переломы, склонность к падениям и низкая минеральная плотность костной ткани. Многие исследования выявили, что эстрогены замедляют скорость потери костной массы и уменьшают частоту переломов, играют значительную роль в регуляции генов, участвующих в транспортировке кальция из кишечника и почечных канальцев, поэтому эффективность заместительной терапии эстрогенами документально подтверждена. Важно, что эти эффекты могут быть независимыми от системы витамина D. Вместе с тем онконастороженность при использовании эстрогенов вызывает беспокойство.
В связи с вышеизложенным актуальность изучения остеопороза у женщин остается важным аспектом. Представленная работа посвящена указанной проблеме.
Материал и методы исследования
В исследовании приняли участие 159 женщин, из них 122 женщины репродуктивного возраста (18–24 года). Средний возраст 22,93±3,86 года в 1-й группе, 22,33±2,15 года во 2-й группе; 22,54±3,52 и 21,44±3,16 года в 3-й и 4-й группе. Группа 1 (n=35) – пациентки с наследственными нарушениями соединительной ткани (ННСТ) и расстройствами менструаций с менархе (РМ), группа 2 (n=35) – пациентки с ННСТ и физиологическим ритмом менструаций (ФМ), группа 3 (n=32) – пациентки без ННСТ и с ФМ, группа 4 (n=20) – пациентки без ННСТ и с РМ с менархе. В постменопаузе исследовано 37 женщин. Группа 1 (n=20) – пациентки с признаками ННСТ в течение жизни, группа 2 (n=17) – пациентки без признаков ННСТ. Средний возраст 52,44±2,56 и 53,32±2,22 года, достоверно не различался между собой. Методы исследования включали в себя клинические и лабораторные с определением биохимических параметров в плазме крови уровней кальция, магния, щелочной фосфатазы.
Пациенткам в постменопаузе проводилась остеоденситометрия. Уровень –2SD (стандартного отклонения от пиковой костной массы) расценивался как маркер остеопении 1-й степени. Пациентки дали информированное согласие на обследование. Статистическая обработка полученных результатов проводилась с использованием методов вариационной статистики и критерия Стьюдента при уровне значимости p<0,05; 0,001; 0,0001.
Проведение научно-исследовательской работы разработано в соответствии с Хельсинкской декларацией Всемирной ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ от 19.06.2003 г. № 266.
Результаты исследования и обсуждение
При исследовании уровня кальция отмечено, что каждая четвертая пациентка с ННСТ (25,6%) имела гипокальциемию в молодом репродуктивном возрасте. Наименьший уровень кальция (M±m) выявлен у пациенток 1-й группы (2,28±0,09 ммоль/л), тогда как во 2-й, 3-й, 4-й группах (p<0,05) уровень был достоверно выше соответственно (2,35±0,17, 2,3±0,07, 2,34±0,11 ммоль/л). Магниево-кальциевое соотношение в сыворотке крови оказалось наименьшим (p<0,01) у пациенток в 1-й и 2-й группе (0,30 и 0,32), а в 3-й и 4-й группах в 1,2 раза выше (0,35 и 0,36).
Уровень магния в сыворотке крови у молодых пациенток (M±m) в 1-й и 2-й группе составил 0,72±0,07 и 0,78±0,05 ммоль/л соответственно и оказался ниже нормативных в сравнении с пациентками 3-й и 4-й группы (0,82±0,05 и 0,81±0,04 ммоль/л). Магниевый дефицит превышал (p<0,05) у пациенток 1-й группы в 3,7 раза (61,5%), 2-й группы в 1,4 раза (45,5%) таковой показатель в 3-й группе (16,6%), а в 4-й группе отсутствовал.
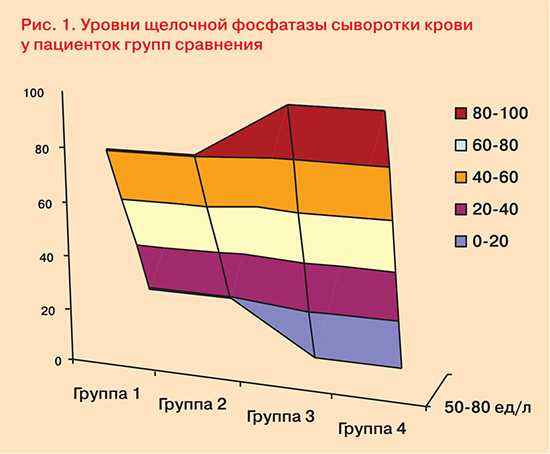
Медианы щелочной фосфатазы сыворотки крови в 1-й и 2-й группе составили соответственно 52 и 57 Ед/л, в 3-й и 4-й группе 64 и 61,5 Ед/л. Установлено, что в 1-й и 2-й группе среди молодых женщин 19,6 и 19,2% имели уровни фермента ниже 50,0 Ед/л. В целом, отмечено более низкое содержание щелочной фосфатазы, в состав которой входят ионы цинка, у подавляющего числа пациенток с ННСТ (рис. 1).
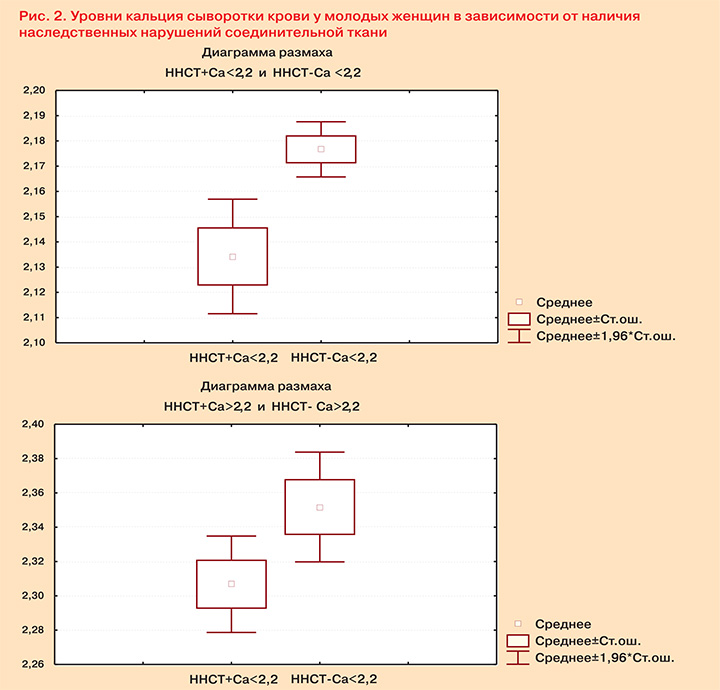
Анализ данных позволил выявить низкие значения уровней кальция сыворотки крови менее референсных у большей части пациенток 1-й и 2-й группы, имевших ННСТ (рис. 2). Вместе с тем, более высокие значения кальция наблюдались у пациенток, не имевших соединительнотканных нарушений.
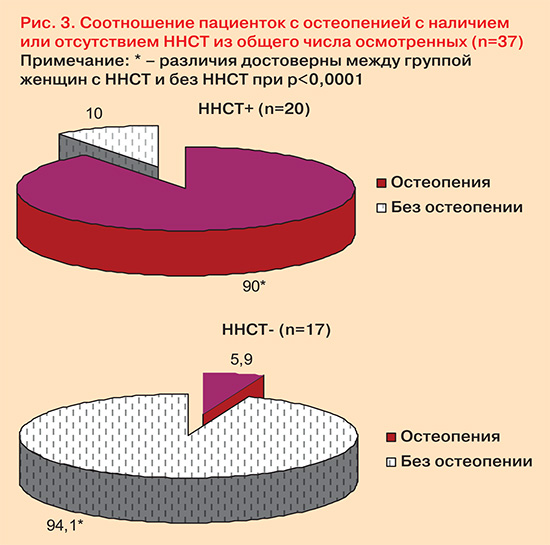
В ходе исследования установлено, что у пациенток после наступления менопаузы, имевших в анамнезе ННСТ, по результатам остеоденситометрии более чем в 15 раз чаще (p<0,0001) имелись признаки остеопении в сравнении c не имевшими соединительнотканных нарушений (рис. 3). Важнейшей составляющей процессов костного метаболизма в течение жизни женщины является обеспеченность кальцием и минералами, способствующими его усвоению и накоплению. При нарушении механизмов образования костной ткани, которые наблюдаются у пациентов с наследственными нарушениями соединительной ткани, существует более высокий риск раннего развития остеопороза.
Низкие значения кальция, магния, цинка сыворотки крови уже с раннего репродуктивного возраста позволяют отнести таких пациенток в группу высокого риска по развитию остеопороза.
В этом случае женщины с наступлением менопаузы, имеющие повышенный риск развития остеопороза, должны получать профилактические дозы препаратов, содержащих кальций в сочетании с остеотропными минералами.
Заключение
Таким образом, для процессов костного ремоделирования необходимы минералы, участвующие в основных его этапах. Применение препаратов кальция способствует восполнению его дефицита в костной ткани с наступлением менопаузы, что благотворно влияет на кальциевый метаболизм и качество жизни пациенток группы высокого риска по развитию остеопороза.
Список литературы находится в редакции.



