Цервикальная слизь образует барьер между влагалищем и маткой, и основная ее функция – защита верхних отделов половых путей от микробной инвазии. Кроме защитной функции, цервикальная слизь выполняет функцию смазки и, ввиду высокого содержания углеводов, может служить источником энергии и питательным субстратом для резидентных бактериальных популяций влагалища и цервикального канала.
Основными компонентами слизистых гелей, включая цервикальную слизь, являются муцины – большие сильно гликозилированные гликопротеины. Считается, что углеводные боковые цепи защищают протеиновое ядро от протеолитических ферментов. Муцины продуцируются бокаловидными клетками слизистых оболочек и подслизистых желез. Кроме муцинов, слизистые гели содержат неорганические соли, антимикробные компоненты, такие как лизоцим, лактоферрин, иммуноглобулины.
Муциназы – это ферменты, продуцируемые некоторыми микроорганизмами и вирусами и способные деградировать муцин. Основную группу муциназ составляют гликозидазы, к числу которых относится наиболее хорошо изученный фермент сиалидаза, или нейраминидаза. Сиалидаза отщепляет терминальный остаток сиаловой кислоты от гликановой цепи, тем самым модулируя различные клеточные процессы, как физиологические, так и патологические. Так, некоторые резидентные бактерии в норме продуцируют небольшие уровни муциназ, способствуя тем самым нормальному процессу обновления слизи [1]. В то же время, частичная или полная деградация молекул муцина муциназами часто является критическим шагом в разрушении защитных барьеров слизистой оболочки.
Муциназная активность микроорганизмов и вирусов, как фактор патогенеза различных инфекций изучается уже несколько десятилетий, однако исследования в основном сосредоточены на инфекциях желудочно-кишечного и респираторного трактов. Информация о роли муциназ бактерий влагалища в патогенезе инфекций репродуктивного тракта фрагментарна и недостаточна. Между тем, продукция вагинальными бактериями муциназ может быть одним из основных микробиологических факторов восходящей инфекции [2, 3], способной приводить к тяжелым заболеваниям репродуктивного тракта женщины – воспалительным заболеваниям органов малого таза (ВЗОМТ), бесплодию, внематочной беременности. При беременности восходящая инфекция может быть причиной невынашивания и преждевременных родов.
Слизистые поверхности урогенитального тракта женщины особенно богаты сиалогликанами. Сиалидазы некоторых бактерий могут активно удалять эти концевые остатки на поверхности слизистых, тем самым способствуя колонизации [4]. В качестве основных продуцентов муколитических ферментов во влагалище рассматриваются, главным образом, бактерии, ассоциированные с бактериальным вагинозом (БВ), ключевую роль в патогенезе которого играют бактерии рода Gardnerella [5]. Полагают, что гарднереллы используют сиалидазу для разрушения и истощения компонентов слизи влагалища [5]. Род Gardnerella до недавнего времени включал единственный вид – G. vaginalis. Однако, принимая во внимание значительное биотипическое разнообразие G. vaginalis, в том числе, в отношении продукции сиалидазы, предпринимались многочисленные попытки генотипирования этих бактерий, в том числе, с применением методов высокопроизводительного секвенирования. В 2019 г. был проведен полногеномный анализ последовательности для 81 геномов гарднерелл, в результате чего в дополнение к виду G. vaginalis были описаны новые виды – G. swidsinskii, G. leopoldii и G. piotii [6]. Ввиду высокого сходства последовательностей 16SрРНК (98,5%), в настоящее время виды гарднерелл идентифицируют с помощью секвенирования гена шаперонина 60 кДа [7].
До недавнего времени считалось, что активность сиалидазы Gardnerella spp. связана с геном сиалидазы А, позднее получившего название nanH1. Недавно у гарднерелл были обнаружены еще две сиалидазы – NanH2 и NanH3 [4]. Это исследование показало, что NanH2 и NanH3 по сравнению с NanH1 более эффективны в расщеплении сиаловых кислот на субстратах слизистой оболочки. Далее, наличие гена сиалидазы nanH1 не всегда было связано с регистрируемой сиалидазной активностью [4].
Целью данной работы было исследование сиалидазной активности бактерий влагалища и определение сиалидазных генотипов и фенотипов различных видов Gardnerella spp.
Материалы и методы
Культуральное исследование образцов отделяемого влагалища
В работе использовали образцы отделяемого влагалища, полученные у женщин репродуктивного возраста в НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта в 2021–2022 гг. Клинический материал инокулировали на агар Шедлера, предназначенный для культивирования факультативных анаэробов и анаэробов, и инкубировали в течение 48 ч при температуре 37°C и 5% концентрации СО2 в анаэростате с использованием газ-пакетов (AnaeroGen, Oxoid, Великобритания).
С целью очистки колонии всех морфотипов, выросшие на агаре Шедлера, трижды рассевали методом истощающего мазка и идентифицировали методом масс-спектрометрии (MALDI-TOF MS, Bruker Daltonics, Германия). Данный метод позволяет идентифицировать микроорганизмы, основываясь на сравнении общего масс-спектра белков с базой данных эталонных штаммов. В коллекцию отбирали только те штаммы бактерий, для которых была отмечена высокая достоверность идентификации (значение показателя силы сходства спектров исследуемого и эталонного штаммов было больше 2,000). Идентифицированные штаммы суспендировали в 1,5 мл триптон-соевого бульона, замораживали и хранили при температуре -80°C. Всего было получено 89 штаммов бактерий от 45 женщин (1–3 штамма от каждой женщины).
Полуколичественный анализ сиалидазной активности вагинальных бактерий
Для полуколичественного анализа сиалидазной активности вагинальных бактерий разработали модификацию методики Robinson L.S. et al. (2019) [4]. Перед анализом бактериальные культуры размораживали и при необходимости концентрировали центрифугированием до оптической плотности 1,0 при 620 нм. В качестве флуоресцентного субстрата использовали 100 mM раствор ацетата натрия, содержащий 300 μМ 2-(4-метилумбеллиферил)-α-D-N-ацетилнейраминовой кислоты (MUAN) (Sigma-Aldrich, США). В лунки микропланшета для флюоресценции вносили по 80 мкл 100 мM раствора ацетата натрия, содержащего 300 мкМ MUAN. Далее добавляли в лунки по 20 мкл суспензии исследуемого бактериального штамма и по 20 мкл каждого разведения положительного контроля, в качестве которого использовали сиалидазу Clostridium perfringens (Sigma-Aldrich, США) в концентрациях 0,001 ед/мкл (К1, 0,02 ед/реакция), 0,0005 ед/мкл (К2, 0,01 ед/реакция), 0,00025 ед/мкл (К3, 0,005 ед/реакция), 0,000125 (К4, 0,0025 ед/реакция). Для отрицательного контроля использовали 100 mM раствор ацетата натрия. Микропланшет инкубировали при 37°С в течение 1 ч, после чего визуализировали результаты реакции в трансиллюминаторе (VilberLourmat, Франция) с применением программы VisionCapt (VilberLourmat, Франция). Результаты анализа регистрировали на основе сравнения интенсивности флуоресценции исследуемых штаммов и контролей. Положительные контроли условно соответствовали сильно выраженной (++++), выраженной (+++), умеренной (++) и слабо выраженной (+) сиалидазной активности (К1-4, соответственно).
Выделение геномной ДНК из культур Gardnerella spp.
Для выделения ДНК из культур Gardnerella spp. с целью последующей идентификации вида и сиалидазного генотипа использовали коммерческие наборы для экстракции ДНК АмплиПрайм ДНК-сорб-АМ («ИнтерЛабСервис», Россия). Культуры Gardnerella spp. размораживали, после чего выделяли ДНК по рекомендованному производителем протоколу.
Идентификация видов Gardnerella spp. и определение их сиалидазных генотипов
Видовую идентификацию Gardnerella spp. проводили с применением секвенирования гена шаперонина cpn60 [8] по Сэнгеру в системе генетического анализа Beckman Coulter, США. Вначале амплифицировали ген cpn60 методом полимеразной цепной реакции (ПЦР) с использованием набора реагентов Tersus plus PCR kit («Евроген», Россия) и праймеров H729 (5’-CGCCAGGGTTTTCCCAGTCACGACGAIIIIGCIGGIGAYGGIACIACIAC-3’) и H730 (5’-AGCGGATAACAATTTCACACAGGAYKIYKITCICCRAAICCIGGIGCYTT-3’) («Евроген», Россия) в следующем режиме термоциклирования: 94°C – 5 мин.; 94°C – 30 с., 50°C – 30 с., 72°C – 45 с. (40 циклов); 72°C – 10 мин. [9]. Анализ полученных ампликонов осуществляли методом электрофореза в 1% агарозном геле в течение 40 минут. Выделение ДНК из ПЦР смеси проводили с применением наборов реагентов AMPure (Beckman Coulter) в соответствии с протоколом производителя. Секвенирующую ПЦР проводили в термоциклере PalmCycler (Corbett Research, Австралия) с использованием каждого секвенирующего праймера (последовательности секвенирующих праймеров H729-М13 и H730-М13 подчеркнуты) с применением набора реагентов DTCS QuickStart kit (Beckman Coulter) в соответствии с протоколом производителя со следующими параметрами циклирования: 96°C – 20 сек., 50°C – 20 сек., 60°C – 4 мин. (30 циклов). Продукты ПЦР очищали с применением наборов реагентов CleanSeq (Beckman Coulter) в соответствии с протоколом производителя. Капиллярный электрофорез проводили в генетическом анализаторе Beckman Coulter. С применением программы Investigator (Beckman Coulter) получали консенсусную последовательность, которую затем анализировали в базе данных cpnDB (https://www.cpndb.ca/).
Характеристика сиалидазных генотипов Gardnerella spp.
Анализ штаммов Gardnerella spp. на наличие генов nanH1, nanH2 и nanH3 проводили методом ПЦР с использованием праймеров и условий, разработанных Robinson L.S. et al. (2019) [4] (табл.1). Для ПЦР амплификации использовали набор реагентов Tersus plus PCR kit («Евроген») и термоциклер Терцик («ДНК-Технология», Россия).

Разделение полученных ампликонов проводили в 2% агарозном геле. Результаты визуализировали с помощью гель-документирующей системы Infinity (VilberLourmat, Франция).
Результаты
Коллекция вагинальных бактерий состояла из 89 штаммов и включала представителей 42 видов 18 родов. Все штаммы были проанализированы полуколичественным методом на выраженность сиалидазной активности (рисунок). Все штаммы Gardnerella spp. и сиалидазо-положительные культуры других бактериальных видов были протестированы повторно, все результаты полностью воспроизвелись.
Подавляющее количество штаммов коллекции (81 штамм из 89 исследованных) не обладали сиалидазной активностью (табл. 2). Сиалидазную активность выявили у 8 штаммов, принадлежащих трем родам – Anaerococcus (n=1), Bifidobacterium (n=1), Gardnerella (n=6). Среди 3 выделенных штаммов Anaerococcus spp. 2 штамма идентифицированы как A. tetradius (в прошлом Peptostreptococcus tetradius) и 1 – как A. vaginalis (в прошлом P. vaginalis). Сиалидазная (слабовыраженная) активность была отмечена у одного из двух A. tetradius; A. vaginalis был сиалидаза-отрицательным. Род Bifidobacterium был представлен видами B. bifidum, B. breve, B. dentium и B. longum. Умеренная сиалидазная активность была выявлена только у штамма B. bifidum. Из 19 штаммов Gardnerella spp. 6 штаммов обладали сиалидазной активностью: 1 –выраженной, 2 – умеренно выраженной, 3 –слабо выраженной.
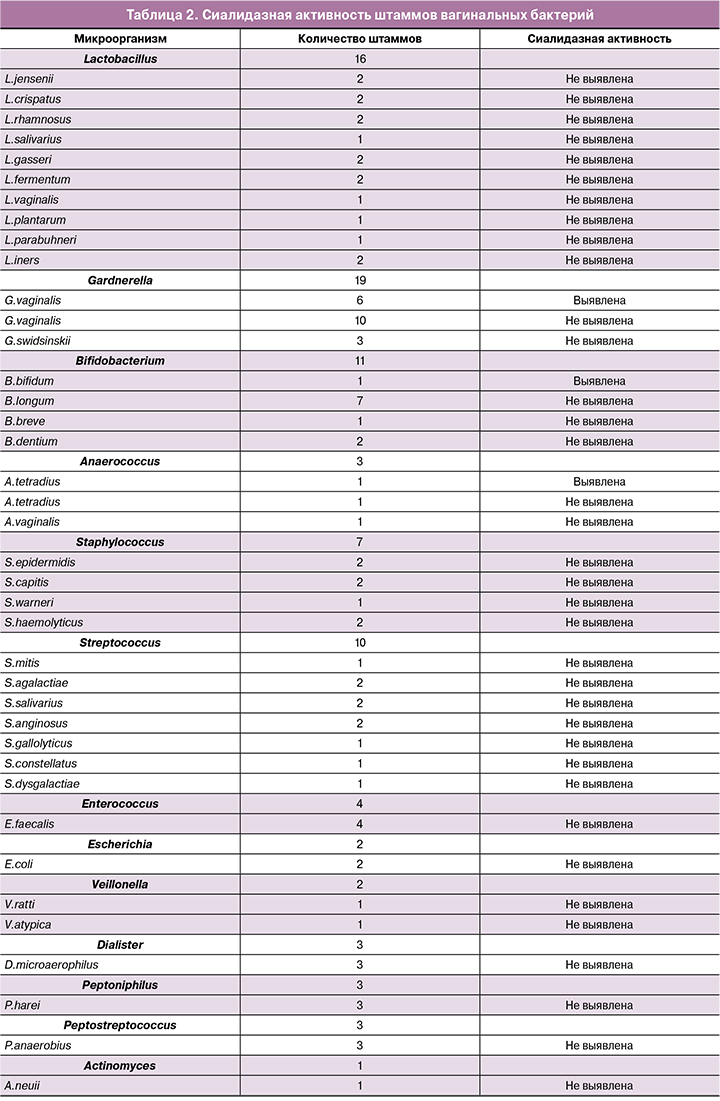
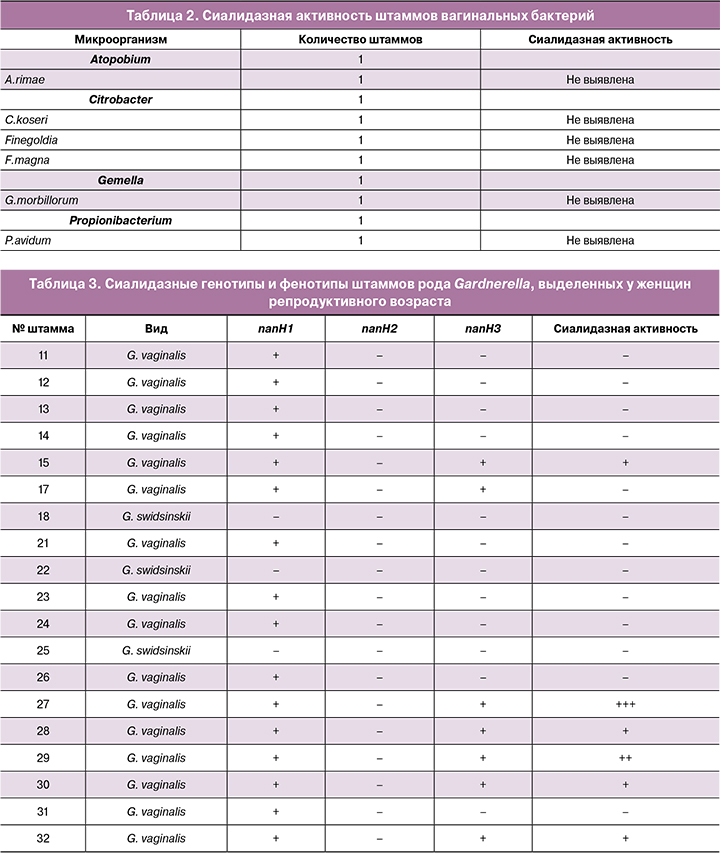
Секвенирование гена cpn60 позволило определить видовую принадлежность штаммов гарднерелл. Три штамма (16%; 95% доверительный интервал 4–40%) были идентифицированы как G. swidsinskii, остальные 16 (84%; 95% доверительный интервал 60–96%) – как G. vaginalis. Все 19 штаммов Gardnerella spp. были проанализированы на наличие генов сиалидаз nanH1, nanH2 и nanH3, и результаты анализа были сопоставлены с результатами теста на сиалидазную активность (табл. 3). Ни один из трех штаммов G. swidsinskii не обладал генами сиалидаз, и все 3 штамма были сиалидаза-отрицательными. У 9 штаммов G. vaginalis был выявлен только ген nanH1, все эти штаммы также не проявляли сиалидазной активности. У остальных 7 штаммов G. vaginalis были выявлены одновременно гены nanH1 и nanH3, при этом у 6 штаммов была зарегистрирована сиалидазная активность, у 1 штамма – нет.
Обсуждение
Способность некоторых микроорганизмов и вирусов ферментировать гликаны (в первую очередь, сиалогликаны) как фактор инфекционного процесса, в наибольшей степени изучена на инфекциях респираторного и желудочно-кишечного трактов. В случае респираторных инфекций подавляющее большинство работ сфокусировано на сиалидазе вирусов гриппа. Применительно к кишечным инфекциям, данная ферментативная способность описана у представителей доминирующих в кишечной микробиоте типов Bacteroidetes, Actinobacteria, Firmicutes. В то время как некоторые кишечные бактерии используют гликаны муцина только в качестве сайтов адгезии, другие бактерии, помимо этого, утилизируют их как питательный субстрат [10].
Способность большинства штаммов бактерий типа Bacteroidеtes ферментировать гликаны достаточно хорошо охарактеризована [11, 12]. К числу Bacteroidеtes относятся бактериальные виды широко представленных в микробиоте человека (включая вагинальную микробиоту) родов Bacteroides, Porphyromonas и Prevotella. Геномные и функциональные исследования показывают, что бактероиды отдают предпочтение не простым углеводам, а сложным, включая гликаны муцинов [13].
В то же время показано, также на примере кишечной микробиоты, что большинство бактерий типа Firmicutes предпочитают усвоение более простых, а не сложных углеводов [14]. Применительно к вагинальной микробиоте, к Firmicutes относятся лактобациллы – доминирующие бактерии нормальной микробиоты влагалища. Некоторые виды Lactobacillus spp. наделены белками, связывающими муцин [13], но у них, по-видимому, отсутствует какой-либо механизм его утилизации. В данной работе мы впервые, на целом ряде штаммов различных видов вагинальных лактобацилл показали, что эти бактерии не обладают сиалидазной активностью. Тип Firmicutes включает также стрептококки, стафилококки, энтерококки и бактерии порядка Clostridiales. Мы также не выявили сиалидазной активности у штаммов стрептококков, стафилококков и энтерококков. Необходимо отметить, что ряд патогенных и условно патогенных фирмикут, например, сиалидаза-продуцирующие Streptococсus pneumoniae, используют механизм ферментации гликанов для адгезии к эпителию респираторного или кишечного трактов [15]. Clostridiales в нашей коллекции были представлены бактериями родов Veillonella, Dialister Peptoniphilus, Peptostreptococcus и Anaerococcus. Из 3 штаммов Anaerococcus spp. (2 штамма A. tetradius и 1 A. vaginalis) сиалидазную активность проявил один из двух штаммов A. tetradius, штамм A. vaginalis был сиалидаза-отрицательным. Бактерии A. tetradius до недавнего времени классифицировались как Peptostreptococcus tetradius, и в одной из ранних работ имели отрицательный сиалидазный фенотип [12]. Вероятно, не все штаммы этого вида имеют гены сиалидаз, или гены сиалидаз имеют индуцируемую, а не конститутивную экспрессию.
Способность утилизировать гликаны также присуща нескольким представителям типа Actinobacteria, к числу которых относятся бактерии семейства Bifidobacteriaceae. Bifidobacteriaceae включают такие широко представленные в микробиоте человека бактерии, как Bifidobacterium spp. – симбионтные кишечные бактерии, доминирующие в кишечной микробиоте грудного ребенка, и Gardnerella spp., выявляющиеся в вагинальной микробиоте как здоровых женщин (в небольшом количестве), так и женщин с БВ (как доминантный вид). В предыдущих исследованиях наибольшую сиалидазную активность выявили у B. bifidum [16], также было показано, что этот вид содержит большой набор муциназ, включая сиалидазу [17]. В нашей коллекции вагинальных бактерий бифидобактерии были представлены видами B. bifidum, B. breve, B. dentium и B. longum, и сиалидазная активность была выявлена только у штамма B. bifidum.
В данном исследовании 3 из 19 штаммов гарднерелл были идентифицированы как G. swidsinskii, остальные 16 – как G. vaginalis. Все 3 штамма G. swidsinskii были отрицательными на гены сиалидаз и, соответственно, на сиалидазную активность. У 9 штаммов G. vaginalis был выявлен только ген nanH1, и все эти штаммы были сиалидаза-отрицательными. У остальных 7 штаммов G. vaginalis были выявлены одновременно гены nanH1 и nanH3, и у всех этих штаммов, кроме одного, была зарегистрирована сиалидазная активность. Полученные нами данные согласуются с результатами недавних исследований [4, 9], показавших, что для экспрессии сиалидазной активности было необходимо наличие гена nanH3 в дополнение к гену nanH1. Кроме того, в этих работах такая же закономерность была выявлена для гена nanH2, и при этом частота данного гена была очень низкой. В нашем исследовании ген nanH2 не был выявлен ни в одном штамме, что также соответствует результатам предыдущих исследований [4, 9].
Исследования о роли продуцирующих сиалидазу бактерий в инфекционных процессах в урогенитальном тракте женщины ограничены, главным образом, вопросами патогенеза и диагностики БВ [12, 18, 19]. В наиболее ранней работе по данной тематике [12] было показано, что у женщин с БВ концентрация продуктов сиалидазной активности значительно выше, чем у женщин без БВ. Авторами также была исследована сиалидазная активность целого ряда штаммов вагинальных бактерий и выявлено, что все изоляты Prevotella bivia, 40% изолятов P. disiens и 20% изолятов G. vaginalis продуцировали сиалидазу, в то время как, ни в одном изоляте Mobiluncus curtisii, M. mulieris, Peptostreptococcus spp., Mycoplasma hominis продукцию сиалидазы не обнаружили [12]. В дальнейшем повышенная продукция сиалидазы при БВ была показана еще в нескольких исследованиях [18–20]. Интересно отметить, что повышенная сиалидазная активность в вагинальном отделяемом была выявлена не только у женщин с БВ, но и у женщин с аэробным вагинитом (АВ), для которого характерно доминирование Escherichia coli, Streptococcus spp., Staphylococcus spp., Enterococcus spp. [21]. В нашем исследовании, однако, ни один из штаммов кишечной палочки, стрептококков, стафилококков, энтерококков не обладал сиалидазной активностью. Косвенным подтверждением наших результатов может служить исследование Santos-Greatti M. et al. (2016) [22], продемонстрировавшее значительно более высокие уровни сиалидазной активности в вагинальных образцах у женщин с БВ микробиотой, чем у женщин с промежуточной микробиотой по шкале Нуджента, которая, по некоторым данным, представляет собой АВ микробиоту [23]. Учитывая неблагоприятное влияние АВ на репродуктивное здоровье женщины [24], данный вопрос заслуживает дальнейшего изучения.
Клиническая значимость способности бактерий деградировать муцины далеко не исчерпывается значимостью БВ и АВ. На сегодняшний день опубликованы единичные исследования, выявившие ассоциацию между муциназной (также в основном сиалидазной) активностью бактерий влагалища и неблагоприятными исходами беременности [25, 26]. Механизмы, посредством которых муколитические ферменты способствуют восходящей инфекции, до конца не ясны. Полагают, что деградация защитной слизи способствует прикреплению бактерий к эпителиальным клетки, изменению иммунного ответа и повышению риска распространения инфекции в матку. Попадая в матку, бактерии продолжают модулировать иммунную реакцию, индуцируют снижение синтеза коллагена в амнионе и хорионе, а также в ткани цервикального канала, и увеличивают риск преждевременного излития околоплодных вод и преждевременных родов [26]. Полагают, что действие муколитических микробных ферментов может быть также ключевым шагом в развитии восходящей инфекции и у небеременных женщин, приводя к инфекциям верхних отделов репродуктивного тракта – ВЗОМТ, перигепатиту, постоперационным осложнениям. Тем не менее, на сегодняшний день связь между муциназной активностью вагинальных бактерий и ВЗОМТ практически не изучена.
Заключение
Таким образом, подавляющее большинство культивируемых видов вагинальных бактерий не обладают сиалидазной активностью. Превалирующим видом Gardnerella spp. в обследованной популяции является G. vaginalis (84%), доля G. swidsinskii составляет 16%. Способностью ферментировать сиалогликаны обладают штаммы Bifidobacterium bifidum, Anaerococcus tetradius и большинство штаммов G. vaginalis, геном которых содержит одновременно гены nanH1 и nanH3. Штаммы G. swidsinskii, а также штаммы G. vaginalis, имеющие только ген nanH1, не проявляют сиалидазную активность.



