Гипертензивные осложнения беременности занимают 3–4 место в списке причин материнской смертности в течение последнего десятилетия и являются непосредственной ее причиной в 6,9–17,4% случаев [1]. В отдаленном прогнозе женщины, перенесшие преэклампсию (ПЭ) в период беременности, отличаются повышенной частотой развития ожирения, хронической артериальной гипертензии (ХАГ), сахарного диабета, ишемической болезни сердца, инсультов [2]. У этой когорты женщин нередко родоразрешение проводится досрочно. Тем не менее, частота нарушения физического и психосоматического развития преждевременно рожденных детей достаточно высока, и в последующем они страдают различными метаболическими, гормональными и сердечно-сосудистыми заболеваниями [3].
ПЭ и эклампсия являются следствием гестационной гипертензии и хронической гипертензии, и, соответственно, относятся к группе сердечно-сосудистых заболеваний у беременных [4].
ПЭ ежегодно выявляется у 8,5 миллионов женщин и ответственна за 15% случаев преждевременных родов в мире [4]. ПЭ – специфичный для беременности синдром, развивающийся после 20-й недели беременности, и характеризующийся наличием артериальной гипертензии (стойкое повышение давления систолического >140 мм ртутного столба и диастолического >90 мм рт. ст.) и протеинурией (больше 0,3 г/л в суточной моче) [5].
Несмотря на то, что определенные патофизиологические изменения (например, нарушение процессов плацентации) возникают на ранних сроках беременности, гипертензия и протеинурия, как правило, манифестируют уже во второй половине беременности и возникают в 3–8% всех случаев беременности.
В соответствии с клиническими рекомендациями Министерства здравоохранения Российской Федерации от 2016 года «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия» на сегодняшний день не существует ни одного теста, с достаточными чувствительностью и специфичностью, который бы обеспечивал эффективную диагностику и выявление риска развития ПЭ [5].
Интенсивные исследования последнего времени позволили выявить новые маркеры, такие как плацентарный фактор роста (PlGF) и растворимая fms-подобная тирозинкиназа 1 типа (sFlt-1) [6]. Чаще всего данные маркеры определяют у беременных группы риска (возраст старше 40 лет, ожирение, хронические заболевания почек и печени).
В исследовании, проведенном Hadker и соавт (2013), после 20 недель беременности было определено оптимальное пороговое значение для соотношения sFlt-1/PlGF – 85:1 с расчетной чувствительностью 82% и специфичностью 95% [7]. Компонентами теста являются два биомаркера sFlt-1 и PlGF, количественный анализ которых проводится на автоматизированной системе, доступной для использования в медицинских учреждениях и лабораториях. Соотношение sFlt-1/PlGF позволяет путем анализа сыворотки крови определить риск развития ПЭ у женщин на более ранних сроках беременности, задолго до манифестации клинических проявлений заболевания.
Целью исследования было изучение результатов математического моделирования по применению в Российской Федерации во второй половине беременности теста на ПЭ sFlt-1/PlGF в сравнении с рутинной практикой ведения беременности без теста.
Материалы и методы
Проводился анализ двух европейских моделей на предмет распределения в популяции пациенток в зависимости от развития ПЭ. Частота ложноположительных, ложноотрицательных, истинно положительных и истинно отрицательных исходов, а также количества пациенток с различными видами ПЭ в каждом сценарии определялась на основе данных модели немецкого исследования Hadker и соавт. (2013) [7] (рис. 1), модели исследования HECON UBC (2011) [8] (рис. 2), а также данных официальной статистики Российской Федерации [9, 10].
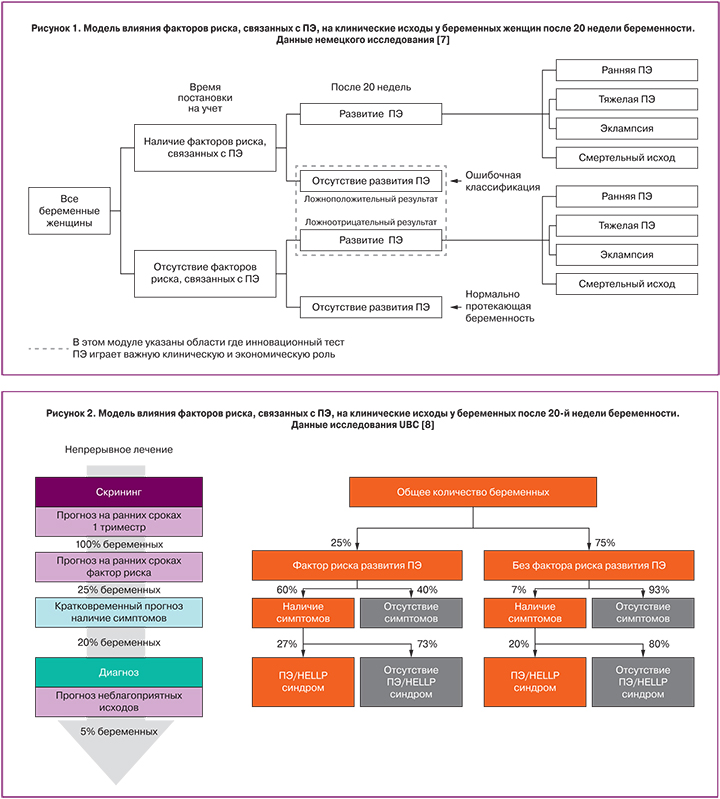
Информация о распределении пациенток по группам в зависимости от наличия или отсутствия у них риска развития ПЭ (25 и 75% соответственно), симптомного или бессимптомного течения заболевания (60 и 40% соответственно) основывалась на данных модели HECON, по мнению экспертов, наиболее точно соответствующих практике, используемой в Российской Федерации [8]. Сведения об итоговом распределении пациенток с ПЭ в зависимости от клинической формы заболевания были получены из данных официальной статистики [1, 10]. В построении адаптированной модели также использовались данные немецкого исследования, которое наиболее полно описывало исходы тестирования [7].
Было предложено 2 клинических сценария оценки популяции беременных на предмет развития у них ПЭ во второй половине беременности.
Первый сценарий (стандартная практика ведения беременности), предполагал регулярные визиты к врачам и применение в ходе обследования стандартных методов диагностики (измерение артериального давления, анализ мочи, биохимический анализ крови, эхография, допплерометрия и прочее) в ходе каждого антенатального визита [9]. Второй сценарий (с инновационным тестом) предполагал добавление к стандартной клинической практике инновационного теста после 20-й недели беременности.
Предполагалось, что вся популяция беременных Российской Федерации будет подвергнута скринингу на ПЭ во второй половине беременности в соответствии с первым или вторым сценарием. При этом 25% популяции беременных попадало в группу пациенток с наличием факторов риска развития ПЭ. Среди факторов риска ПЭ предполагался учет следующих: ПЭ в акушерском анамнезе; отсутствие беременности в анамнезе; ХАГ; многоплодная беременность; гестационный диабет [11]. Каждая группа была представлена подгруппами с наличием (60%) и отсутствием (40%) симптомов ПЭ. Кроме того, пациентки в модели распределялись в зависимости от клинических исходов, таких как умеренная ПЭ, тяжелая ПЭ, эклампсия и ПЭ на фоне ХАГ.
Анализ статистических данных РФ выявил некоторые несоответствия в распределении беременных с ПЭ в сравнении с данными зарубежных моделей [1, 7, 10]. В связи с этим для российской модели был введен поправочный коэффициент.
Результаты
В ходе исследования создана модель влияния факторов риска, связанных с ПЭ, на клинические исходы у беременных после 20-й недели беременности для двух сценариев: стандартной клинической практики и практики с применением инновационного теста.
Модель выявила различия между двумя сценариями по распределению пациенток в зависимости от клинических исходов ПЭ. Так в сценарии «Стандартная практика ведения беременности» доля истинно положительных и истинно отрицательных случаев была значимо ниже, чем в сценарии с инновационным тестом. Частота ложноотрицательных и ложноположительных случаев была выше в стандартном сценарии по сравнению со сценарием «Инновационный тест». Процентное распределение беременных для обоих сценариев представлено на рис. 3
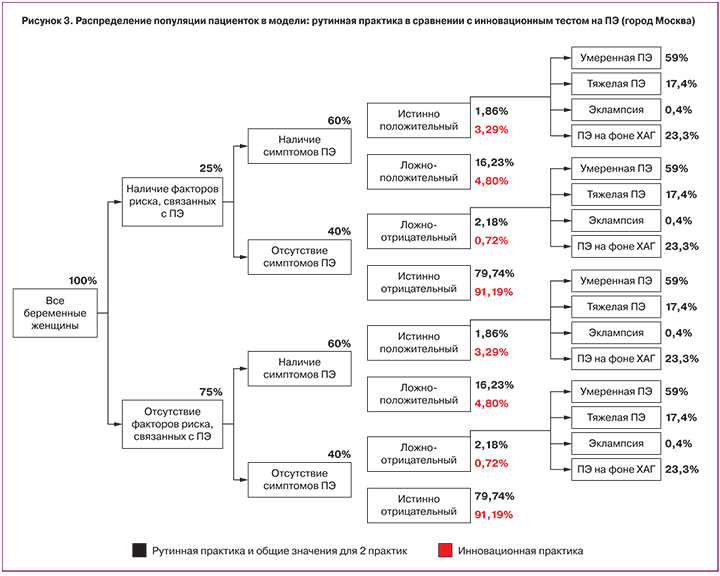
Конечное распределение по формам ПЭ расчитано на основе процентного распределения по городу Москва, базирующегося на статистических данных. По мнению экспертов данное распределение по формам ПЭ более точно отражает выявляемость заболевания в рутинной практике.
Для приближения расчетных значений модели к данным реальной российской статистики был использован региональный поправочный коэффициент. Расчет поправочного коэффициента рассмотрим на примере города Москва (табл. 1). На 2017 год в городе Москва было зарегистрировано 147 150 беременных женщин.
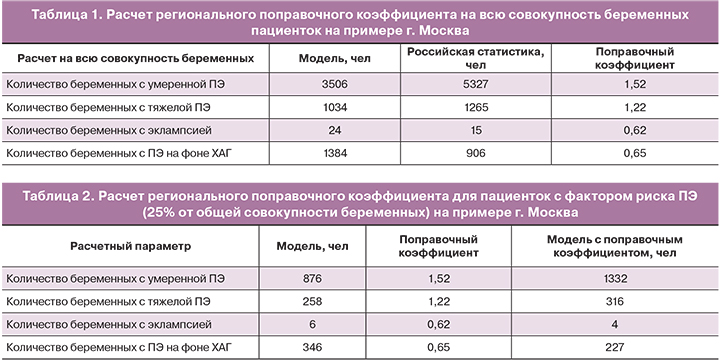
Поправочный коэффициент изначально рассчитывается на всю совокупность беременных (100%) и затем используется в расчетах на 25% беременных, которые входят в группу фактора риска.
Расчет поправочного коэффициента производится для каждого региона и каждой формы заболевания: умеренная ПЭ, тяжелая ПЭ, эклампсия и ПЭ на фоне ХАГ.
Поправочный коэффициент рассчитывается как отношение данных реальной статистики РФ к данным, полученным в результате моделирования.
Например, поправочный коэффициент для категории пациенток с умеренной ПЭ рассчитывался как =1,52.
Далее этот же поправочный коэффициент применялся в расчетах на выборку 25% от общего количества беременных, то есть только для тех пациенток, у которых есть фактор риска развития ПЭ (табл. 2):
Например, расчет количества пациенток с умеренной ПЭ в группе риска возникновения заболевания с учетом поправочного коэффициента был проведен следующим образом 876×1,52=1332.
Модель показала, что применение в клинической практике инновационного теста sFlt-1/PlGF позволяет улучшить диагностику ПЭ за счет увеличения на 24% частоты истинно положительных результатов (с 1,9 до 2,3%), снижения в 3 раза частоты ложноположительных результатов теста (с 16,2 до 4,8%), снижения в 3 раза частоты ложноотрицательных результатов теста (с 2,2 до 0,7%) и увеличения на 14% частоты истинно отрицательных результатов теста (с 79,74 до 91,2%).
Анализ данных российской статистически показал, что в адаптированной модели с учетом введения поправочного коэффициента процентное распределение случаев ПЭ в зависимости от степени тяжести состояния выглядит следующим образом: умеренная ПЭ – 59%; тяжелая ПЭ – 17,4%; эклампсия – 0,4%; ПЭ на фоне ХАГ – 23,3%.
Обсуждение
Работа посвящена оценке преимущества применения инновационного теста на ПЭ sFlt-1/PlGF во второй половине беременности в ходе моделирования на российской популяции. Определение sFlt-1/PlGF предоставляет новую информацию, которая может иметь ценность в прогнозировании развития ПЭ в ближайшие с момента взятия теста сроки. Анализ приоритетных публикаций и математическое моделирование с введением поправочных коэффициентов к европейским моделям продемонстрировали преимущества применения инновационного теста sFlt-1/PlGF у пациенток группы риска с симптомным и бессимптомным течением беременности в диагностике ПЭ, снижении риска развития тяжелых форм заболевания, приводящих к задержке роста плода, преждевременным родам и перинатальной смертности.
В проведенном исследовании были отобраны и проанализированы передовые модели, которые наиболее точно отражали практику распределения пациенток с ПЭ. Европейская модель распределения пациенток с ПЭ впервые была адаптирована для РФ. При этом был введен поправочный коэффициент, при помощи которого данные, полученные из европейских моделей, были приближены к условиям российской действительности.
Данное исследование обладает рядом ограничений. Во-первых, модель предполагает, что чувствительность и специфичность нового теста на ПЭ будут такими же, как были в клинических испытаниях [7]. Хотя данные работы являются в этом смысле отправной точкой, реальная практика может несколько отличаться от опубликованных работ. Кроме того, модель использует ряд допущений в отношении чувствительности и специфичности стандартной практики тестирования на ПЭ. Если существующий тест показывает лучшую эффективность, то ее экономическая составляющая должна быть определена в ходе последующего исследования. В-третьих, информация о частоте визитов в ходе беременности была взята из российских клинических рекомендаций по ведению беременности и экспертных оценок для группы риска развития ПЭ, последняя информация не была опубликована. Хотя первичные данные, полученные от клиницистов и организаторов здравоохранения, имеющих опыт ведения пациентов с ПЭ, обеспечивают клинически и экономически релевантную информацию для построения модели, использование этих данных не было строго валидировано. Наконец, при построении модели в этом исследовании акцент делался на здоровье матери во время беременности. Наша модель не учитывала проблемы со здоровьем, которые могут быть вызваны ПЭ, в последующей жизни, как для женщины, так и для ребенка [12]. Прямая и опосредованная стоимость таких осложнений представляется высокой [13]. Принимая во внимание, что клиническое и экономическое влияния ПЭ определяются также и плодом, приводя к экономическим последствиям, обусловленным ведением неонатального периода, экономия средств, обеспечиваемая применением инновационного теста, представляется недооцененной. Однако эти преимущества от инновационного теста на ПЭ не были учтены в нашей модели. Безусловно, если бы эти факторы были включены в модель, то сметная экономия средств для российского бюджета здравоохранения оказалась более существенной.
Анализ приоритетных зарубежных публикаций и построение модели продемонстрировали преимущества применения инновационного теста для прогнозирования ПЭ во 2 половине беременности. Это может позволить оптимизировать врачебную тактику, и в первую очередь, может предотвратить наступление жизнеугрожающих осложнений беременности. Совершенствование диагностических подходов к ведению ПЭ играет важную роль в рационализации расходования выделяемых средств за счет улучшения диагностики, наблюдения и ведения пациентов.
Построение российской модели по оценке эффективности применения инновационного теста sFlt-1/PlGF позволило выявить потенциал улучшения диагностики ПЭ. Результаты исследования рекомендуется учесть при разработке клинических протоколов и рекомендаций по ведению беременности у женщин группы риска по развитию ПЭ.
Заключение
Определение материнских сывороточных концентраций sFlt-1 и PlGF и соотношения sFlt-1/PlGF позволяет дифференцировать беременных на пациенток с ПЭ/эклампсией и пациенток с неосложненным течением беременности. В отличие от существующей стандартной практики наблюдения, использование данного инновационного теста обладает потенциалом снижения частоты ложноположительных и ложноотрицательных (субклиническое течение заболевания) результатов по выявлению ПЭ. Внедрение инновационного теста sFlt-1/PlGF в клиническую практику оптимизирует идентификацию ПЭ.



