Плацентарная недостаточность (ПН) с формированием синдрома задержки роста плода (СЗРП) и преэклампсия (ПЭ) являются наиболее распространенными осложнениями беременности.
По данным ВОЗ, число новорожденных с задержкой роста колеблется от 6,5% в развитых странах Европы до 31,1% в Центральной Азии. В России этот синдром отмечается у 2,4–17% беременных [1]. Частота ПЭ составляет 6–8% в развитых странах и превышает 18% в развивающихся [2–5].
В структуре причин преждевременных родов на долю ПЭ приходится до 15% случаев во всем мире [6, 7]. Занимая ведущие позиции среди причин материнской (29–35%) и перинатальной смертности (230–400‰), ПЭ также лежит в основе развития отдаленных заболеваний матери и новорожденного [8–10]. В то же время СЗРП разной степени тяжести обуславливает не только резкое увеличение перинатальной смертности, но и многочисленные морфофункциональные изменения в организме ребенка, приводящие к неблагоприятным последствиям в дальнейшей его жизни. Перенесенная тяжелая ПН может приводить к нарушениям физических и умственных способностей, а также повышенной соматической и инфекционной заболеваемости новорожденных и детей на первом году жизни, являясь в дальнейшем причиной развития таких заболеваний, как артериальная гипертензия, сахарный диабет, метаболический синдром [1, 11, 12].
В настоящее время из всех предложенных гипотез развития ПЭ наиболее приоритетной является плацентарная теория, согласно которой данная патология развивается в результате патологической плацентации и неадекватной инвазии цитотрофобласта, что, в свою очередь, ведет к ишемии плаценты [12].
По данным G.I. Burton и соавт. (2009) [9], ишемизированные клетки трофобласта начинают в повышенном количестве синтезировать антиангиогенные факторы роста, в частности растворимую форму FMS-подобной тирозинкиназы-1 (sFlt-1), которая, являясь рецептором для проангиогенного фактора роста эндотелия сосудов (VEGF), связываясь с последним, нейтрализует его действие. К числу контролирующих рост плаценты факторов относится и другой проангиогенный фактор из семейства VEGF – плацентарный фактор роста (PlGF) [13]. Среди антиангиогенных факторов широко изучается влияние белка эндоглина (sEng), который является составной частью рецепторного комплекса трансформирующего ростового фактора TGF-β и, подобно sFlt-1, ингибирует формирование эндотелиальных клеток in vitro [14].
Известно, что процессы ангиогенеза регулируются за счет равновесия между про- и антиангиогенными факторами [15]. Показано, что при ПЭ происходит изменение баланса между уровнем этих белков, что может переключать направление ангиогенеза с преимущественного роста сосудов (что требуется для успешной плацентации) на преимущественное ингибирование их образования.
Одним из ведущих патогенетических механизмов развития ПН являются нарушения маточно-плацентарного и фетоплацентарного кровотоков, сопровождающиеся повышением вязкости крови, гиперагрегацией эритроцитов и тромбоцитов, расстройством микроциркуляции и сосудистого тонуса, недостаточностью артериального кровообращения [16]. Нормальное развитие плаценты напрямую зависит от «удачной» инвазии трофобласта, процессов васкулогенеза и ангиогенеза. Особое значение для развития сосудистой сети плаценты и ее нормального функционирования имеют сосудистые (ангиогенные) факторы роста, стимулирующие пролиферативную активность эндотелиальных клеток, увеличивая их жизнеспособность. Для нормального развития и функционирования плаценты важно равновесие между различными механизмами ангиогенеза, а также баланс между процессами ангиогенеза и апоптоза, которые поддерживаются соотношением проангиогенных и антиангиогенных факторов, секретируемых как самими эндотелиальными клетками, так и клетками микроокружения [2].
По данным R. Romero (2008), возникающая при ПН гипоксия может регулировать экспрессию PlGF в плацентарной ткани, увеличивая продукцию s-Flt-1, которая может конкурентно связывать свободно циркулирующие про-ангиогенные факторы VEGF и PlGF и еще больше усугублять дисбаланс в сторону анти-ангиогенного состояния [15, 16].
По данным G. Girardi и соавт. (2006), при развитии плацентарного трофобласта в условиях гипоксии в кровь матери начинает поступать большое количество антиангиогенных факторов, таких как sFlt-1 и sEng. Повышенная концентрация sFlt-1 подавляет плацентарную дифференциацию цитотрофобласта, нарушает процессы инвазии, что играет непосредственную роль в патогенезе аномальной плацентации, связанной с развитием ПН и нарушением роста плода [12].
Как следует из вышесказанного, во многом патофизиология ПН и ПЭ схожа. ПЭ всегда подразумевает наличие ПН той или иной степени выраженности, хотя далеко не у всех беременных с ПН и связанным с ней СЗРП развивается симптомокомплекс, характерный для ПЭ. ПЭ – это состояние с формированием полиорганной недостаточности, с развитием «материнского» синдрома, с обязательным наличием артериальной гипертензии, в то время как при «чистой» ПН мы наблюдаем изолированное нарушение функции в системе «мать-плацента-плод» без формирования генерализованного эндотелиоза и развития системных нарушений.
Цель настоящего исследования: изучить роль про-ангиогенных и анти-ангиогенных факторов роста в патогенезе ПН и ПЭ.
Материал и методы исследования
В соответствии с целью исследования был проведен проспективный анализ течения беременности, родов, послеродового периода и постнатальных исходов у 254 беременных: I основную группу составили 116 пациенток с ПН и СЗРП, во II группу сравнения включены 86 беременных с ПЭ, в III контрольную группу вошли 52 соматически здоровые беременные с неотягощенным акушерско-гинекологическим анамнезом и физиологическим течением беременности. Основная группа разделена на 3 подгруппы в зависимости от степени тяжести СЗРП: 1A подгруппу составили 44 беременных с СЗРП I степени тяжести, 1Б подгруппу составили 38 беременных с СЗРП II степени и 1В подгруппу – 34 беременных с СЗРП III степени. Группа сравнения была разделена на 2 подгруппы: 2а подгруппу составили 50 беременных с ПЭ средней степени тяжести, 2б подгруппу – 36 беременных с ПЭ тяжелой степени.
Диагноз СЗРП устанавливали при выявлении параметров фетометрии ниже 10-го перцентиля. Степень тяжести СЗРП определяли по отставанию параметров фетометрии от должного гестационного срока. При I степени тяжести СЗРП отставание на 2 недели, при II – в пределах 3–4, при III степени – более 4 недель. Диагноз ПЭ выставляли при сочетании повышенного артериального давления (АД) (140/90 мм рт. ст. и выше) и протеинурии (300 мг/сут и выше), не обусловленной заболеванием почек. В нашей работе мы использовали критерии тяжелой степени ПЭ, предложенные European Society of Hypertension and of the European Society of Cardiolody (2007) [13] в модификации О.В. Макарова:
- АД соответствует как минимум 160/110 мм рт. ст. и более по результатам двух замеров с 6-часовым перерывом.
- Суточная протеинурия ≥2 г/м2/сут (3–5 г/л в сутки в зависимости от росто-весовых показателей).
- Гипоальбуминемия <18 г/л.
- Олигурия ≤30 мл/час или ≤400 мл/24 ч.
- Тромбоцитопения (<100000×109/л).
- Задержка роста плода на 4 недели и более.
- Критические формы ПЭ (эклампсия, тяжелая ретинопатия, острый жировой гепатоз, HELLP-синдром, острая почечная недостаточность, отек легких).
Всем беременным проведено традиционное комплексное клинико-лабораторное обследование, а также исследование уровня проангиогенного (PlGF) и антиангиогенных (sFlt-1, sEng) факторов роста в сыворотке крови в 28-34 недели гестации. Исследование проводили методом твердофазного иммуноферментного анализа с использованием коммерческих наборов фирмы «R&D Systems» (Великобритания) в точном соответствии с рекомендациями фирмы-производителя. Математическую обработку полученных данных проводили с использованием методов вариационной статистики с помощью пакетов программ Statistica 7 (StatSoft) и Excel 2010 (Microsoft). Все данные представлены как среднее арифметическое ± стандартное отклонение среднего. Сравнение средних осуществляли с помощью двустороннего t-критерия Стьюдента для независимых переменных, разницу между группами считали достоверной при значении p<0,05.
Результаты исследования и обсуждение
У беременных основной и группы контроля АД не повышалось ни до, ни во время беременности. У беременных с ПЭ величина систолического АД (АДс) во время беременности в среднем составляла 153,29±3,48 мм рт. ст., величина диастолического АД (АДд) – 96,14±1,97 мм рт. ст. У беременных с ПЭ средней степени тяжести максимальная величина АДс во время беременности составляла 151,07±3,46 мм рт. ст., величина АДд 95,48±2,0 мм рт. ст., у беременных с тяжелой ПЭ величина АДс во время беременности составляла 161,09±4,83 мм рт. ст., величина АДд 99,69±2,45 мм рт. ст. (р<0,05). У пациенток группы сравнения в 38% (n=33) случаев ПЭ была сочетанной, среди них у 31% (n=27) беременных ПЭ развилась на фоне хронической артериальной гипертонии.
Период пролонгирования беременности у пациенток с ПЭ в среднем составил 8,12±1,27 сут (от до 19 суток). Средний срок родоразрешения в группе сравнения составил 33,09±0,33 недели, что достоверно меньше, чем в основной (35,8±1,42 недели) и в контрольной группах (39,4±0,9 недели) (p<0,05). Срок родоразрешения у беременных в 2а и 2б подгруппах достоверно не отличался и в среднем составил 32,73±0,66 недели и 33,21±0,5 недели соответственно. Срок родоразрешения пациенток с ПН был достоверно меньше по сравнения со здоровыми беременными (p<0,05). Все роды контрольной группы были своевременными. Частота преждевременных родов в основной группе составила 41% (n=47), что достоверно ниже этого показателя в группе сравнения – 100% (n=86) (р<0,05).
Все пациентки с ПЭ родоразрешены путем операции кесарева сечения, основными показаниями к которому служили нарастание тяжести ПЭ – 74% (n=64) и/или ухудшение функционального состояния плода – 26% (n=22). Обращает на себя внимание значительно больший процент операций кесарева сечения в основной группе, по сравнению с контрольной: 43% (n=50) и 14% (n=7) соответственно. В 68% (n=34) случаев у беременных основной группы операцию кесарева сечения проводили в экстренном порядке: по поводу ухудшения функционального состояния плода у 46% (n=23) пациенток, по поводу присоединения ПЭ у 18% (n=9) беременных, отслойки нормально расположенной плаценты – у 4% (n=2) беременных. В контрольной группе все пациентки были прооперированы в плановом порядке.
У 5 (6%) родильниц II группы отмечено прогрессивное повышение АД, повлекшее назначение или усиление антигипертензивной терапии. У 3% (n=4) пациенток основной группы была зарегистрирована антенатальная гибель плода, у 1% (n=1) – интранатальная гибель плода. 41% (n=47) детей от матерей основной группы были недоношенными. У пациенток основной группы 34% (n=39) новорожденных сразу после родоразрешения были переведены в отделение реанимации и интенсивной терапии. Для дальнейшего лечения 14% (n=16) детей были переведены в отделение реанимации № 2, а 16% (n=19) детей – в детское отделение на второй этап выхаживания. Количество койко-дней, необходимых для реабилитации новорожденных основной группы, составило 24±6,2 дня, что достоверно выше по сравнению с новорожденными контрольной группы, где средний койко-день составил 4,1±0,9 дня (p<0,05).
Все дети, рожденные от матерей с ПЭ, были недоношенными, 91% (n=78) из них сразу после рождения госпитализированы в отделение реанимации и интенсивной терапии. СЗРП был диагностирован у 57% (n=49) новорожденных II группы. СЗРП I степени диагностировали у 23 (29%) детей, СЗРП II степени – у 22 (26%) детей, СЗРП III степени – у 3 (3%) детей. Для дальнейшего лечения 45 (52%)детей от беременных с ПЭ переведены на 2-й этап выхаживания в детское отделение, из них 31 (36%) ребенок – в реанимационное отделение. Средний койко-день для детей, рожденных от матерей с ПЭ, составил 33,87±5,4 дня, что достоверно больше, чем в основной и группе контроля и сравнимо с количеством койко-дней, потребовавшихся для реабилитации новорожденных с СЗРП III степени (IВ подгруппа) (29,35±6,7 дня) (p<0,05).
Все дети пациенток контрольной группы были выписаны домой в удовлетворительном состоянии.
В ходе нашего исследования выявлены достоверные отличия в содержании сосудистых факторов роста в сыворотке крови у пациенток, беременность которых осложнилась ПН и СЗРП, по сравнению с пациентками с ПЭ и со здоровыми беременными. Уровень sFlt-1 у беременных основной группы был в 5,5 раза выше по сравнению с контрольной группой и составил 19438,6±3131,8 пг/мл и 3299,4±552,5 пг/мл соответственно (p<0,05). У беременных с ПЭ уровень sFlt-1 (37058,36±5840,17 пг/мл) был в 2 раза больше, чем у беременных с ПН, и в 11 раз выше по сравнению со здоровыми.
Уровень s-Eng у беременных основной группы был в 3,3 раза выше по сравнению с контрольной группой и составил 17483±5865 пг/мл и 5440±670 пг/мл соответственно (p<0,05). У беременных с ПЭ уровень s-Eng (69940±810 пг/мл) был в 4 раза больше, чем у беременных с ПН и в 13 раз выше по сравнению со здоровыми.
Концентрация PlGF у беременных основной группы была в 1,5 раза меньше по сравнению со здоровыми беременными и составила 146,5±45 пг/мл и 238,51±66,9 пг/мл соответственно (p<0,05). У беременных с ПЭ уровень PlGF (29,9±5,5 пг/мл) был в 5 раз меньше, чем у беременных с ПН, и в 8 раз меньше по сравнению со здоровыми.
Таким образом, нарушение формирования и функционирования фетоплацентарного комплекса, характеризующееся снижением уровня проангиогенного фактора роста (PlGF) и повышением уровня антиангиогенных факторов роста (sFlt-1 и s-Eng), характерно как для ПЭ, так и для ПН. Однако степень тяжести ангиогенного дисбаланса различна.
Нами рассчитан ангиогенный коэффициент К, являющийся отношением sFlt-1/PlGF, отражающий выраженность дисбаланса между про- и антиангиогенными факторами роста. У пациенток основной группы величина ангиогенного коэффициента в 25 раз превышала значения К у здоровых беременных и составила 610,4±260,3 по сравнению с 25,28±8,24 (p<0,05). Значение ангиогенного коэффициента К у пациенток с ПЭ составило 1675,4±491,1, что в 2,7 раза превышает его значения при ПН и в 67 раз при физиологическом течении беременности (p<0,05).
Таким образом, ПЭ и тяжелая ПН сопровождается выраженным дисбалансом сосудистых факторов роста, что отражается на резком возрастании значений ангиогенного коэффициента К. В то же время выраженность ангиогенного дисбаланса при ПЭ во много раз превосходит таковой при формировании СЗРП.
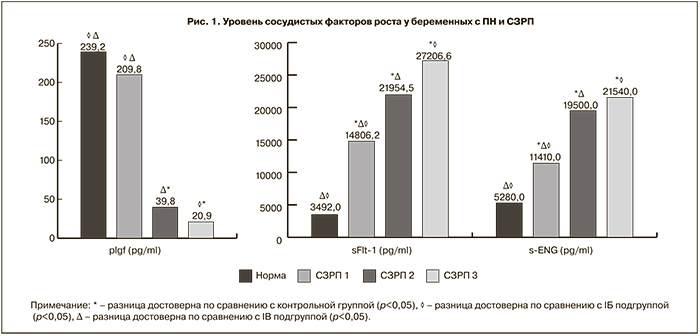
У беременных с СЗРП III степени уровень lGF был достоверно ниже по сравнению с беременными с СЗРП II и I степени: 20,9±11,1 пг/мл, 39,8±28,2 пг/мл и 209,8±85,7 пг/мл соответственно (p<0,05). При этом уровень PlGF был достоверно ниже у беременных с СЗРП II степени по сравнению с СЗРП I степени. У беременных с СЗРП II и III степени уровень PlGF был достоверно ниже по сравнению со здоровыми: 20,9±11,1, 39,8±28,2 и 238,51±66,8 соответственно (p<0,05). У беременных с СЗРП I степени уровень PlGF достоверно не отличался от контрольной группы, но имел тенденцию к снижению.
Значения PlGF у беременных с СЗРП II степени в 6 раз меньше по сравнению с контрольной группой. У беременных с СЗРП III степени значения PlGF оказались меньше значений контрольной группы в 11,5 раз (рис. 1).
При сравнении значений коэффициента К в основной группе было выявлено резкое его возрастание по мере утяжеления течения ПН и нарастания степени СЗРП (180,5 – СЗРП I степени, 1070,4 СЗРП II степени, 1360,5 – СЗРП III степени).
У 7,8% (n=9) беременных из основной группы (ПН) присоединилась ПЭ. Количество дней, прошедших от момента определения сосудистых факторов роста у данной группы беременных до присоединения симптомов ПЭ составило в среднем 14,6±2,6 дней. Концентрация PlGF у беременных этой группы составила 15,41±1,4 пг/мл, sFlt-1 – 56217,56±3134,8 пг/мл, s-Eng – 94320±8134,5 пг/мл. Ангиогенный коэффициент К у этой группы беременных составил в среднем 3648±290,4 (от 2530,6 до 6080,8), что в 2,7 раза больше средних значений ангиогенного коэффициента IВ подгруппы (СЗРП 3-й степени) (1360,5±240,2), и сравнимо со значением ангиогенного коэффициента К у беременных с тяжелой степенью ПЭ (2б подгруппа) (3478,66±418,45).
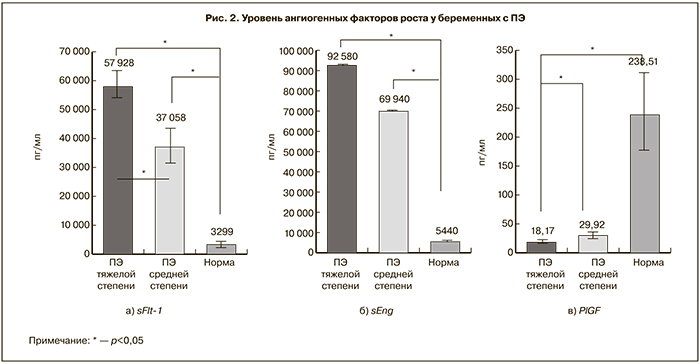
При исследовании сосудистых факторов роста в подгруппах 2а и 2б было выявлено, что средний сывороточный уровень sFlt-1 у беременных с ПЭ средней степени тяжести (2а подгруппа) составил 37058,36±5840,17 пг/мл, что достоверно ниже по сравнению с пациентками с тяжелой ПЭ (2б подгруппа) (57927,58±5029,38 пг/мл (p<0,05). Уровень sEng у беременных с тяжелой ПЭ достоверно выше по сравнению с беременными с ПЭ средней степени тяжести: 92580±1782 пг/мл и 69940±1235 пг/мл соответственно (p<0,05). У беременных с ПЭ средней степени тяжести уровень PlGF достоверно выше по сравнению с беременными с тяжелой ПЭ: 29,92±5,5 пг/мл и 18,17±3,01 пг/мл соответственно (p<0,05) (рис. 2).
Уровень ангиогенного коэффициента К у беременных с ПЭ средней степени тяжести составил 1675,36±491,09, что достоверно ниже по сравнению с беременными 2б подгруппы (3478,66±418,45) (p<0,05).
Таким образом, изменение концентрации ангиогенных факторов роста более выражено при тяжелой степени ПЭ, что свидетельствует о ключевой роли дисбаланса про- и антиангиогенных факторов роста в развитии клинической картины ПЭ и в изменении ангиогенного статуса в зависимости от клинических проявлений и тяжести эндотелиоза.
У части беременных 2а подгруппы (n=34) сосудистые факторы роста определяли при поступлении (при средней тяжести ПЭ) и непосредственно перед родоразрешением, когда клинико-лабораторные данные свидетельствовали об утяжелении течения ПЭ.
Сывороточный уровень sFlt-1 достоверно увеличился при нарастании тяжести ПЭ в среднем с 27712,23±5129,5 пг/мл до 53654,86±12018,42 пг/мл (p<0,05). Средний уровень сывороточного PlGF при нарастании тяжести ПЭ достоверно снизился с 39,98±6,68 пг/мл до 19,4±7,26 пг/мл (p<0,05). Достоверных отличий между значениями сывороточного sEng при нарастании ПЭ выявлено не было, однако отмечалась тенденция к его увеличению. Уровень ангиогенного коэффициента К достоверно увеличивался при утяжелении течения ПЭ с 698,55±60,45 до 3072,83±939,21 (p<0,05).
Нами определена диагностическая ценность метода определения уровня сосудистых факторов роста у беременных с ПЭ для оценки степени тяжести. Высокочувствительным (62%), с положительной прогностической ценностью (70%) и высокоспецифичным (75%) критерием тяжелой степени ПЭ является снижение про-ангиогенного сосудистого фактора PlGF до 14,5-42,8 пг/мл, что указывает на прогрессирование патологического процесса у данной категории больных. На основании полученных результатов получен патент 2477481 Российская Федерация. МПК G01N33/49. Способ выбора тактики ведения беременных с преэклампсией средней степени тяжести / Макаров О.В., Волкова Е.В., Джохадзе Л.С., Винокурова И.Н., Лысюк Е.Ю., Кибардин А.В.; патентообладатель Закрытое акционерное общество «Протеинсинтез». № 011141357/15; заявл. 13.10.2011; опубл. 10.03.2013 // Бюлл. – 2013. – № 7.
Заключение
ПЭ и ПН с формированием СЗРП характеризуются увеличением сывороточных концентраций антиангиогенных сосудистых факторов роста и снижением проангиогенного фактора. В случае ПН эти изменения носят умеренный характер, выраженность дисбаланса сосудистых факторов определяет глубину сосудистых нарушений в маточно-плацентарном комплексе и, как следствие, степень его поражения и тяжесть ПН, которая также будет зависеть от скорости развития дисбаланса и компенсаторно-приспособительных возможностей плода и материнского организма. ПЭ характеризуется более выраженым ангиогенным дисбалансом с преобладанием антиангиогенной активности, что приводит к развитию системных нарушений, срыву адаптационных механизмов материнского организма и развитию полиорганной недостаточности, что угрожает жизни и здоровью не только плода, но и беременной.
Глубокое понимание патологических аспектов формирования ПН и ПЭ поможет разработать комплекс мероприятий по своевременной диагностике, адекватному лечению и выбору акушерской тактики у данной категории беременных с целью снижения материнской заболеваемости и перинатальных осложнений.



