25 апреля 2023 г. под председательством в.н.с. Научно-клинического отделения ВРТ им. Ф. Паулсена-старшего ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России, д.м.н., профессора Корнеевой Ирины Евгеньевны состоялся экспертный совет, посвященный оптимизации методов поддержки лютеиновой фазы в программах вспомогательных репродуктивных технологий (ВРТ) в условиях импортозамещения.
В ходе экспертного совета обсуждались современная доказательная база, обосновывающая необходимость применения препаратов прогестерона для поддержки лютеиновой фазы в программах ВРТ, и свойства, которыми должен обладать «идеальный» препарат прогестерона в этом клиническом контексте. Ведущие российские эксперты-клиницисты в области ВРТ единогласно подтвердили, что, выбирая препарат прогестерона в программах ВРТ, они руководствуются критериями эффективности, удобства в применении и непрерывной коммерческой доступности. Интравагинальное применение прогестерона, с точки зрения экспертов, остается наиболее фармакологически обоснованным путем поддержки программ ВРТ, а микронизированный прогестерон в форме геля может восприниматься пациентками как более удобный с позиции кратности дневного приема и местной переносимости, по сравнению с интравагинальными капсулами. Эксперты согласились, что появление препаратов микронизированного прогестерона для интравагинального применения российского производства – важный шаг на пути расширения клинических возможностей врачей, ведущих пациенток в программах ВРТ, в условиях необходимости стабильного импортозамещения.
Прогестерон при физиологической беременности и в программах вспомогательных репродуктивных технологий
Совет экспертов открылся обсуждением доказательной базы, обосновывающей необходимость применения препаратов прогестерона для поддержки лютеиновой фазы в программах ВРТ, основанной на общепринятом научном мнении о ключевой роли прогестерона в секреторной трансформации эндометрия, имплантации и поддержке прогрессирующей беременности [1].
Согласно современной номенклатуре, термин «прогестерон» относится только к природному гормону, который вырабатывается яичниками или входит в состав зарегистрированных лекарственных средств, которые квалифицируются как идентичные натуральному прогестерону. Прогестагены – это функциональный термин, который относится к природным и синтетическим молекулам, обладающим прогестагенной активностью. Термин «прогестин» используется только для синтетических соединений, которые обладают способностью взаимодействовать с рецепторами прогестерона, но при этом принадлежат к разным классам молекул, иногда с очень разными, даже противоположными, фармакологическими свойствами и механизмами действия. Натуральный прогестерон и иные прогестагены играют важную роль в здоровье женщины и особенно важны для репродуктивной функции [2, 3].
Успех имплантации зависит от качества эмбриона, состояния эндометрия и их синхронных взаимодействий. Прогестерон – важный медиатор эндометриально-эмбриональной синхронии, который обеспечивает морфологические и биохимические изменения эндометрия, необходимые для его дифференцировки в соответствии со стадией развития эмбриона. Негеномные эффекты прогестерона включают поддержание иммунологической толерантности в отношении раннего эмбриона, регуляцию местного и системного воспаления, токолитический эффект в миометрии, ингибирование биосинтеза холестерина и системную нейропротекцию [4].
В естественном цикле прогестерон секретируется после овуляции желтым телом, а его секреция поддерживается вначале лютеинизирующим гормоном (ЛГ), а при наступлении беременности – человеческим хорионическим гонадотропином. Для успешной беременности как в естественных циклах, так и в программах ВРТ необходима адекватная концентрация прогестерона в сыворотке крови. Периконцепционный период (период вокруг зачатия) – это ключевое окно для действия прогестерона [2–4].
Целью поддержки лютеиновой фазы в программах ВРТ является достижение необходимого уровня прогестерона для успешной имплантации эмбриона и поддержки раннего срока беременности [1]. В то время как минимальный уровень прогестерона для естественного зачатия составляет 9,4 нг/мл, оптимальный уровень прогестерона в стимулированных циклах экстракорпорального оплодотворения/интрацитоплазматической инъекции сперматозоидов (ЭКО/ИКСИ) достигает 25–31 нг/мл. Активность желтых тел позволяет обеспечить около половины этого уровня, что обосновывает необходимость экзогенной поддержки прогестероном [5]. Относительный дефицит прогестерона в стимулированных циклах ЭКО/ИКСИ обусловлен мультифолликулярным ростом и высоким уровнем эстрогенов и прогестерона, которые ингибируют секрецию ЛГ по принципу отрицательной обратной связи, а также аспирацией клеток гранулезы, приводящей к преждевременному лютеолизу и неполноценности лютеиновой фазы [5]. Общеизвестно, что отсутствие экзогенной поддержки прогестероном в «свежих» циклах радикально снижает частоту беременности в программах ВРТ, и отказ от поддержки посттрансферного периода считается неэтичным [6].
Эксперты отдельно обсудили подходы к применению прогестерона в криоциклах. При отсутствии желтого тела наиболее частым методом подготовки эндометрия является последовательное назначение эстрогенов и прогестерона [5]. Как и в «свежих» циклах, в данной клинической ситуации вагинальный микронизированный прогестерон обеспечивает высокую концентрацию в эндометрии благодаря эффекту первичного прохождения через матку. Однако в 30% случаев концентрация прогестерона в сыворотке крови при таком методе подготовки эндометрия может быть снижена ввиду его недостаточной абсорбции, риск которой повышается с возрастом, при более высоком индексе массы тела (ИМТ) и при насыщении вагинальных рецепторов. С учетом того, что в этих случаях возможность относительной компенсации дефицита эндогенным прогестероном отсутствует, это может оказывать отрицательное влияние на исходы цикла ВРТ [7, 8].
В настоящее время отсутствует консенсус о минимальном уровне прогестерона в программах ВРТ после подготовки эндометрия эстрогенами и прогестероном, необходимом для достижения беременности. По данным Labarta E. et al. (2017), частота прогрессирующей беременности статистически значимо снижена у женщин с сывороточным уровнем прогестерона в день переноса эмбриона <9,2 нг/мл после подготовки эндометрия эстрогенами и микронизированным прогестероном (ОШ 0,297; 95% ДИ 0,113–0,779; p=0,013) [7]. В исследовании той же группы ученых 2021 г. пороговый уровень прогестерона для успешной беременности в циклах с собственными или донорскими ооцитами при том же методе подготовки эндометрия составил ≥8,8 нг/мл, а оптимальный – >10 нг/мл [8]. Метаанализ 16 публикаций Melo P. et al. (2021) также показал, что при переносе бластоцист в криоциклах после подготовки эндометрия с использованием вагинального прогестерона уровень прогестерона в сыворотке крови >10 нг/мл был связан с увеличением частоты прогрессирующей беременности и живорождений (ОР 1,47; 95% ДИ 1,28–1,70), увеличением частоты клинической беременности (ОР 1,31; 95% ДИ 1,16–1,49) и более низким риском самопроизвольного выкидыша (ОР 0,62; 95% ДИ 0,5–0,77) [9].
Неполноценная лютеиновая фаза встречается и в естественном цикле ВРТ приблизительно у 8% пациенток и диагностируется на основании низкой концентрации прогестерона в сыворотке крови: однократном уровне прогестерона <10 нг/мл или суммы трех измерений уровней прогестерона <30 нг/мл [10]. Важным фактором в оценке уровня прогестерона в сыворотке крови является время анализа, которое должно соответствовать времени достижения максимальной концентрации прогестерона в сыворотке после экзогенного введения препарата прогестерона [5].
Пути введения прогестерона и клинические предпочтения специалистов
Эксперты обсудили возможные пути введения прогестерона в программах ВРТ ввиду того, что метаболизм прогестерона, а также его уровни в сыворотке крови и в матке различаются в зависимости от пути введения. Прогестерон при вагинальном введении всасывается без значительных метаболических изменений и обеспечивает высокую концентрацию гормона в эндометрии, в отличие от перорального приема, при котором преобладающая доля активного вещества распределяется с системным кровотоком. Пик концентрации прогестерона в крови при введении вагинального геля достигается примерно через 6 ч. Снижение вклада печени в метаболизм прогестерона при вагинальном введении также обосновывает преимущество этого пути не только в репродуктивной медицине, но и для заместительной гормональной терапии в менопаузе и у пациенток с эндокринным бесплодием [11–13].
В 2019 г. эксперты Европейского общества репродукции и эмбриологии человека (ESHRE) рекомендовали в стимулированных циклах ЭКО/ИКСИ с переносом «свежих» эмбрионов начинать введение препаратов прогестерона не позднее третьего дня после забора ооцитов и использовать следующие варианты поддержки:
- 90 мг × 1 р/день микронизированного вагинального прогестерона в форме геля;
- 200 мг × 3 р/день микронизированного вагинального прогестерона в капсулах;
- 50 мг × 1 р/день прогестерона для внутримышечного введения;
- 25 мг × 1 р/день прогестерона для подкожного введения [14].
Согласно данным международных веб-опросов врачей об их клинических практиках в поддержке лютеиновой фазы (ПЛФ), проведенных в период с 2009 по 2019 гг., вагинальный микронизированный прогестерон оставался наиболее часто используемым препаратом. За 10 лет его доля в назначениях препаратов для поддержки лютеиновой фазы увеличилась с 64 до 74%. Сочетание вагинальных и других форм препаратов прогестерона использовали в 18% случаев. В 2019 г. 49% опрошенных докторов начинали терапию прогестероном в день проведения трансвагинальной пункции, 39% – на следующий день. Несмотря на возможность отмены препаратов прогестерона в день положительного теста на хронический гонадотропин, более половины клиницистов (56%) назначали препараты прогестерона до 8–10 недель, 22% – до 10–12 недель беременности [15]. По данным Di Guardo F. et al. (2020), интравагинальный прогестерон для поддержки лютеиновой фазы при ЭКО выбирали 80% врачей [16].
Согласно российским клиническим рекомендациям, поддержку посттрансферного периода в программах ЭКО/ИКСИ необходимо начинать в день трансвагинальной пункции яичников или в первые 3 суток после нее. Длительность поддержки посттрансферного периода определяется врачом акушером-гинекологом в соответствии с инструкцией по медицинскому применению препарата прогестерона, особенностями течения беременности и анамнезом пациентки, но обычно продолжается до 12 недель беременности [17].
Обсуждая собственную клиническую практику, эксперты подчеркнули, что в программах ВРТ они отдают предпочтение вагинальному микронизированному прогестерону. В то же время частой тактикой в криопротоколах, проводимых на фоне заместительной гормональной терапии, становится индивидуализация поддержки лютеиновой фазы в зависимости от уровня прогестерона в сыворотке крови. При этой тактике доза вагинального прогестерона при необходимости увеличивается или дополняется другими формами препаратов прогестерона для достижения его оптимальной концентрации [18].
Вагинальные формы микронизированного прогестерона
Эксперты обсудили современные данные о сопоставимой эффективности различных форм вагинального прогестерона с точки зрения частоты наступления беременности в циклах ВРТ [19, 20]. Учитывая эту сопоставимую эффективность, эксперты согласились, что важными критериями выбора препарата вагинального микронизированного прогестерона являются его переносимость и удобство для пациента – так называемые пациент-репортируемые исходы (patient-reported outcomes).
Особенность лекарственной формы прогестерона в виде вагинального геля – увеличенное время фиксации препарата во влагалище за счет использования мукоадгезивного состава. Пролонгированное высвобождение прогестерона из вагинального геля происходит за счет включения в его состав поликарбофила – полимера полиакриловой кислоты, биоадгезивные свойства которого формируют устойчивые связи с влагалищным эпителием, что позволяет вводить препарат однократно каждые 24 ч [21].
Согласно данным Simunic V. et al. (2007), сравнивавших две вагинальные формы прогестерона (гель и капсулы), эффективность которых по частоте наступления беременности была сопоставимой, респонденты с опытом использования обоих препаратов отметили более положительный опыт при использовании вагинального геля, чем при использовании капсул [22]:
- препарат проще для введения: гель – 89,6%; капсулы – 10,4%;
- препарат более удобен при ежедневном использовании: гель – 93,7%; капсулы – 6,3%;
- препарат меньше вытекает: гель – 75%; капсулы – 25%;
- препарат, которому отдается предпочтение: гель – 85%; капсулы – 14,6%.
Эксперты согласились, что применение вагинального прогестерона в форме геля, с точки зрения пациенток, является более приемлемым в процессе лечения бесплодия в программах ВРТ, и это, несомненно, должно учитываться клиницистом при выборе препарата для поддержки лютеиновой фазы и посттрансферного периода.
Препарат «Миражэль»: опыт применения
В рамках импортозамещения и с целью обеспечения гарантированной доступности препаратов прогестерона был разработан препарат «Миражэль» – первый российский биоадгезивный вагинальный гель микронизированного прогестерона [23], который по своим свойствам полностью соответствует оригинальному препарату. В ходе открытого рандомизированного перекрестного исследования была доказана биоэквивалентность вагинального геля «Миражэль» 90 мг/доза (АО «Вертекс», Россия) вагинальному гелю «Крайнон» 90 мг/доза («Мерк Сероно Лимитед», Великобритания). Установлено, что «Миражэль» не уступает по параметрам безопасности препарату «Крайнон» [24] и сопоставим по эффективности с другими вагинальными формами прогестерона [25].
В вагинальном геле прогестерон включен в полимерную систему доставки, которая связывается со слизистой оболочкой влагалища и обеспечивает непрерывное высвобождение прогестерона по крайней мере в течение трех дней [21]. Благодаря биоадгезии вагинальный гель «Миражэль» «приклеивается» к стенкам влагалища, минимизируя вытекание. Поликарбофил в составе геля «Миражэль» имеет кислую среду, поэтому его применение способствует поддержанию оптимального кислотно-щелочного баланса влагалища и снижает вероятность нарушения микробиоценоза [26].
Вагинальный гель «Миражэль» используют для поддержки лютеиновой фазы в циклах ВРТ, а также у пациенток со вторичной аменореей и дисфункциональными маточными кровотечениями, обусловленными дефицитом прогестерона на этапе прегравидарной подготовки. Биоадгезивный вагинальный гель «Миражэль» выпускается в тубах в двух вариантах – 20 и 50 г, позволяя выбрать размер упаковки, наиболее подходящий пациентке. Одна доза (1,125 г геля) удобно набирается с помощью аппликатора в комплекте и содержит 90 мг прогестерона.
Для поддержки лютеиновой фазы в процессе вспомогательных методов репродукции применяется 1 доза препарата «Миражэль», которая содержит 90 мг прогестерона (1 аппликатор – 1,125 г геля). Гель вводится ежедневно интравагинально до 12 недель беременности.
При вторичной аменорее или дисфункциональных маточных кровотечениях, обусловленных дефицитом прогестерона, вводится 1 доза геля «Миражэль» (1 аппликатор – 90 мг прогестерона) интравагинально через день с 15-го по 25-й день цикла. Доза может быть либо увеличена, либо уменьшена при необходимости.
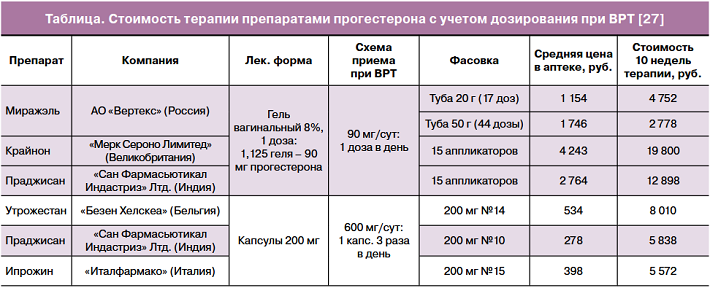
Гель «Миражэль» высококонкурентен с экономических позиций, особенно в сегменте вагинальных гелей, и имеет дополнительные преимущества российского производства и непрерывной доступности, не находящейся в зависимости от международной логистики (таблица) [27]. Обсуждая экономические преимущества препарата, эксперты затронули положительные стороны от возможного включения вагинального геля «Миражэль» в список препаратов, доступных для пациенток в программах ВРТ по ОМС (МНН прогестерон входит в перечень ЖНВЛП) и/или при оформлении протокола ВК (форма введения препарата не входит в перечень ЖНВЛП).
Эксперты поделились положительным собственным опытом применения препарата «Миражэль» на базе ведущих медицинских центров РФ (ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России, ФГБНУ «НИИ АГиР им. Д.О. Отта», МЦ ГК «Мать и Дитя», ООО «Клинический институт репродуктивной медицины» г. Екатеринбург), в том числе наблюдениями о сопоставимой эффективности с позиций частоты наступления и прогрессирующей беременности как в свежих, так и в криоциклах, по сравнению с микронизированным прогестероном в капсулах. Особое внимание было отведено обсуждению сравнительного анализа вагинальных форм микронизированного прогестерона в свежих циклах ЭКО, проведенного в ООО «Клинический институт репродуктивной медицины» в Екатеринбурге в 2023 г.
В исследование были включены 309 пациенток (средний возраст 32,4 года), не имевших избыточной массы тела, со средним номером программы 1,65 (1–4-я попытка ЭКО);
Пациенткам проводился перенос эмбрионов в свежем цикле. У всех пациенток был проведен стандартный протокол с антагонистами гонадотропин-рилизинг-гормона. Всем пациенткам был перенесен один эмбрион 5-х суток развития качества 3–4 по классификации Гартнера и оценкой KID SCORE не менее 7 баллов.
Вагинальный препарат прогестерона был назначен всем пациенткам со следующего дня после пункции; не были включены те пациентки, которые имели риск синдрома гиперстимуляции яичников.
1-я группа пациенток (n=154) получала вагинальный гель прогестерона «Миражэль» (АО «Вертекс», Россия) 90 мг/сут; 2-я группа пациенток (n=155) получала микронизированный прогестерон 200 мг 3 р/сут вагинально («Утрожестан», Besins Healthcare, Бельгия). Между группами не было статистически значимых различий по возрасту, ИМТ, уровням ФСГ и ЛГ, числу полученных ооцитов и средней дозе препарата.
Между группами не было выявлено статистически значимых отличий по частоте клинической беременности в расчете на перенос эмбриона.
Комплаентность к терапии препаратом «Миражэль», по опросу пациентов, была выше в связи с более удобной формой применения и возможностью однократного введения препарата в сутки. Пациентки отмечали более удобное и комфортное применение вагинального геля «Миражэль», а также меньший дискомфорт и меньший эффект «вытекания» препарата при его использовании [25].
Заключение Cовета экспертов
1. Подавляющее большинство специалистов во всем мире отдают предпочтение интравагинальному прогестерону для поддержки лютеиновой фазы при ВРТ [15, 16].
2. Гарантированная доступность лекарственных средств на национальном рынке и отсутствие зависимости от сложных логистических цепей – основа непрерывного доступа пациента к качественной медицинской помощи.
3. «Миражэль» – воспроизведенный препарат микронизированного геля прогестерона для интравагинального применения, разработанный и произведенный в рамках импортозамещения на территории РФ, что позволяет ЛПУ осуществлять бесперебойные закупки как в коммерческих циклах, так и в программах ОМС.
4. Гель «Миражэль» доказал биоэквивалентность референтному препарату «Крайнон» и продемонстрировал сопоставимую клиническую эффективность в сравнении с другими вагинальными препаратами микронизированного прогестерона по частоте наступления клинической беременности в расчете на перенос эмбриона; опрос пациентов продемонстрировал лучшую приверженность к терапии препаратом «Миражэль» в связи с возможностью однократного введения препарата в сутки [24, 25].
5. Совет экспертов рекомендует ввести интравагинальный гель «Миражэль» в широкую практику врачей акушеров-гинекологов как эффективный, доступный и комфортный для применения препарат прогестерона, отвечающий всем требованиям современных методов терапии.



