В сложившейся в настоящее время тенденции изменения структуры инфекционных болезней урогенитальной сферы все большее значение приобретают микроорганизмы, патогенные потенции которых слабо учитывались здравоохранением [1–3]. К таким заболеваниям относится герпесвирусная инфекция. По данным сероэпидемиологических исследований антитела к вирусам простого герпеса выявляются у 70–100% населения [4, 5]. Заболеваемость генитальным герпесом в России за период с 1993 по 2013 г. выросла с 8,5 до 18,4 случая на 100 000 населения. Установлено, что 20–50% взрослых, обращающихся в венерологические клиники, имеют антитела к вирусу простого герпеса [2, 6].
90% населения земного шара инфицировано герпесвирусами, 2–12% страдают рецидивирующими герпесвирусными заболеваниями [1]. Особую опасность представляет заражение вирусом простого герпеса беременных, что нередко приводит к инфицированию плодных оболочек и плода. Результатом данного процесса является хроническое невынашивание беременности, раннее отхождение околоплодных вод, внутриутробная инфекция плода [4].
Необычайно широкая распространенность заболевания, разнообразные варианты вируса простого герпеса, его устойчивость к терапии традиционными противовирусными препаратами и длительное течение заставляют многих исследователей обращать внимание на причины, приводящие к развитию герпесвирусной инфекции и обусловливающие ее персистирование [7, 8]. Определенные трудности связаны с лечением часто рецидивирующего генитального герпеса (РГГ), что обусловлено большим разнообразием вирусов простого герпеса и их пантропизмом, сложностью механизмов развития и течения заболевания, формированием резистентных к базовым препаратам штаммов вирусов герпеса. Известно, что классические антивирусные вещества (ацикловир, бромвинилдиоксиуредин и др.), являясь нуклеоаналогами, взаимодействуют с ДНК вируса и блокируют синтез новых вирусных частиц. Однако в последние годы выявлены новые мутантные штаммы вирусов, нечувствительные к нуклеоаналогам. В то же время они оказались чувствительны к дефензинам и глицирризиновой кислоте (ГК), являющейся активным компонентом препарата кольпоцид. Основными действующими веществами препарата являются пептидогликаны и липотейхоевая кислота, полученные из продуктов ферментации лактобактерий, а также ГК. Липотейхоевая кислота в комплексе с протеогликанами стимулирует выработку дефензинов, которые являются естественными защитными пептидами организма человека, стимулируя репаративные процессы, активируя локальный противовирусный иммунитет. Дефензины составляют большое семейство низкомолекулярных катионных пептидов, которые способны к киллингу широкого спектра патогенов. Они эффективны в отношении ДНК и РНК вирусов, ингибируя их репликацию [1, 3]. Антивирусная активность ГК была обнаружена в последние годы. Было показано, что ГК способна ингибировать ДНК и РНК вирусов. В исследованиях на культуре клеток, зараженных различными вирусами, выявлено, что ГК в концентрациях, хорошо переносимых неинфицированными клетками, ингибирует рост и цитопатическую активность указанных вирусов [7]. Как было показано в последних исследованиях, молекулярный механизм противовирусного действия ГК заключается в ингибировании киназы Р, что приводит к подавлению фосфорилирования клеточных и кодируемых вирусом белков в инфицированных клетках. Таким образом, ГК относится к классу киназных ингибиторов, развитие толерантности вирусов к которым затруднено [7]. Кроме того, активированная ГК является выраженным иммуностимулятором, влияя как на гуморальные, так и клеточные факторы иммунитета. Иммуностимулирующий эффект проявляется индукцией выработки собственных интерферонов, повышением активности Т-лимфоцитов, уменьшением концентрации иммуноглобулинов класса G и увеличением концентрации иммуноглобулинов класса A и M [4].
 Исходя из вышеизложенного, целью настоящей работы стало усовершенствование метода преконцепционной подготовки женщин, больных РГГ, путем разработки нового этиологически и патогенетически обоснованного комплекса терапии с сочетанием системной традиционной противовирусной терапии в комплексе с препаратом липотейхоевой и ГК (кольпоцид-гель).
Исходя из вышеизложенного, целью настоящей работы стало усовершенствование метода преконцепционной подготовки женщин, больных РГГ, путем разработки нового этиологически и патогенетически обоснованного комплекса терапии с сочетанием системной традиционной противовирусной терапии в комплексе с препаратом липотейхоевой и ГК (кольпоцид-гель).
Материал и методы исследования
В период нашей работы наблюдалось 150 женщин в возрасте от 17 до 34 лет – 120 больных РГГ, у которых, после окончания курса предложенной терапии в течение 12 месяцев наступила беременность, завершившаяся рождением ребенка. Исследования проводились на базе кафедр акушерства, гинекологии и перинатологии Кубанского государственного медицинского университета, в ООО «ВИП КлиникГрупп», г. Краснодар. Всем женщинам проведено клинико-лабораторное, общесоматическое, гинекологическое обследование, ультразвуковое исследование органов малого таза, по показаниям – мазки на онкоцитологию, кольпоскопия. Для оценки эффективности современного традиционного и предлагаемого способа терапии методом случайной выборки все больные с обострением РГГ (120 пациенток) были разделены на две репрезентативные группы:
- I группа (60 пациенток), получавших традиционную противовирусную терапию ацикловиром в дозе 200 мг 5 раз в сутки в течение 5 дней;
- II (основная) группа (60 пациенток), которой в комплексное лечение, кроме этиотропной была добавлена топическая терапия препаратом активированной ГК – кольпоцид в виде геля, который применялся 1 раз в сутки на область наружных половых органов и интравагинально в течение 10 дней. Противовирусную терапию начинали одновременно с применением геля. Кроме того, кольпоцид назначали профилактически во время беременности 1 раз в сутки по 5 дней каждый месяц (начиная с 22 недель беременности).
Диагноз РГГ устанавливали на основании клинико-микробиологического обследования. Диагностику инфицированности различными вирусами простого герпеса проводили комплексно: 1) прямая микроскопия; 2) реакция прямой иммунофлуоресценции; 3) метод полимеразной цепной реакции (ПЦР), который обладает 95% чувствительностью, 100% специфичностью; 4) серологическая диагностика с определением иммуноглобулинов (Ig) класса M, A и G. Концентрацию цитокинов (интерлейкин (IL)-1β, IL-8, фактор некроза опухоли (TNF)α, интерферон (IFN)γ, IL-4 и IL-10) в сыворотке крови и в цервикальной слизи определяли твердофазным иммуноферментным методом с использованием наборов по прилагаемым методикам (Caltag Laboratories, USA).
Обследование беременных проводили согласно приказу № 572н от 12.11.2012 г. Министерства здравоохранения Российской Федерации.
Ввиду того, что группы по всем исследованным параметрам были однородными, нами без определения достоверной массовой доли каждого исследуемого признака для суждения о клиническом состоянии больной была предложена интегральная субъективно-объективная балльная оценка (0 баллов – отсутствие симптома, 1 балл – средняя степень выраженности симптома, 2 балла – выраженная симптоматика). Это позволяет в динамике оценивать как интенсивность каждого симптома, так и суммарную интегральную балльную оценку клинической картины. Результаты исследований были обработаны методом вариационной статистики с определением критерия Фишера (F) для оценки непараметрических показателей групп малых выборок и критерием Стьюдента (t) для независимых групп. Анализ проводился с использованием программы Statistica 6.0.
Результаты и обсуждение
Клиническая эффективность
До лечения суммарная балльная оценка клинических проявлений герпетической инфекции в обеих клинических группах была одинаковой, что еще раз подтверждает репрезентативность выборки (рис. 1).
Через 5 дней после окончания проводимой терапии в обеих группах отмечено достоверное (P<0,001) снижение суммы баллов клинической оценки, что свидетельствует о правильности выбора комплексного лечения. Но если в I группе, пациенты которой получали только противовирусную терапию, данный показатель снизился в 3,2 раза, то во II группе больных, получавших предлагаемую комплексную терапию с локальным введением препарата кольпоцид-гель, сумма балльной оценки снизилась в 7,5 раза. Данный факт можно объяснить более эффективной микробиологической санацией вульвовагинальной зоны на фоне сочетанного применения местной терапии гелем кольпоцид, а также достоверной тенденцией к нормализации параметров местного иммунитета с восстановлением естественного микробиоценоза влагалища и повышением противовирусной резистентности как в микробиологическом, так и в клиническом аспектах. Подтверждением этого являются результаты динамического наблюдения пациентов исследуемых групп в течение полугода. При этом обнаружено, что рецидивирование заболевания с возвращением прежней симптоматики по сумме баллов в 2,5 раза чаще (2,36±0,19 против 0,83±0,11 балла соответственно; P<0,001) происходило в группе, которой не проводилось лечение гелем кольпоцид. Более того, основной рост обнаружения вируса простого герпеса в I группе зарегистрирован на месячном сроке мониторинга при значительном снижении его интенсивности в последующие 5 месяцев. Аналогичная закономерность проявляется и при анализе клинических проявлений заболевания.
Таким образом, в клиническом аспекте отмечалась достоверно (P<0,05) более высокая эффективность предлагаемого метода терапии по сравнению с традиционным.
Микробиологическая эффективность
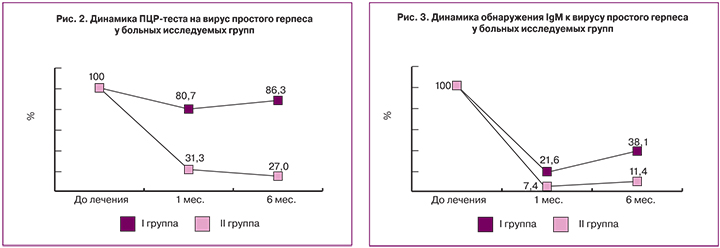
Молекулярно-биологическое исследование в обеих группах было проведено через 1 и 6 месяцев после окончания терапии. В настоящее время считается, что полной элиминации вируса простого герпеса достичь практически невозможно [1, 5]. Тем более интересно было увидеть, что на фоне предложенной терапии с применением препарата кольпоцид-гель (II группа) через 1 месяц обнаружено отсутствие вируса простого герпеса при проведении ПЦР-теста у 68,7% больных, а через 6 месяцев – у 73,0% исследуемых II группы (рис. 2).
В I группе через 1 месяц от начала терапии ПЦР отрицательный результат вируса простого герпеса выявлен у 19,3% женщин, а через 6 месяцев – у 14,7% пациенток. По-видимому, негативация ПЦР-теста происходит за счет малых, не регистрируемых данным методом концентраций ДНК вируса простого герпеса в исследуемом материале.
До начала терапии наличие IgM было выявлено у 100% пациенток I и II исследуемых групп. В ходе мониторинга через 1 месяц от начала терапии во II группе выявлено 21,5% пациентов с обнаруженными клинически значимыми титрами IgM, через 6 месяцев – 33,1%. Во II группе динамика результатов серологического исследования была следующая: через 1 месяц от начала терапии – 7,1% клинически значимых IgM-положительных пациентов, через 6 месяцев – 11,4% женщин с обнаруженным IgM (рис. 3).
Таким образом, микробиологическая эффективность лечения с системным применением ацикловира (I группа) была достаточно высокой, но при использовании предлагаемого метода она достигла практически максимально возможных результатов.
Иммунологическая эффективность
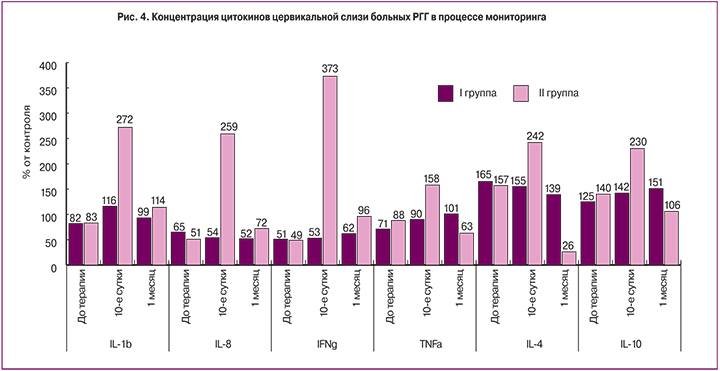
После окончания курса предлагаемой терапии во II группе отмечено значительное повышение концентраций всех исследованных цитокинов цервикальной слизи, за исключением TNFα и IL-4, которые также несколько повысились, но данная динамика была недостоверной (рис. 4). В исследовании, проведенном через 1 месяц мониторинга в основной группе, все исследованные параметры, за исключением достоверного снижения концентрации IL-4, возвратились, с теми или иными колебаниями, к исходным значениям.
В I группе достоверной динамики сывороточной концентрации данных цитокинов не выявлено. Таким образом, при исследовании параметров системного иммунитета у больных РГГ, во-первых, выявлены определенные, но находящиеся в пределах физиологических норм изменения и, во-вторых, показано, что при применении комплексной терапии наблюдается выраженная временная активация ее как антиген-специфических, так и антиген-неспецифических эффекторных структур с преимущественной временной Th1 девиацией. На 10-е сутки лечения в цервико-вагинальной слизи женщин II группы, в комплексную терапию которых был включен препарат кольпоцид, концентрация IL-1β увеличилась в 12 раз (рис. 4). Особенно интересной является динамика IFNγ. Введение в комплексную терапию дефензинов и ГК индуцировало временное повышение синтеза IFNγ с подъемом его концентрации в цервикальной слизи более чем в 37 раз по сравнению с исходной. Чрезвычайно интересной находкой стало выявленное на месячном сроке мониторинга достоверное (P<0,05) повышение в цервико-вагинальной слизи женщин основной группы концентрации IL-1β и снижение IL-4.
Все вышеперечисленное свидетельствует о клинико-иммунологической эффективности предлагаемой терапии РГГ с применением липотейхоевой и ГК (кольпоцид-гель) в комплексе с современным системным противовирусным препаратом, что позволяет рекомендовать ее к широкому клиническому применению.
Беременность и роды
В наше исследование были включены только те пациентки, у которых в течение 12 месяцев после лечения РГГ наступила беременность. Нами проведено динамическое наблюдение за всеми пациентками, прошедшими предложенную преконцепционную подготовку. Выявлено, что в I группе во время беременности обострения генитального герпеса наблюдались у 61,7% женщин, а во II группе, в которой с целью прегравидарной подготовки в комплексе с противовирусной терапией применялся препарат кольпоцид-гель, обострение генитального герпеса зарегистрировано только у 9 (15,0%) беременных. При этом у 6,7% пациенток симптоматика генитального герпеса купировалась после дополнительного применения геля кольпоцид 1 раз в день в течение 5 дней без дополнительного назначения противовирусной терапии. Наличие ультразвуковых маркеров внутриутробной инфекции выявлено у 61,6% беременных I группы и у 12,3% II группы. Осложненные роды с преждевременным излитием околоплодных вод, аномалиями родовой деятельности в группе сравнения зарегистрированы в 33,1% случаев, в основной группе – в 18,3%. Наличие признаков реализации внутриутробной инфекции было отмечено у 58,3% новорожденных I группы и у 11,5% – II группы.
Заключение
Таким образом, применение этиологически обоснованной системной противовирусной терапии на фоне патогенетически обоснованной терапии липотейхоевой и ГК (кольпоцид-гель) позволяет повысить клинико-микробиологическую и иммунологическую эффективность лечения больных РГГ и провести более успешную преконцепционную подготовку.



