Зарегистрированная в конце 2019 г. новая коронавирусная инфекция (COVID-19) охватила весь мир и привела к глобальной пандемии. Известно, что возбудитель заболевания – вирус SARS-CoV-2 при попадании в организм человека начинает взаимодействовать с ангиотензин-превращающим ферментом 2 (ACE2), который представляет собой рецептор на поверхности клетки. Далее вирус проникает в клетки и запускает инфекционный процесс с быстрым прогрессирующим повреждением эндотелия, развитием тяжелой системной воспалительной реакции, активацией внутрисосудистого свертывания с тромботическими осложнениям, микроангиопатической гемолитической анемией, полиорганной недостаточностью. В ответ на вирусную инфекцию активируется система врожденного иммунитета, синтез и высвобождение цитокинов, хемокинов, включая интерлейкин (IL)-6, IL-2, IL-4, IL-6, IL-8, IL-10, фактор некроза опухоли альфа (TNF-α), интерферон гамма (IFN-γ), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), макрофагальный воспалительный белок 1α (MIP1α), MIP-1β и MCP-1, и многие другие, которые способствуют активации молекул адгезии, миграции нейтрофилов, эозинофилов, макрофагов; имеет место, так называемый, «цитокиновый шторм» [1–3].
В последние годы в литературе появился целый ряд работ о применении и достаточно высокой эффективности различных методик озонотерапии (ОТ) в комплексном лечении новой коронавирусной инфекции (COVID-19) [4–6]. Был показан выраженный иммуномодулирующий и противовоспалительный эффект медицинского озона, его стимулирующее влияние как на клеточный, так и на гуморальный иммунитет за счет индукции синтеза иммуноактивирующих цитокинов, трансформирующего фактора роста β1 и β2 (TGF-β1 и TGF-β2) и многих других [7, 8].
Цель данного исследования состояла в оценке содержания про- и противовоспалительных цитокинов в крови пациентов с СOVID-19 при включении системной ОТ в комплексную терапию инфекции.
Материалы и методы
В исследование были включены 65 пациентов с подтвержденным диагнозом COVID-19 со средним и тяжелым течением заболевания, госпитализированных в инфекционный госпиталь ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России в возрасте от 29 до 78 лет, в период с 23.04.2020 по 20.06.2020. Все пациенты проходили лечение в соответствии с Временными методическими рекомендациями МЗ РФ «Профилактика, диагностика и лечение новой коронавирусной инфекции (СOVID-19)» Версия 6 [9]. Группы формировались на основе простой рандомизации 65 пациентов в две группы с использованием генератора групп программы MedCalc v.16.8. Принадлежность пациента к группе определялась при его поступлении в стационар путем вскрытия помеченного порядковым номером пациента в исследовании конверта, в котором была карточка с указанием номера группы, присвоенного данному порядковому номеру при рандомизации. В результате в первой группе (получавших комплексную терапию согласно рекомендациям МЗ РФ и системную ОТ), оказалось 35 пациентов. Вторую группу (получавших терапию согласно рекомендациям МЗ РФ) составили 30 пациентов. По оценочной шкале NEWS [10] производилась оценка степени тяжести состояния пациента с COVID-19, также оценивалась длительность пребывания в стационаре.
В комплексной терапии 35 пациентов первой группы проводилась системная ОТ в виде внутривенного капельного введения 400 мл озонированного физиологического раствора с концентрацией озона в растворе 4 мг/л, который готовили непосредственно перед введением на медицинской озонаторной установке «УОТА 60-01» («Медозон», Россия). Скорость инфузии – 20–25 мл в минуту, всего 6 процедур через день. Критериями включения пациентов в исследование служили согласие пациента с подтвержденным диагнозом COVID-19 на исследование, критериями исключения – неподтвержденный диагноз COVID-19, беременность. Клинические и лабораторные показатели у пациентов оценивали при поступлении, до начала и через 2 недели комплексного лечения. Взятие крови проводили утром, натощак из периферической вены c помощью закрытых систем для взятия венозной крови S-Monovette (Sarstedt, Германия). Содержание С-реактивного белка (СРБ) проводили в сыворотке крови турбидиметрическим методом на автоматическом биохимическом анализаторе ВА-400 (Biosystems, Испания). Определение содержания цитокинов: GМ-CSF, IFN-γ, TNFα, IL-2, IL-4, IL-6, IL-8, IL-10 осуществлялось мультиплексным методом на проточном флюориметре Bioplex 200 (Bio-Rad, США) с использованием коммерческого набора Bio-Plex ProHuman Cytokine 8-plex Panel (Bio-Rad, США.) В соответствии с инструкцией производителя для приготовления образцов ЭДТА-плазмы применяли двукратное центрифугирование образцов периферической крови при 1000g в течение 15 минут при 4°С и 10000g для полного удаления тромбоцитов и осадков. Образцы плазмы замораживали и хранили до момента проведения анализа при температуре -80°С.
Статистический анализ
Статистическая обработка данных проводилась с использованием пакета Microsoft Office Excel 2007 и программы MedCalc v.16.8. Нормальность распределения данных проводили, используя критерии Колмогорова–Смирнова и Шапиро–Уилка. Если распределение параметров отличалось от нормального, данные представлены как медиана и интерквартильный размах (Ме (Q1; Q3), в случае нормального распределения исследуемых параметров данные представлены как среднее (стандартное отклонение), или M(SD). Проверку статистических гипотез об отсутствии межгрупповых различий количественных признаков в нескольких группах осуществляли с помощью критерия Краскела–Уоллиса и Манна–Уитни при сравнении в двух группах при последующем апостериорном анализе. Значимость изменений показателей во время пребывания в стационаре оценивали с помощью критерия Вилкоксона. При анализе количественных признаков в двух группах решение о значимости различий принимали при р<0,05, а в трех – с учетом поправки Бонферрони – при р<0,017. При анализе различий качественных признаков использовали критерий χ2, решение о значимости различий принимали при р<0,05.
Результаты
Детальная клиническая характеристика всех больных, получавших лечение в инфекционном госпитале Центра, была представлена ранее [11]. При анализе клинических показателей пациентов групп данного исследования следует подчеркнуть, что все 65/65 (100%) пациентов жаловались на кашель; 44/65 (67,9%) отмечали выраженную слабость, боли в горле, одышку; у 39/65 (60%) было повышение температуры выше 37,5°С; у 35/65 (53,8%) отмечалась потеря обоняния, у 34/65 (52,3%) – расстройства функции кишечника, у 32/65 (49,2%) – тахикардия, у 27/65 (41,5%) – головная боль, у 7/65 (10,8%) – мышечные боли. По данным компьютерной томографии (КТ) легких, у 38/65 (58,5%) пациентов было КТ 2 и у 27/65 (41,5%) – КТ 3 [12]. Состояние средней тяжести было у 47/65 (72,3%) больных и тяжелое – у 18/65 (27,7%). Снижение сатурации менее 95% было у 38/65 пациентов (58,4%). Средний возраст составил 43,6 (3,2) лет с колебаниями от 29 до 78 лет. Среди сопутствующих заболеваний, осложняющих течение заболевания, чаще всего отмечены: гипертоническая болезнь – у 18/65 (27,7%) больных, ожирение и сахарный диабет – у 12/65 (18,4%) пациентов, у 10/65 (15,4%) – хронический бронхит, эмфизема легких, бронхиальная астма, у 9/65 (13,8%) – ишемическая болезнь сердца, инфаркт миокарда, у 6/65 (9%) пациентов была варикозная болезнь вен ног, у 5/65 (7,7%) – аутоиммунный тиреоидит. Всем 65 пациентам была начата терапия инфекционного заболевания. Пациентам первой группы (n=35) в комплексную терапию была включена системная ОТ, и в среднем каждый пациент получил 6,4 (1,3) процедур ОТ. Все пациенты первой группы перенесли системную ОТ без осложнений.
Анализ данных клинического течения заболевания в первой группе (с ОТ) показал, что после лечения только у 7/35 (20%) пациентов сохранились жалобы на слабость, кашель, одышку, боли в горле и необходимость кислородной поддержки; тогда как во второй группе – у 16/30 (53,3%) больных (р=0,055). Продолжительность пребывания в стационаре в первой группе больных с ОТ в среднем составила 12,2 (2,7) (8–17) дней, в группе без ОТ – 17,9 (4,2) (12–26) (р=0,025). Показатели шкалы NEWS до начала терапии были 4,05 (0,36) баллов; после лечения в первой группе показатели составили 1,35 (0,54) баллов, во второй группе – 2,70 (0,14) баллов (p=0,01).
У всех 65 больных, поступивших в стационар, содержание СРБ в сыворотке крови составило 48,2 (9,1; 159,2) мг/л. После терапии в течение 2 недель в первой группе (с ОТ) этот показатель снизился до 7,29 (1,7; 28,16) мг/л, а во второй группе (без ОТ) – до 7,98 (4,21; 35,67) мг/л, что значимо при сравнении с исходными показателями (р<0,05).
Содержание цитокинов в сыворотке крови у пациентов исследуемых групп представлены в таблице 1.
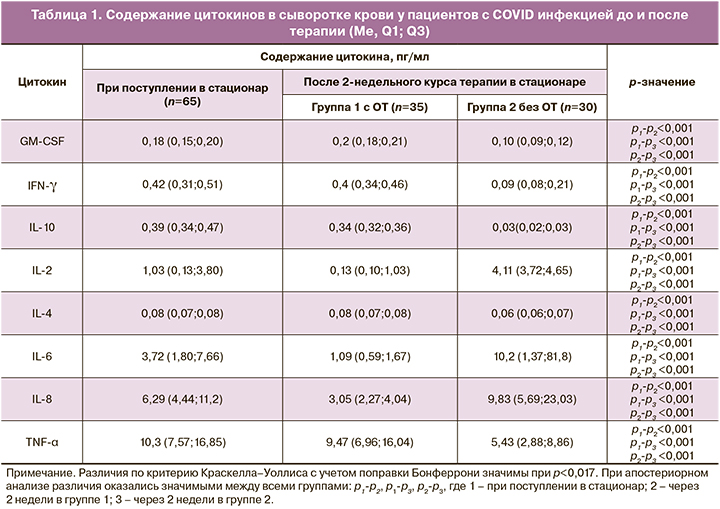
Как видно из представленных в таблице 1 результатов, содержание цитокинов в сыворотке крови у пациентов анализируемых групп через две недели после лечения отличалось от исходного уровня и между собой. Особенно отличаются показатели медиан провоспалительных цитокинов IL-6, IL-8, а также регуляторного IL-2. Оказалось, что содержание вышеуказанных цитокинов осталось повышенным во второй группе пациентов без ОТ, по сравнению с исходными данными при поступлении и по сравнению с первой группой с ОТ. Так, содержание IL-2 в сыворотке крови исходно было 1,03 пг/мл, (0,13;3,80), в первой группе после ОТ снизилось до 0,13 пг/мл (0,13;1,03) (р<0,001), а во 2 группе, напротив, стало еще выше и составило 4,11 пг/мл (3,72;4,65) (р<0,001). Аналогичные тенденции определены и в отношении уровня IL-6, который был 3,72 (1,80;7,66) пг/мл при поступлении, в первой группе после ОТ содержание IL-6 снизилось до 1,09 (0,59;1,67) пг/мл (р<0,001), а во второй группе содержание IL-6 стало еще выше и составило 10,2 (1,37;81,8) пг/мл, (р<0,001). Содержание цитокина IL-8 исходно было 6,29 (4,44;11,2) пг/мл, далее значимо снизилось в первой группе пациентов до 3,05 (2,27;4,04) пг/мл (р<0,001), и, напротив, во второй группе пациентов после лечения показатель IL-8 стал еще выше и составил 9,83(5,69;23,03) пг/мл (р<0,001), что свидетельствует о сохранении активного системного воспалительного ответа во второй группе пациентов.
При исследовании противовоспалительных цитокинов в группах больных особенно значимые изменения выявлены в отношении IL-10. Так, в первой группе пациентов с ОТ содержание IL-10 значимо выше, по сравнению со значениями во второй группе (без ОТ): 0,34 (0,32;0,36) пг/мл и 0,03 (0,02;0,03) пг/мл соответственно, (р<0,001).
В таблице 2 представлены результаты анализа соотношений про- и противовоспалительных цитокинов у пациентов с COVID инфекцией.
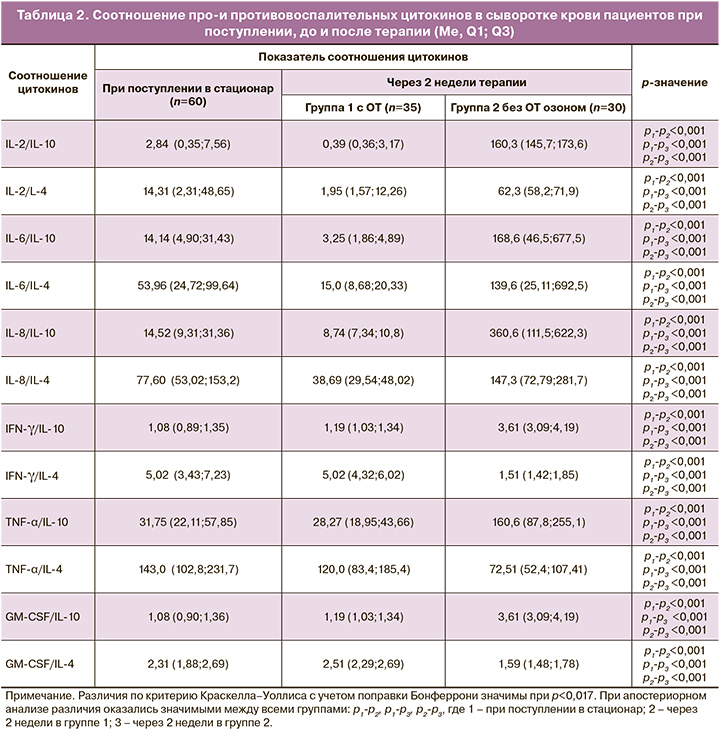
Анализ результатов соотношений про- и противовоспалительных цитокинов, представленных в таблице 2, показал, что в первой группе пациентов соотношения IL-2/IL-10, IL-2/IL-4, IL-6/IL-10, IL-6/IL-4, IL-8/IL-10, IL-8/IL-4 после ОТ значимо снижаются, по сравнению с исходными значениями, что может подтверждать наличие признаков снижения активности воспалительного процесса. Во второй группе пациентов без ОТ, напротив, соотношение указанных цитокинов возрастает в несколько раз. Так, соотношение IL-2/IL-10 во второй группе после лечения возросло с 2,84 (0,35; 7,56) до 160,3 (145,7;173,6) (р<0,001), а в первой группе, напротив, снизилось до 0,39 (0,36;3,17) (р<0,001).
Что касается соотношения других цитокинов, то, например, TNF-α/IL-4 значимо снизилось со 143,0 (102,8;231,7), как в первой группе пациентов (до 120,0 (83,4;185,4), р<0,001), так и во второй группе (до 72,51 (52,4;107,41), р<0,001); соотношение GM-CSF/IL-4 в первой группе возросло с 2,31 (1,88;2,69) до 2,51 (2,29;2,69) (р<0,001), а во второй – снизилось до 1,59 (1,48;1,78) (р<0,001). Такие тенденции отражают сложные взаимосвязи в иммунологическом ответе при развитии воспалительного процесса, обусловленные активацией клеток, как врожденного, так и клеточного иммунитета.
Также нами был проведен парный анализ содержания цитокинов до и после терапии в сыворотке крови у одних и тех же пациентов первой группы. Результаты представлены в таблицах 3 и 4, соответственно.

Анализ результатов, представленных в таблице 3, показал, что у пациентов с COVID-19 через две недели комплексного лечения с включением системной ОТ выявлено значимое снижение IL-2, IL-6, IL-8, IL-10, TNF-α.
При анализе показателей, представленных в таблице 4, выявлено значимое снижение соотношений про- и противовоспалительных цитокинов, таких, как IL-2/L-4, IL-6/IL-10, IL-6/IL-4, IL-8/IL-10, IL-8/IL-4 и TNF-α/IL-4. А соотношение IFN-γ/IL-10 и GM-CSF/IL-10 несколько возрастает (р<0,05).
В таблице 5 представлены результаты исследования концентрации цитокинов в сыворотке крови у 15 пациентов второй группы (без ОТ).

Представленные в таблице 5 результаты свидетельствуют об отсутствии изменений концентрации цитокинов после проведения стандартного лечения без применения ОТ, за исключением IL-6, концентрация которого значимо возросла через 2 недели терапии: 3,59 (2,49;5,36) пг/мл до лечения и 9,04 (1,55;110,81) пг/мл – после стандартного лечения (р=0,0413, р<0,05), что отражает сохранение активности воспалительного процесса.
В соотношениях про- и противовоспалительных цитокинов (IL-2/L-4, IL-6/IL-10, IL-6/IL-4, IL-8/IL-10, IL-8/IL-4, IFN-γ/IL-10 и GM-CSF/IL-4) в плазме крови до и после стандартной терапии у пациентов второй группы также не выявлено значимых изменений, за исключением соотношения TNF-α/IL-4, которое значимо снизилось после лечения с 97,05 (79,40;133,61) до 72,06 (49,45;106,93) (р=0,02).
Обсуждение
SARS-CoV-2, который быстро распространился по всему миру, является высоко контагиозным респираторным вирусом, поражающим не только легкие, но вызывающим системное заболевание, поскольку шиповидный белок коронавируса связывает рецептор ACE2, который присутствует во многих тканях, например, в эпителии тонкой кишки, в артериальных и венозных эндотелиальных клетках, гладкомышечных клетках артерий желудка, тонкой кишки, толстой кишки, кожи, лимфатических узлов, тимуса, костного мозга, селезенки, печени, почек и головного мозга [13–15]. Многочисленные исследования последних лет показали, что тяжелая степень течения COVID-19 характеризуется чрезмерным воспалением, о чем свидетельствует выраженное повышение уровня СРБ и провоспалительных цитокинов и хемокинов в сыворотке крови, что получило название «цитокинового шторма». Продукция провоспалительных цитокинов IL-1β, IL-2, IL-4, IL-6, IL-8 и TNF-α вызывает различные эффекты, включая высвобождение других воспалительных и хемотаксических факторов, которые активируют молекулы адгезии и увеличивают миграцию эозинофилов и нейтрофилов, тем самым активируя врожденный иммунный ответ [16]. При резком повышении уровня IL-6 и нарушении регуляции некоторых цитокинов, например, таких как IFN-γ, GM-CSF и других происходит нарушение баланса между провоспалительными и противовоспалительными цитокинами [17]. Повышенный уровень системного IL-6 у пациентов с COVID-19 рассматривается, как значимый параметр для прогнозирования наиболее тяжелого течения заболевания и необходимости проведения интенсивной терапии [18]. В комплексную терапию больных с инфекцией COVID-19 было предложено использование системной ОТ в виде внутривенных инфузий озонированного физиологического раствора. Есть мнение специалистов Ассоциации Российских озонотерапевтов и врачей других стран о целесообразности применения медицинского озона для профилактики и лечения коронавирусной инфекции, как безопасного, недорогого и эффективного метода терапии [19–21].
При обследовании 65 пациентов с COVID-19 инфекцией со средним и тяжелым течением заболевания изучены концентрации целого ряда цитокинов и хемокинов в динамике лечения. Показаны различия в динамике ряда про- и противовоспалительных цитокинов в крови пациентов в группах с ОТ и без ОТ. Содержание IFN-γ в плазме крови в группе пациентов, которым проводилась ОТ, остается фактически на том же уровне, что и до лечения, что указывает на очевидную необходимость дальнейшей реабилитации пациентов с перенесенной коронавирусной инфекцией.
Важное значение имеет GM-CSF в развитии воспалительного процесса, поскольку данный ростовой фактор способствует активации и пролонгированному выживанию моноцитов, макрофагов и нейтрофилов, увеличивает пул провоспалительных цитокинов, выделяемых этими клетками, и содействует фагоцитозу и освобождению/клиренсу поврежденных тканей от инфекционных агентов. В связи со сказанным отсутствие изменений в концентрации GM-CSF в крови пациентов через две недели комплексной терапии, в том числе и с использованием озона, следует рассматривать как фактор сдерживания воспалительного процесса [4, 22, 23].
Результаты проведенного нами исследования продемонстрировали наличие эффекта ОТ на концентрацию исследованных провоспалительных и противовоспалительных цитокинов в динамике терапии. Механизмы эффективности ОТ при коронавирусной инфекции многообразны, включая адаптацию к окислительному стрессу и индукцию про- и противовоспалительных цитокинов. Эффектом ОТ является и образование алкеналов вследствие окисления жирных кислот в крови, в частности, омега-6 и омега-3, переносимых альбумином. Они действуют как преобразователи сигнала, активируя цитоплазматический белок Nrf2 и, следовательно, транскрипцию нескольких антиоксидантных генов под промотором ARE (антиоксидант-респонсивный элемент) [24]. Эти генные продукты ингибируют каскад воспалительных цитокинов и инфламмасому NRLP3 и приводят к синтезу противовоспалительных цитокинов, таких как IL-10 [25–27]. Кроме того, производные озона действуют на вирусы посредством окисления капсида, с большей эффективностью у вирусов с липидным покрытием, чем у вирусов с белковым капсидом, что резко снижает вирусную нагрузку. Дополнительными эффектами ОТ являются уменьшение агрегационной способности эритроцитов и снижение вязкости и улучшение реологии крови в системе макро- и микроциркуляции [8].
Включение ОТ в состав комплексной терапии пациентов с COVID-19 привело к формированию противовоспалительных и иммуномодулирующих эффектов, способствующих купированию воспалительного процесса, улучшению состояния пациентов и сокращению сроков пребывания в стационаре. Поэтому системную ОТ можно рекомендовать включать в комплексное лечение пациентов со средним и тяжелым течением инфекции, вызванной SARS-CoV-2 [28, 29].
Заключение
Полученные результаты по анализу содержания цитокинов в крови инфицированных SARS-CoV-2 свидетельствуют о снижении активности, так называемого, «цитокинового шторма», который также наблюдается и при инфекциях, вызываемых другими вирусами SARS. Полученные данные демонстрируют различную динамику исследованных цитокинов в группах пациентов, получавших стандартную терапию и комплексную терапию с включением озона. Нами показано снижение концентрации провоспалительных цитокинов, а также улучшение клинических показателей и снижение показателей по шкале тяжести состояния NEWS, а также длительности пребывания в стационаре в группе пациентов, получавших комплексную терапию в сравнении с показателями в группе пациентов, получавших стандартную терапию.



