Рак шейки матки (РШМ) является одной из наиболее распространенных опухолей и занимает четвертое место в структуре онкологических заболеваний. В 2020 г. зарегистрировано 604 127 новых случаев заболевания, смертность составила 341 831 случай [1]. С целью предотвращения и профилактики заболевания во всех странах мира предусмотрено проведение скрининга РШМ.
В России скрининг РШМ осуществляется цитологическим методом и предусмотрен в возрасте 21–29 лет 1 раз в 3 года, в возрасте от 30 до 65 лет проводится ко-тестирование (цитология и определение вируса папилломы человека (ВПЧ) высокого онкогенного риска) 1 раз в 5 лет [2]. Длительное время скрининг включал только цитологическое исследование (Пап-тест или жидкостную цитологию). При высокой специфичности недостатками данного метода являются недостаточная чувствительность, которая составляет 53,0% (30–87%), а также большое число дискордантных результатов при проведении исследования разными патологоанатомами и при сопоставлении результатов с гистологическим исследованием [3–5]. Корреляция цитологии и гистологии (cytology histology correlation (CHC)) является одним из важных критериев оценки качества скрининга РШМ [6]. Так, при сопоставлении результатов цитологического и гистологического исследований у 415 пациенток с заболеваниями шейки матки соответствие диагноза было достигнуто у 194 (46,7%) пациенток. Общее число незначительного несоответствия составило 192 (46,4%) случая, а общее число значительного несоответствия цитологического и гистологического заключений составило 29 (6,9%) случаев [7]. Bergeron C., von Knebel Doeberitz M. было обнаружено, что тестирование на ВПЧ показало более раннее обнаружение плоскоклеточных интраэпителиальных поражений высокой степени (HSIL) по сравнению с цитологическим исследованием [8].
В связи с более высокой чувствительностью (96,1%) ВПЧ-тестирование было включено в скрининговые программы РШМ, в том числе в некоторых странах в качестве первичного теста. Однако данный метод имеет низкую специфичность из-за широкого распространения ВПЧ-инфекции, которая, по различным оценкам, составляет от 16 до 24% [9–10]. В большинстве случаев наблюдается транзиторное течение папилломавирусной инфекции (ПВИ), элиминация вируса происходит в течение последующих 12–18 месяцев. Персистенция вируса высокого канцерогенного риска более 24 месяцев может приводить к развитию цервикальной интраэпителиальной неоплазии (CIN). При дальнейшей персистенции ВПЧ-инфекции риск прогрессии заболевания до CIN3 в течение 5 лет составляет: при нормальных результатах цитологического заключения (NILM) – 5–7,4%, при ASCUS – 8–10%, при LSIL – 15–17% [11]. Вместе с тем большинство женщин с дисплазией легкой степени подвержены инвазивным манипуляциям на шейке матки, которых можно было избежать при низком риске прогрессии заболевания.
В связи с этим чрезвычайно актуальной является задача выявления в когорте ВПЧ-инфицированных женщин пациенток с «тяжелыми» поражениями шейки матки (HSIL, РШМ) и быстрой прогрессией заболевания при «малых» поражениях. Молекулярно-генетические методы являются хорошим подспорьем в решении данной задачи. В публикации Мельниковой Н.В. и соавт. продемонстрирована возможность проведения дифференцировки пациенток с цервикальной интраэпителиальной неоплазией CIN2 и ≤CIN1 на основе экспрессии 21-генной панели мРНК методом количественной полимеразной цепной реакции [12].
Цель настоящего исследования состояла в разработке способа определения «тяжелых» ВПЧ-ассоциированных поражений шейки матки и риска прогрессии «малых» форм поражений с использованием молекулярно-генетических методов.
Материалы и методы
В исследование включены 466 пациенток в возрасте от 20 до 49 лет, обратившихся в научно-поликлиническое отделение ФГБУ «НМИЦ АГП им. В.И. Кулакова» с декабря 2015 г. по март 2019 г. Критерии включения: репродуктивный возраст от 20 до 49 лет; регулярный менструальный цикл; для групп исследования: цитологическое и/или гистологическое заключение NILM, ASCUS, LSIL, HSIL или РШМ и наличие ВПЧ канцерогенного риска, для контрольной группы: отсутствие ВПЧ-инфекции и цитологическое заключение NILM; способность выполнять требования протокола; подписанное информированное согласие на участие в исследовании. Критерии исключения: беременность; послеродовый период и лактация; прием гормональных препаратов; наличие острых воспалительных заболеваний (специфической и неспецифической этиологии); отсутствие возможного следования протоколу.
Помимо этого, 90 женщин с «малыми» формами поражения эпителия шейки матки были включены в проспективное обсервационное исследование и находились под динамическим наблюдением с обследованием каждые 6 месяцев в течение 24 месяцев.
Проведены цитологическое, молекулярно-генетическое исследование, кольпоскопия, выполнена биопсия (по показаниям, с последующим гистологическим исследованием биоптата). Цитологическое исследование осуществлялось с использованием закрытой автоматической технологии BD Sure Path c приготовлением клеточных препаратов на жидкой основе и трактовкой клеточного состава автоматическим и ручным способом в соответствии с классификацией по системе Бетесда (пересмотр в 2014 г).
Материалом для лабораторных исследований были соскобы клеток цервикального канала, взятые в специальные транспортные среды для жидкостной цитологии (BD Sure Path), ВПЧ-типирования («Стор-Ф»), экспрессии генов («Стор-экс»). Выделение ДНК ВПЧ проводили с использованием набора «Проба-ГС», РНК – «Проба-НК». Далее проводили реакцию обратной транскрипции и полимеразной цепной реакции (ОТ-ПЦР) для определения уровня экспрессии 11 целевых генов: ESR1, PGR (рецепторы эстрогена и прогестерона), MKI67, MYBL2, CCNB1, CDKN2A (гены, регулирующие пролиферацию и клеточный цикл), ANLN (ген, регулирующий инвазию), BCL2, BAG1 (гены апоптоза), EXO1 (ген, регулирующий репликацию и репарацию ДНК) и UBE2T (утилизация белков), а также двух референсных генов B2M и GUSB. Транскрипционный профиль генов определялся методом мультиплексной ОТ-ПЦР «в реальном времени» (по два гена в одной пробирке) в соответствии с рекомендациями производителя с праймерами и флуоресцентно меченными зондами (Fam, Cy5) к кодирующим фрагментам генов. Использованы реактивы и детектирующие амплификаторы «ДТПрайм» в соответствии с инструкциями и рекомендациями производителя (ООО «НПФ ДНК-Технология», Россия). По завершении амплификации уровень представленности транскриптов рассчитывали методом сравнения индикаторных циклов (∆Cр) с нормировкой относительно референсных генов B2M и GUSB.
ВПЧ-типирование (типы высокого онкогенного риска: 16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82, типы низкого онкогенного риска: 6, 11 и 44 (55)) осуществлялось методом ПЦР с детекцией результатов в режиме реального времени с использованием наборов «HPV квант-21» (ООО «НПФ ДНК-Технология», Россия).
Исследование было одобрено Комиссией по этике ФГБУ «НМИЦ АГП им. В.И.Кулакова» Минздрава России (протокол №4 от 12.10.2015 г.). Пациентки, включенные в исследование, подписали добровольное информированное согласие.
Статистический анализ
В исследуемых группах в качестве меры центральной тенденции уровня экспрессии рассчитывали медиану (Me). Значимость межгрупповых различий определяли с помощью U-критерия Манна–Уитни. Различие между группами полагали статистически значимым при p<0,05. Разработка алгоритмов способа определения «тяжелых» ВПЧ-ассоциированных поражений шейки матки и риска прогрессии «малых» форм поражений (индекса риска (ИР)) осуществлялась с использованием множественного логистического регрессионного анализа. В качестве независимых (предикторных) переменных включались ln значений уровней экспрессии генов и наличие ВПЧ-ВР. Переменными отклика были наличие/отсутствие прогрессирующей неопластической трансформации эпителия шейки матки. При оценке качества работы бинарного классификатора использовали ROC-анализ. Обработку полученных результатов проводили в программе SPSS Statistics версия 17.0.
Результаты
По результатам цитологического/гистологического исследования сформированы следующие группы: ВПЧ-инфицированные женщины с нормальными результатами цитологии (NILM; группа 1; n=97), ASCUS (группа 2; n=28), LSIL (группа 3; n=61), HSIL (группа 4; n=60) и РШМ (группа 5, n=21), в контрольную группу сравнения включены 199 женщин без ВПЧ с цитологическим заключением NILM.
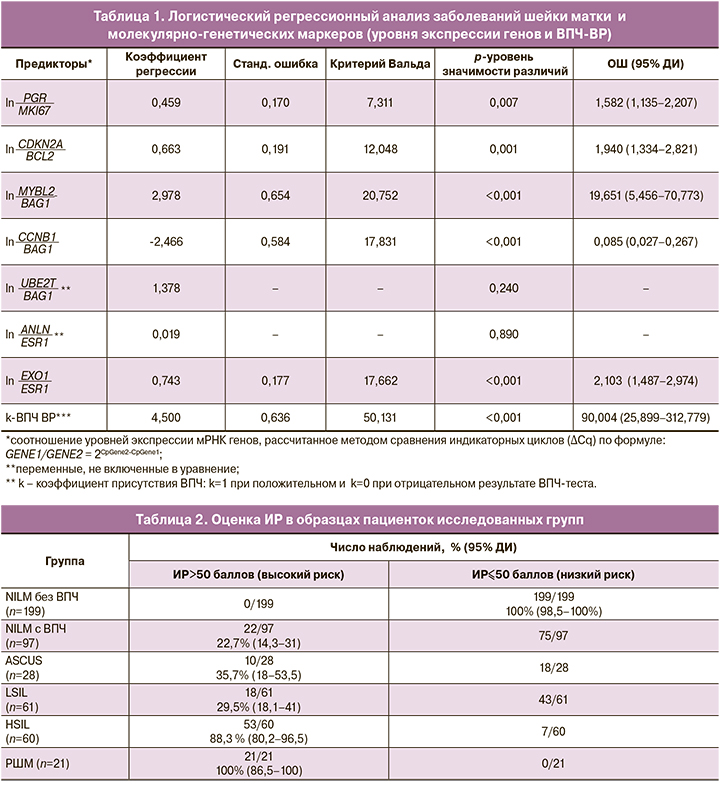
В результате исследования установлено, что по мере нарастания степени тяжести поражения эпителия шейки матки, ассоциированного с ВПЧ-ВР, увеличивался уровень экспрессии мРНК генов MKI67, MYBL2, CCNB1, CDKN2A, ANLN, EXO1, UBE2T и снижался уровень экспрессии мРНК генов ESR1, PGR, BCL2, BAG1 (рис. 1).
 Результаты регрессионного анализа представлены в таблице 1, результаты разделения образцов в исследованных группах в зависимости от значения ИР приведены в таблице 2.
Результаты регрессионного анализа представлены в таблице 1, результаты разделения образцов в исследованных группах в зависимости от значения ИР приведены в таблице 2.
Высокий риск определен в 53 из 60 образцов с цитологическим заключением HSIL и во всех образцах РШМ. Диагностическая чувствительность составила 88,3% (80,2–96,5%) при HSIL и 100% (86,5–100%) при РШМ (табл. 2). Площадь под ROC-кривой составила 0,968±0,010 (р=2,9×10-45). Дискриминационный порог для разделения классов (cut-off) оставлен на уровне 50 баллов.
ИР менее 50 баллов определен во всех 199 образцах без ВПЧ с цитологическим заключением NILM. Диагностическая специфичность составила 100% (98,5–100%).
В качестве примера представляем клиническое наблюдение.
Клиническое наблюдение
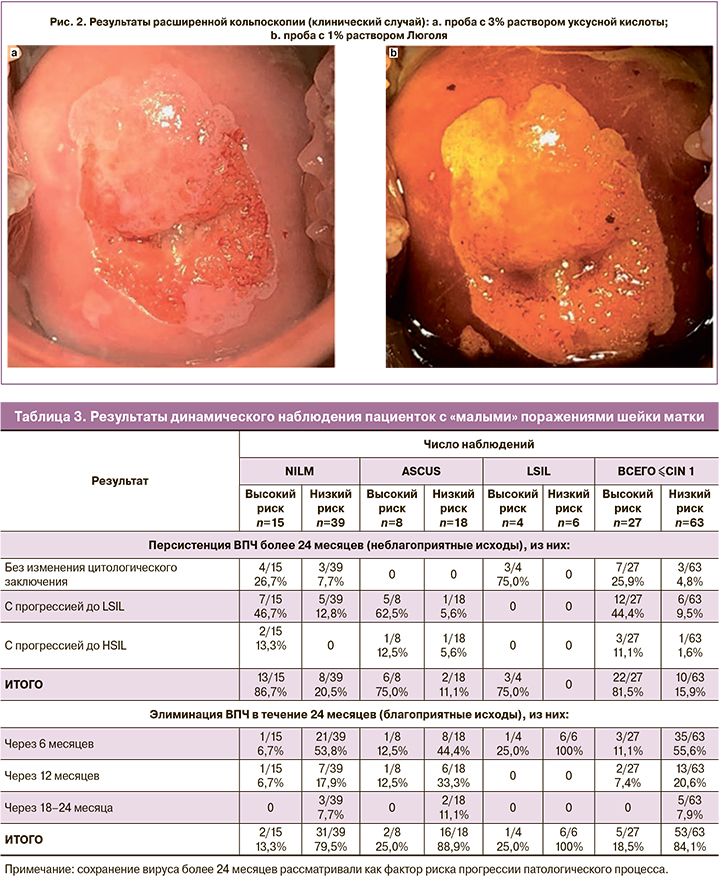
Пациентка В., 27 лет. Цитологическое заключение соответствовало NILM, определялся ВПЧ 16 типа. Значение ИР рассчитано по формуле:
ИР= 1/(1+e-z)×100%,
где e=2,71828 – значение натурального логарифма; z – значение граничной функции, рассчитанное по экспериментальным данным: z=0,459×ln 226,1-30,8 + 0,663×ln 231,8-29,5 + 2,978×ln 228,4-29,4 - 2,466×ln 228,4-28,6 + 0,743×ln 224,7-32,7 + 4,500×1. Значение ИР составило 79 баллов, в связи с чем пациентке была проведена кольпоскопия. При кольпоскопии были выявлены слабовыраженные изменения эпителия шейки матки (рис. 2). После проведения прицельной биопсии гистологическое заключение соответствовало CIN2.
В группу высокого риска попало от 22,7 до 35,7% образцов с «малыми» поражениями шейки матки (≤СIN1). Под динамическим наблюдением в течение 24 месяцев с мониторингом каждые 6 месяцев находились 90 женщин. Исходы динамики в исследуемых группах представлены в таблице 3.
В группе NILM при наличии риска в 13 из 15 случаев сохранилась персистенция вируса более 24 месяцев с прогрессией типа мазка до LSIL или HSIL в 7 и в 2 случаях соответственно. В группе ASCUS при наличии риска в 6 из 8 случаев сохранилась персистенция вируса более 24 месяцев с прогрессией типа мазка до LSIL или HSIL в 5 и в 1 случае соответственно. В группе LSIL при наличии риска в 3 из 4 случаев сохранилась персистенция вируса более 24 месяцев без изменения типа мазка. При наличии риска элиминация вируса произошла в группе NILM в 2 из 15 случаев, в группе ASCUS – в 2 из 8 случаев, в группе LSIL – в 1 из 4 случаев.
При отсутствии риска элиминация вируса произошла в группе NILM в 31 из 39 случаев, в группе ASCUS – в 16 из 18 случаев, а также во всех 6 случаях в группе LSIL. При отсутствии риска в группе NILM персистенция вируса более 24 месяцев сохранилась в 8 из 39 случаев с прогрессией типа мазка до LSIL в 5 случаях; в группе ASCUS сохранилась персистенция вируса более 24 месяцев с прогрессией типа мазка до LSIL и HSIL по одному случаю.
Всего у пациенток с «малыми» поражениями шейки матки (≤CIN1) при наличии риска в 22 из 27 случаев (81,5%) сохранилась персистенция вируса более 24 месяцев с прогрессией типа мазка до LSIL или HSIL в 12 и в 3 случаях соответственно (истинно положительные прогнозы). При наличии риска элиминация вируса произошла в 5 из 26 случаев (18,5% – ложноположительные прогнозы).
При отсутствии риска элиминация вируса произошла в 53 из 63 случаев (84,1% – истинно отрицательные прогнозы). При отсутствии риска персистенция вируса более 24 месяцев сохранялась в 10 из 63 случаев (15,9% – ложноотрицательные прогнозы) с прогрессией типа мазка до LSIL и HSIL в 6 и 1 случае соответственно.
Таким образом, при наблюдении на протяжении 24 месяцев за пациентками с «малыми» поражениями шейки матки неблагоприятный прогноз подтвержден в 81,5% случаев, благоприятный – в 84,1% случаев.
Обсуждение
ВПЧ-тестирование широко используется в диагностике поражений шейки матки. ВПЧ высокого онкогенного риска (16, 18, 26, 30, 31, 33, 34, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 67, 68, 69, 70, 73, 82, 85, 97) широко распространены в популяции – от 75 до 80% сексуально активных женщин заражаются ВПЧ в течение своей жизни [13]. Большинство случаев заканчивается элиминацией вируса, которая происходит в среднем через 375–542 дня после инфицирования [14]. В нашем исследовании в результате динамического наблюдения в течение 24 месяцев установлено, что ВПЧ-ВР не был выявлен у 38 (42,2%) из 90 пациенток уже через 6 месяцев, у 15 (16,7%) – через 12 месяцев и у 5 (5,6%) – через 18–24 месяца, т.е. более чем в половине случаев произошла элиминация вируса (64,4%). Аналогичные результаты получены нами ранее [15]. Полученные результаты сопоставимы с исследованиями Rodriguez A.C. et al., Weaver B. et al., в соответствии с которыми у 85% ВПЧ-инфицированных женщин элиминация вируса происходит в течение 8–24 месяцев с момента инфицирования [16, 17]. В исследовании Турановой О.В. и соавт. элиминация ВПЧ спустя 6 месяцев произошла у 57,1% пациенток [18].
По результатам метаанализа A.F. Rositch et al., элиминация вируса зависит от типовой принадлежности и осуществляется через 10,9–11,5 месяцев после инфицирования. При этом у 58,7% пациенток элиминация ВПЧ происходит в первый год наблюдения и лишь у 9,5 и 3,2% – через 18 и 24 месяца, соответственно [19].
В связи с широким распространением папилломавирусной инфекции, высокой частотой элиминации вируса, с одной стороны, стоит задача выявления «тяжелых» форм поражения эпителия шейки матки, а с другой – выявления в когорте ВПЧ-инфицированных женщин пациенток с «малыми» формами эпителия шейки матки, подверженных риску прогрессии патологического процесса до CIN3. На решение данных задач и была направлена данная работа. Были использованы маркеры (мРНК генов человек и ДНК ВПЧ-ВР), уровень экспрессии которых разнонаправленно изменялся (повышался или снижался) по мере нарастания степени тяжести поражения эпителия шейки матки.
Удалось разработать модель интегральной оценки уровня экспрессии генов, которая позволила выявлять «тяжелые поражения» шейки матки, включая пропущенные по цитологии 3 дополнительных случая дисплазии тяжелой степени (HSIL), далее подтвержденных по гистологии. Один из таких примеров представлен в результатах исследования (клиническое наблюдение). Учитывая значительное несоответствие цитологического (NILM) и гистологического (HSIL) заключений, определение ИР у данной пациентки продемонстрировало раннюю диагностику предракового поражения шейки матки. В перспективе разработанная модель может быть использована в клинической практике в качестве дополнительного метода отбора пациенток для проведения кольпоскопии и биопсии.
Однако, по нашему мнению, наибольший интерес разработанный способ интегральной оценки экспрессии генов и ВПЧ может представлять для прогноза ПВИ. У пациенток с «малыми» формами поражения эпителия шейки матки при сортировке образца в группу риска (ИР>50 баллов) чаще сохранялся ВПЧ (81,5% против 15,9%) в течение 24 месяцев, а также наблюдалась прогрессия типа мазка до LSIL (44,4% против 10,5%) и HSIL (12,5% против 1,6%).
Аналогичный подход реализован в тесте QIAsure Methylation Test (Qiagen, Германия), при использовании которого можно выявить гиперметилирование ДНК гена FAM19A4 и микро РНК hsa-mir124-2. Гиперметилирование ДНК приводит к снижению экспрессии данных маркеров и ассоциировано с РШМ и распространенными поражениями CIN2/3, связанными с продолжительностью ВПЧ-ВР-инфекции более 5 лет, которые имеют повышенный уровень метилирования и хромосомные аберрации («раковый» (эпи)генетический профиль). Тест QIAsure имеет следующие клинические характеристики для выявления CIN3 и РШМ: чувствительность составляет 66–67% для CIN3 и 100% для РШМ при тестировании образцов, взятых врачом или при самозаборе биоматериала. Полагают, что положительный результат обеспечивает эффективное выявление РШМ и распространенных поражений CIN2/3, имеющих ожидаемый высокий краткосрочный риск прогрессирования до РШМ [20]. Отрицательный Тест QIAsure, с другой стороны, указывает на низкий риск РШМ в течение последующих 14 лет [21].
Тест QIAsure одобрен FDA, предназначен для определения «тяжелых» поражений шейки матки и сортировки ВПЧ-позитивных образцов или образцов с атипичными плоскоклеточными клетками неопределенного значения (ASC-US) при цитологии для проведения кольпоскопии и последующей биопсии по показаниям.
Примерно с такой же частотой (24,9%), как и в нашем исследовании, тест дает положительные результаты при ≤CIN1 [22]. Однако предположения по поводу данного наблюдаемого явления разработчики теста QIAsure не представляют. По-нашему мнению, это могут быть быстро прогрессирующие формы ВПЧ-ассоциированных поражений.
Данное исследование является пилотным и заслуживает дальнейшей валидации на большей выборке в соответствии с требованиями Руководства TRIPOD, которые будут учтены при планировании, проведении, анализе дальнейших исследований и отчетности по ним с использованием данной модели [23].
Заключение
В перспективе разработанная модель подлежит дальнейшей апробации и, вероятно, может быть использована в клинической практике при скрининге и профилактике РШМ в качестве дополнительного метода для сортировки образцов с «тяжелыми» поражениями и риском прогрессии патологического процесса, а также отбора пациенток для проведения кольпоскопии и биопсии по показаниям.



