Выход бластоцисты из блестящей оболочки (т.е. хетчинг) является необходимым условием для адгезии и нидации эмбриона в эндометрий и наступления беременности. Устойчивость zona pellucida (zp) к действию литических ферментов является одним из неблагоприятных явлений, возникающих в процессе криоконсервации/оттаивания ооцитов и эмбрионов. Такое «упрочнение» zp приводит к повышению ее устойчивости к действию лизинов, секретируемых трофэктодермой эмбриона, что, в свою очередь, приводит к нарушению вылупления бластоцисты [1]. Тем не менее, данный феномен может быть сведен к минимуму использованием процедуры вспомогательного хетчинга.
Процедура витрификации бластоцисты человека может приводить к упрочнению zp эмбриона. Сообщалось, что после витрификации бластоцист человека значительно увеличивается устойчивость к ферментативному удалению проназой zp, по сравнению с эмбрионами не подвергавшимися процедуре криоконсервации/оттаивания [2]. Также сообщалось, что вспомогательный хетчинг улучшает клинические исходы в циклах переноса криоконсервированных/оттаянных эмбрионов [3]. Существует вероятность того, что бластоцисты со сниженной жизнеспособностью не в состоянии самостоятельно вылупиться даже после частичного удаления или истончения zp. Кроме того, вылупление эмбриона через отверстие в zp, полученное в результате применения вспомогательного хетчинга, также требует от бластоцисты значительных энергетических затрат и может вызывать заметное изменение их формы [4]. Поэтому Vajta G. и соавт. [4] предположили, что полное удаление zp у бластоцисты может иметь бóльшее положительное влияние на ее имплантацию, нежели частичное удаление или нарушение целостности zp. В предварительных исследованиях Hiraoka K. было показано, что при переносе витрифицированных/оттаянных бластоцист полное удаление zp приводило к более высоким долям беременности, имплантации и родов, чем частичное удаление zp [5].
Целью настоящего исследования является оценка эффективности программ ЭКО при переносе в криоцикле витрифицированных/оттаянных бластоцист, у которых, механическим способом была полностью удалена блестящая оболочка по сравнению с переносом zp-интактных эмбрионов.
Материалы и методы
Работа проводилась на базе клиники «АльтраВита», Москва. В настоящем исследовании приняли участие 431 пациентка, проходящая лечение методами ЭКО с переносом витрифицированных/оттаянных бластоцист в криоцикле (общее число бластоцист — 476), которые были разделена на 2 группы: экспериментальную (209 пациенток, 230 бластоцист) с переносом витрифицированных/оттаянных бластоцист, подвергшихся полному удалению zp, и контрольную (222 пациентки, 246 бластоцист) с переносом витрифицированных/оттаянных zp-интактных бластоцист.
Все бластоцисты хорошего качества были криоконсервированы на 5-6-й день развития и разморожены непосредственно в день переноса эмбриона. Эмбрионы пациенток были случайным образом отнесены к экспериментальной или контрольной группе. После переноса эмбрионов оценивали следующие показатели: доля имплантации эмбрионов, частота наступления клинической, прогрессирующей клинической и многоплодной беременностей.
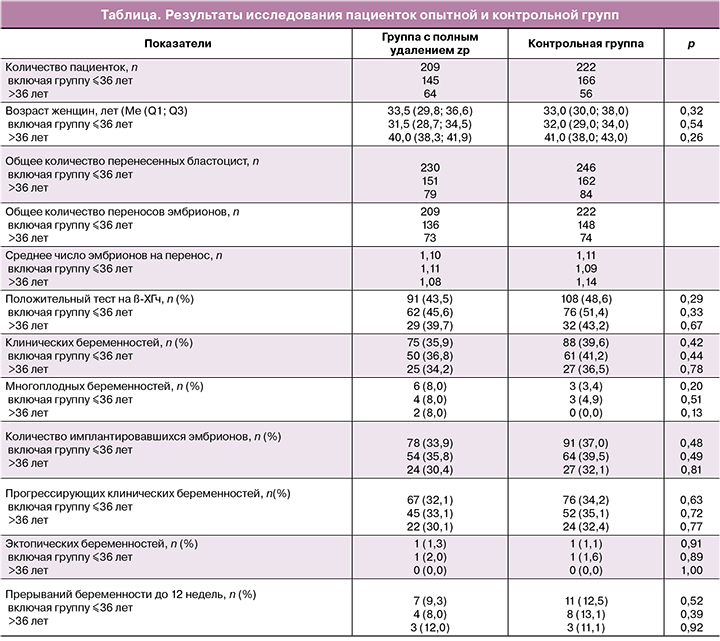
Возраст женщин составил от 23 до 49 лет (медиана (Ме) и квартили Q1, Q3 возраста женщин составили 33,5 (29,8; 36,6) и 33,0 (30,0; 38,0) года в опытной и контрольной группах (p=0,32) соответственно.
Овариальная стимуляция. Индукцию суперовуляции проводили по протоколу с применением антагонистов гонадотропин-рилизинг гормона со 2–3 дня менструального цикла с использованием рекомбинантных и/или мочевых гонадотропинов в суточной дозе 150—300 МЕ. Овуляцию инициировали введением хорионического гонадотропина человека в дозе 10 000 МЕ за 34—36 ч до пункции фолликулов.
Получение ооцитов. Аспирацию фолликулов выполняли под внутривенным наркозом. Ооциты, окруженные слоем клеток кумулюса, получали в результате трансвагинальной пункции фолликулов под ультразвуковым контролем спустя 34—36 ч после введения овуляторной дозы хоринического гонадотропина.
Оплодотворение. Для оплодотворения полученных ооцитов применяли процедуру ICSI или IMSI Hoffman modulation [6, 7], в зависимости от параметров спермы.
Культивирование эмбрионов. Культивирование осуществляли в СО2–инкубаторе при 36,7 °C в увлажненной атмосфере с 7,3% СО2 и 20% O2. Эмбрионы культивировали индивидуально в микрокаплях среды Global (LifeGlobal) с добавлением 5 мг/мл белка (LifeGlobal) под слоем минерального масла. На 3-и сутки после оплодотворения производили замену культуральной среды на аналогичную свежую. Ежедневно проводили оценку развития эмбрионов. На 5—6 день развития бластоцисты хорошего качества криоконсервировали с целью последующего переноса эмбриона в криоцикле.
Оценка качества эмбрионов. Зиготы и эмбрионы индивидуально оценивали под микроскопом через ~18, ~45, ~72 и ~96 ч после оплодотворения на предмет их развития и качества. На 5-6-е сутки развития производили оценку качества сформировавшихся бластоцист. Для переноса эмбриона и криоконсервации были использованы экспандированные бластоцисты качества AA, AB, BA и BB по Gardner D.K.
Криоконсервирование и оттаивание эмбрионов. Криоконсервирование и оттаивание бластоцист осуществляли с помощью наборов Vitrification Kit (101) (Cryotech, Japan) и Warming Kit (102) (Cryotech, Japan) соответственно, согласно рекомендациям производителя.
Вспомогательный хетчинг. Процедура вспомогательного хетчинга была выполнена через 5—15 мин после оттаивания эмбрионов (пока бластоцисты оставались частично коллапсированными) на инвертированном микроскопе Leitz Fluovert FU (Wild Leitz GmbH, Germany) с использованием системы Хоффмановского модуляционного контраста и оборудованном комплектом микроманипуляторов Narishige (Narishige, Tokyo, Japan).
Полное удаление zp осуществляли на нагревательном столике при 37 °C в чашке Петри в микрокапле среды HTF/HEPES (LifeGlobal) с добавлением 5 мг/мл белка (LifeGlobal) под слоем минерального масла.
Частичное механическое разрезание (70—90% окружности) zp было выполнено с помощью микропипетки для рассечения zp (Cook Medical). После выполнения разреза эмбрион снимался с присасывающей пипетки, а полное удаление zp, то есть полное вылупление эмбриона из блестящей оболочки осуществляли при помощи мягкого механического пипетирования через капилляр диаметром 175—200 мкм. Для каждого эмбриона вся процедура полного удаления zp занимала не более 3 мин.
Оценка выживаемости. После завершения процедуры полного удаления zp бластоцисты несколько раз отмывали от манипуляционной среды и до момента переноса культивировали в среде HTF (LifeGlobal) с добавлением 15 мг/мл белка (LifeGlobal).
Выживаемость эмбрионов оценивали под микроскопом в течение 1—3 ч после оттаивания и бластоцисты, прошедшие повторное экспандирование, были характеризованы как жизнеспособные.
Подготовка эндометрия, перенос эмбриона и оценка наступления беременности. Перенос размороженных эмбрионов осуществляли в естественных или гормонозаместительных циклах. В естественных циклах перенос эмбриона осуществляли на 5-й день после овуляции, независимо от дня (5-й или 6-й) криоконсервирования бластоцисты. Для подготовки эндометрия в циклах с использованием заместительной гормональной терапии все женщины получали трансдермально эстрадиол (Дивигель 3,0 мг; Orion Corporation, Финляндия). Введение прогестерона (Утрожестан капс. 200—600 мг/день; Besins Healthcare, Бельгия) начинали, когда толщина эндометрия превышала 8 мм. Перенос эмбрионов осуществляли на 5-й день после начала терапии прогестероном, независимо от дня (5-й или 6-й) криоконсервирования бластоцисты. Время от момента размораживания до переноса эмбриона составляло от 2 до 4 ч. Одна или две жизнеспособные бластоцисты переносились в полость матки пациентки. Среднее количество эмбрионов на перенос составило 1,1.
Клиническую беременность диагностировали по наличию плодного яйца в полости матки, копчико–теменному размеру плода 2—4 мм и регистрации сердцебиения при ультразвуковом исследовании на 4—5-й неделе после переноса эмбриона. Частота прогрессирующей клинической беременности определялась отношением общего числа клинических беременностей сроком 12 и более недель к общему числу переносов.
Статистический анализ. Статистический анализ был выполнен с использованием Пакета анализа программы MS Excel (MicroSoft, US). Для описания возраста пациенток использовались медиана (Ме) и квартили Q1 и Q3. Для сравнения возраста пациенток испол зовали t-критерий Стьюдента. Для сравнения доли имплантации эмбрионов, а также наступления клинической, прогрессирующей клинической и многоплодной беременности использовался критерий χ2. Значения p≤0,05 считали статистически значимым.
Результаты
В результате проведения процедуры полного удаления zp какой-либо дегенерации эмбрионов не наблюдалось. В экспериментальной и контрольной группах все полученные клинические исходы не имели статистически значимых различий. Также внутри опытной и контрольной групп пациентки были разнесены на возрастные подгруппы: до 36 лет включительно и старше 36 лет. Внутри данных возрастных подгрупп между экспериментом и контролем также не наблюдалось статистически значимых различий. Характеристики пациенток каждой из групп и результаты исследования представлены в таблице.
Обсуждение
Частота имплантации в расчете на один перенос эмбриона в программах ЭКО человека варьирует от 8 до более чем 40%. Относительно низкие показатели имплантации эмбрионов в программах ЭКО, по крайней мере частично, могут быть связаны с нарушением процесса хетчинга. До настоящего времени процесс вылупления бластоцисты изучен не полностью.
Процесс вылупления требует от эмбриона больших энергетических затрат (экспандирование) и мобильности клеток бластоцисты (выход за пределы zp). Повторное экспандирование и коллапсирование бластоцисты может истощить энергетический резерв эмбриона ниже порогового уровня, который необходим для успешного хетчинга и/или дальнейшего развития. Полное удаление zp, предположительно, может увеличить вероятность имплантации за счет сохранения данного энергетического резерва, в связи с отсутствием потерь при неудачных попытках хетчинга. Некоторые авторы в исследованиях на грызунах, наблюдая в условиях in vivo низкую долю экспандированных бластоцист при высокой доле успешного хетчинга, выдвинули предположение, что механизм вылупления in vivo и in vitro может различаться. Это явление можно объяснить более высокой устойчивостью zp у эмбрионов, полученных in vitro. В исследованиях с использованием цейтраферной фотосъемки in vitro было показано, что высокая доля мышиных бластоцист вылупилась без предварительных циклов экспандирования и коллапсирования, то есть без пульсаций. Пульсация бластоцист перед процессом вылупления может быть артефактом или признаком затруднений, связанных с процессом вылупления, по причине разрыва межклеточных контактов клеток трофэктодермы и утечки жидкости из бластоцели.
От 2,8 до 25% бластоцист человека вылупляются к 6 дню развития in vitro. Однако большая доля морфологически нормальных бластоцист испытывает затруднения с хетчингом, а более половины из них не вылупляются даже спустя 8 дней культивирования in vitro и остаются иммобилизованными в zp (траппинг-феномен).
Существует вероятность того, что бластоцисты с низкой жизнеспособностью не в состоянии вылупиться после истончения или перфорации zp, поэтому может быть рекомендовано полное удаление блестящей оболочки.
Vajta G. и соавт. [4] предположили, что полное удаление zp может приводить к увеличению имплантации эмбрионов по сравнению с другими видами вспомогательного хетчинга.
В первых исследованиях, посвященных влиянию полного удаления zp на клинические исходы, сравнивались результаты программ ЭКО после переноса бластоцист с удаленной и интактной zp. В 4 проспективных рандомизированных исследованиях был проанализирован эффект полного удаления zp бластоцисты, до процедуры переноса эмбриона, методом ферментативной обработки проназой или кислым раствором Тироде [8—11].
Все авторы сообщили о некоторых преимуществах в результативности программ ВРТ при использовании вспомогательного хетчинга методом полного удаления zp, в особенности у пациенток с низким качеством полученных бластоцист (25 кейсов; 4,3 эмбриона на перенос) [11], пациенток с высоким риском развития синдрома гиперстимуляции яичников (11 кейсов; 1,0 эмбриона на перенос) [9] или выполненного на эмбрионах с задержкой развития (48 кейсов; 2,2 эмбриона на перенос) [8]. В исследовании по влиянию химического удаления zp у эмбрионов третьего дня развития не выявлено статистических различий по показателям клинической беременности и спонтанных абортов у пациенток младше 40 лет, проходящих первую попытку ЭКО (27 кейсов; 3,2 эмбриона на перенос), хотя у пациенток с плохим прогнозом старше 40 лет и/или имеющих две и более неудачные попытки ЭКО (30 кейсов; 3,9 эмбриона на перенос) полное удаление zp повышало долю клинической беременности [12].
Также в 2 ретроспективных исследованиях была произведена оценка влияния полного удаления и истончения/перфорации zp на клинические исходы программ ЭКО. Lan K. [13] показал, что, у пациенток в свежих циклах стимуляции бластоцисты, после химического удаления zp на 5-й день (104 кейса; 2, 6 эмбриона на перенос), имплантируются с той же вероятностью, что и эмбрионы (104 кейса; 2,7 эмбриона на перенос) прошедшие процедуру лазерного хетчинга на стадии дробления и культивировавшиеся до 5-го дня развития. В работе Hiraoka K. сообщалось, что при переносе в криоциклах криоконсервированных/оттаянных бластоцист, прошедших полное удаление zp при помощи лазера и механического пипетирования (57 кейсов; 1,5 эмбриона на перенос), значительно увеличивается доля клинической беременности и имплантации, по сравнению с эмбрионами, подвергшимися перфорации zp при помощи кислого раствора Тироде (45 кейсов; 1,7 эмбриона на перенос) (67 против 42%, р = 0,014; 55 против 30%, р=0,001 соответственно), хотя различий в частоте наступления многоплодной беременности не наблюдалось [14]. Процедуры вспомогательного хетчинга в обеих группах осуществлялись непосредственно после оттаивания замороженных бластоцист.
При анализе данных литературы не удалось найти рандомизированных контролируемых исследований, в которых бы сравнивались клинические исходы программ ЭКО при переносе бластоцист с механически удаленной zp, с zp-интактным контролем.
В целом, вышеприведенные данные и доступные мета-анализы [15, 16], как правило, свидетельствуют о бóльших преимуществах процедуры полного удаления zp, по сравнению с другими вариантами вспомогательного хетчинга. Однако низкое число кейсов в каждом исследовании и большое количество эмбрионов в расчете на один перенос, не вносят ясности в понимание необходимости проведения процедуры полного удаления zp и размывают значимость этого фактора в результативности программ ЭКО.
Достаточно редкое использование полного удаления zp эмбрионов в практике клиник ЭКО может быть объяснено опасениями специалистов в том, что эмбрионы без zp могут оказаться более восприимчивыми во время проведения рутинных процедур. Потенциальные повреждения в результате механических травм, прикрепления к стеклянным и пластиковым поверхностям или потери защиты от инфекций могут рассматриваться как возможные недостатки. С другой стороны, по мнению некоторых авторов, эти аспекты не должны представлять собой актуальную проблему [4].
В работе Ueno S. [17], по исследованию вылупления, адгезии к фибронектину и скорости роста эмбрионов человека в условиях in vitro, было показано, что бластоцисты, подвергшиеся процедуре полного удаления zp , быстрее адгезируются к дну чашки и растут, по сравнению с zp-интактными или эмбрионами с частично разрушенной zp. Однако не стоит забывать, что условия in vitro и in vivo, в которых может находиться эмбрион, значительно отличаются друг от друга, что может оказывать существенное влияние на экспансию бластоцисты, ее хетчинг, адгезию и нидацию.
Данные настоящего исследования согласуются и дополняют вышеприведенные результаты, полученные зарубежными коллегами.
Выводы
В результате проведенного исследования установлено, что полное механическое удаление zp у витрифицированных/оттаянных бластоцист человека за 1-3 ч до переноса эмбриона не оказывает какого-либо существенного влияния на клинические исходы программ ЭКО. Все оцененные показатели (частота имплантации эмбрионов, частота наступления клинической и прогрессирующей клинической беременности, частота многоплодной и внематочной беременности) были сопоставимы в опытной и контрольной группах и не имели статистически значимых различий, включая подгруппы пациенток до и после 36 лет.



