Миастения – аутоиммунное заболевание, при котором в организме вырабатываются антитела к ацетилхолиновым рецепторам постсинаптической мембраны нервно-мышечного синапса, что приводит к уменьшению количества функционирующих рецепторов концевой пластинки и в конечном итоге к нарушению сокращения мышечного волокна (рис.).
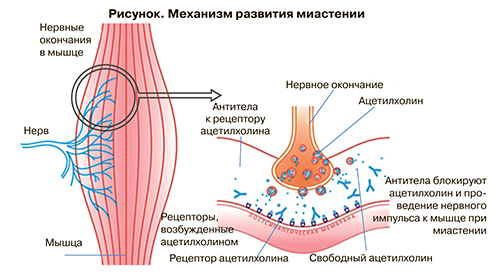
Клинически это вызывает утомляемость и нарастающую слабость скелетной мускулатуры от глазных и бульбарных форм до тяжелых, угрожающих жизни расстройств дыхания. Ежегодная заболеваемость Миастенией составляет от 5 до 30 случаев на 1 млн человек, а общую распространенность в популяции оценивают от 10 до 20 случаев на 100 000 населения.
Стоит обратить внимание на то, что всего лишь 30% сохранившихся функционирующих ацетилхолиновых рецепторов обеспечивают надежную нервно-мышечную проводимость без каких-либо клинических признаков. Из этого следует, что даже незначительный неврологический дефицит – признак глубокого поражения нервно-мышечных синапсов, требующий очень внимательного подхода к обеспечению безопасности анестезии и предупреждению послеоперационных неврологических осложнений и дыхательных расстройств.
Одна из главных проблем, возникающих у анестезиолога в случае сопутствующей миастении, – ограничение в применении большой группы препаратов, часто используемых в периоперационном периоде: антибактериальных препаратов, препаратов магния, бензодиазепинов, наркотических анальгетиков, антиаритмических препаратов, особенно применение мышечных релаксантов. Классические руководства по анестезиологии предупреждают врача о чрезвычайно высокой чувствительности больных миастенией к недеполяризующим миорелаксантам и, наоборот, резистентности к миорелаксантам деполяризующего действия. Определенное влияние оказывает длительное поддерживающее лечение антихолинэстеразными препаратами.
При возможности предпочтительна регионарная анестезия. Чаще всего она применима при операциях небольшого объема или на конечностях. Однако, если речь идет о полостных онкохирургических вмешательствах, ввиду распространенности патологического процесса, регионарная анестезия применима не часто. Точная диагностика и взаимодействие с хирургами в таком случае позволяет определить объем и уровень операции, однако остается высокая вероятность необходимости перехода на сочетанную анестезию.
Клинический случай
Пациентка П., 39 лет, поступила в ФГБУ НМИЦ АГП им. акад. В.И. Кулакова в марте 2022 г. с диагнозом «гранулезоклеточная опухоль яичников IIIC cт Т3сТхМ0»; состояние после комбинированного лечения (в 2013 г. надвлагалищная ампутация матки с придатками, резекция большого сальника, удаление метастазов опухоли с брыжейки тонкой кишки и в 2019 г. удаление рецидивной опухоли малого таза, биопсия брюшины). Проведено 17 курсов ХТ.
Прогрессирование заболевания в декабре 2021 г. По данным КТ и МРТ: картина единичных вторичных образований в брыжейке тонкой кишки, по ходу нижних брыжеечных сосудов, лимфаденопатия мезентериальных узлов. Признаки спаечного процесса. Образование (14 мм) в области рубца.
Сопутствующее заболевание: миастения, генерализованная форма с преобладанием бульбарных расстройств, IIIA стадия, паранеопластического генеза.
Миастения манифестировала с декабря 2020 г. Беспокоят жалобы на слабость, быструю утомляемость, слабость лицевой мускулатуры, дизартрия, эпизоды затруднения жевания твердой пищи без нарушения глотания. Специальной терапии не получала, КТ и МРТ головного мозга без патологии. В начале января 2022 г. симптомы усилились. Консультирована неврологом, начата терапия: калимин 240 мг/сут, метипред 12 мг/сут. Терапия с хорошим эффектом: слабость скелетных мышц не наблюдается, купировались бульбарные расстройства, оставалась умеренная слабость лицевой мускулатуры.
Пациентка обсуждена на междисциплинарном консилиуме. Был определен объем планируемой операции лапаротомия, адгезиолизис, метастазэктомия из брюшной полости, полная повторная циторедукция. Хороший эффект от проводимой терапии, а также точно выверенный объем и верхний уровень оперативного вмешательства на уровне 5 см выше пупка позволили выбрать спинально-эпидуральную анестезию.
Пациентка продолжила принимать Калимин и Метипред в прежней дозе, без отмены их перед операцией. На дооперационном этапе пациентке корригировали электролитные нарушения в ОРИТ.
В операционной произведена пункция и катетеризация эпидурального пространства на уровне Th10-Th11, катетер заведен краниально на глубину 5,0 см, а также пункция спинального пространства на уровне L2–L3. Эпидуральная анальгезия проводилась ропивакаином, спинальный блок – бупивакаином.
Выполнена лапаротомия, адгезиолизис, метастазэктомия из брюшной полости, аппендэктомия, полная повторная циторедукция. В периоперационном периоде старались избегать применения препаратов из списка ограничений, инфузионная терапия во время операции и в послеоперационном периоде проводилась безмагниевыми растворами, АБ-профилактику проводили цефазолином. Также проводили профилактику наведенной гипотермии.
Признаки спинального блока полностью нивелировались через 4 ч после операции. В послеоперационном периоде продолжена эпидуральная анальгезия. Согласно плану, пациентка продолжила прием Калимина и Метипреда в прежних дозах.
Течение послеоперационного периода гладкое. Усиления симптомов миастении не было. Через 7 дней проведен первый из шести запланированных курсов химиотерапии, в удовлетворительном состоянии пациентка выписана домой под амбулаторное наблюдение онколога и невролога.
Заключение
Таким образом, данный клинический пример показывает хороший результат применения спинально-эпидуральной анестезии при выполнении циторедуктивной операции у пациентки с миастенией. При этом не отмечалось значимых нарушений в показателях центральной гемодинамики, не было прогрессирования симптомов миастении. Спинально-эпидуральная анестезия является методом выбора при операциях у таких пациентов. Грамотная предоперационная подготовка, включающая коррекцию электролитных нарушений и плановую терапию миастении, профилактика наведенной гипотермии в операционной и запрет на использование препаратов из списка ограничений – факторы, позволяющие снизить риск развития миастенического криза.
Необходимо отметить, что в НМИЦ АГП им. акад. В.И. Кулакова накоплен большой опыт успешного применения регионарной анестезии у пациентов с миастенией различной степени при кесаревом сечении и других операциях в малом тазу и нижнем отделе брюшной полости.
Чухнов С.А.,
к.м.н., заведующий отделением анестезиологии-реанимации № 2, НМИЦ АГП им. акад. В.И. Кулакова, Москва



