По имеющимся данным, синдром поликистозных яичников (СПКЯ) является распространенным заболеванием, относится к одной из наиболее актуальных проблем современной гинекологии и характеризуется широким индивидуальным разнообразием клинических проявлений [1]. СПКЯ – гетерогенная группа нарушений с широкой клинической и биохимической вариабельностью, при которых хроническая ановуляция является следствием нарушения механизма обратной связи в гипоталамо-гипофизарной системе. Данный полиэндокринный синдром сопровождается нарушениями функции яичников и других желез внутренней секреции [2, 3]. Его можно обнаружить у каждой десятой женщины репродуктивного возраста в популяции, а по некоторым оценкам – у каждой пятой. Частота СПКЯ составляет от 6,0 до 20,0% [4]. Активно изучаются механизмы развития СПКЯ на уровне гипоталамо-гипофизарного комплекса, яичников, надпочечников, жировой ткани. Доказана связь СПКЯ с бесплодием. Однако механизмы, посредством которых СПКЯ влияет на репродуктивную функцию, остаются актуальными и спорными. Предполагается, что при СПКЯ нарушается секреция гонадотропных гормонов и стероидов, процессы фолликулогенеза и овуляции, что приводит к нарушению развития эндометрия, снижается секреция эстрадиола в гранулезе. Наряду с репродуктивными нарушениями, СПКЯ ассоциирован с инсулинорезистентностью, нарушением углеводного обмена, психического статуса, сердечно-сосудистыми заболеваниями. Несмотря на длительную историю изучения, некоторые аспекты этиологии, патогенеза и патофизиологии заболевания до конца не ясны, не завершен поиск единого фундаментального механизма, позволяющего объяснить истинную природу заболевания.
СПКЯ – полигенное эндокринное расстройство, обусловленное как наследственными факторами, так и факторами внешней среды. Вклад генетических факторов в этиологию СПКЯ составляет 79,0%, а окружающей среды, образа жизни и индивидуальной истории болезни – 21,0% [3]. Генетическая теория развития СПКЯ является актуальной, современной и активно изучается при развитии заболевания [5, 6].
 В тека-клетках яичников у женщин с СПКЯ происходит секреция всех стероидогенных предшественников биосинтеза андрогенов. Процесс ароматизации андрогенов до эстрогенов обеспечивается ферментом P450 arom – ароматазой. Ароматаза – ключевой фермент, ответственный за биосинтез эстрогена. Система цитохрома играет ключевую роль в функционировании яичников, фолликулогенезе, росте и развитии фолликула. Стартовым этапом стероидогенеза является превращение холестерина в прегненолон, который катализируется ферментом отщепления боковой цепи холестерина или Р450scc (рис. 1). Р450с17α катализирует синтез 17-гидроксипрегненолона и 17-ОН-прогестерона из прегненолона и прогестерона соответственно, а затем – конверсию этих стероидов в дегидроэпиандростерон и андростендион. Р450с17α является основным звеном в биосинтезе андрогенов в яичниках и надпочечниках [7].
В тека-клетках яичников у женщин с СПКЯ происходит секреция всех стероидогенных предшественников биосинтеза андрогенов. Процесс ароматизации андрогенов до эстрогенов обеспечивается ферментом P450 arom – ароматазой. Ароматаза – ключевой фермент, ответственный за биосинтез эстрогена. Система цитохрома играет ключевую роль в функционировании яичников, фолликулогенезе, росте и развитии фолликула. Стартовым этапом стероидогенеза является превращение холестерина в прегненолон, который катализируется ферментом отщепления боковой цепи холестерина или Р450scc (рис. 1). Р450с17α катализирует синтез 17-гидроксипрегненолона и 17-ОН-прогестерона из прегненолона и прогестерона соответственно, а затем – конверсию этих стероидов в дегидроэпиандростерон и андростендион. Р450с17α является основным звеном в биосинтезе андрогенов в яичниках и надпочечниках [7].
Считается, что ряд полиморфизмов генов, связанных с ферментным комплексом цитохрома Р450 (CYP), играют ведущую роль в патогенезе СПКЯ, предположительно – в снижении ароматазной активности [8]. Ген CYP11А1 (ген фермента отщепления боковой цепи P450scc) кодирует ферменты Р450scc и рассматривается как ген-кандидат СПКЯ. Усиление активности CYP11A лежит в основе повышенной продукции андрогенов [9]. Ген CYP17 кодирует фермент Р450с17 α, который обладает как 12α-гидроксилазной, так и 17-, 20-лиазной активностью. Ген CYP19 кодирует ароматазу (Р450 arom), с помощью которой происходит конверсия С19-стероидов (андрогенов) в С18-стероиды (эстрогены). Предполагается, что при изменении в структуре гена снижается ароматазная активность в клетках гранулезы и формируется относительный избыток андрогенов, блокирующий развитие фолликулов [10, 11].
Генетическая теория СПКЯ играет важную роль в патогенезе заболевания и выявлении генетических маркеров патологии. Исследования полиморфизмов генов потенциально способны пролить свет на генетические аспекты этиологии СПКЯ.
Материалы и методы
Исследование проводили с информированного согласия женщин на базе ГАУЗ КО «Кемеровская городская клиническая поликлиника № 5», г. Кемерово. Исследование одобрено комитетом по этике и доказательности медицинских исследований ФГБОУ ВО «КемГМУ» Минздрава России (Приказ Минздрава России от 19.06.2003 г. № 266).
Дизайн исследования: ретроспективное аналитическое исследование случай-контроль. В исследовании приняли участие 94 пациентки с СПКЯ – основная группа; группу сравнения составили 94 здоровых женщины без СПКЯ. Критерии включения в основную группу: женщины репродуктивного возраста с диагнозом СПКЯ, подписавшие информированное согласие на участие в исследовании. Критерии исключения из основной группы: возраст моложе 18 и старше 35 лет; отсутствие согласия на участие в исследовании, применение гормональной терапии, комбинированных оральных контрацептивов. Критерии включения в группу сравнения: здоровые женщины репродуктивного возраста без СПКЯ, не имеющие бесплодия, тяжелых соматических заболеваний, либо соматическая патология находится в стадии компенсации. Критерии исключения из группы сравнения: женщины моложе 18 и старше 35 лет; репродуктивного возраста, имеющие бесплодие, тяжелую соматическую патологию в стадии декомпенсации, отказ от участия в исследовании, принимающие гормональную терапию, комбинированные оральные контрацептивы.
 Диагноз СПКЯ устанавливался на основании критериев клинического протокола «СПКЯ в репродуктивном возрасте. Современные подходы к диагностике и лечению» (Москва, 2015 г.) [12].
Диагноз СПКЯ устанавливался на основании критериев клинического протокола «СПКЯ в репродуктивном возрасте. Современные подходы к диагностике и лечению» (Москва, 2015 г.) [12].
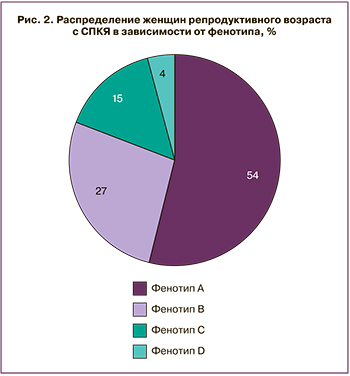
Распределение женщин репродуктивного возраста с СПКЯ в зависимости от фенотипа представлено на рис. 2.
Самый распространенный фенотип у женщин репродуктивного возраста с СПКЯ – основной (классический), встречался у 51 (54,2%) женщины. Другие фенотипы диагностировались гораздо реже.
Анализ состояния здоровья женщин репродуктивного возраста проведен на основании обращаемости и диспансеризации.
Выделение ДНК из лимфоцитов периферической крови проводили с помощью метода фенол-хлороформной экстракции с последующим осаждением этанолом. Образцы ДНК хранили при температуре –20° С.
Для молекулярно-генетического анализа SNP-полиморфизмов генов VNTR пентануклеотидного ((tttta)n) полиморфизма в позиции -528 промоторного региона генов CYP11A, CYP17A1 (-34T>C, MspA1, rs743572) и CYP19A1 (c.-39+15658 C>T, rs2470152) использовали тест-системы ООО «СибДНК» (г. Новосибирск).
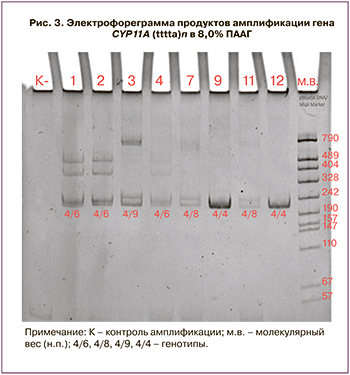 Пентануклеотидный ((tttta)n) полиморфизм гена CYP11A определяли с помощью электрофоретического разделения продуктов амплификации в 8% полиакриламидном геле (рис. 3). VNTR аллели в гене CYP11A1 обозначали следующим образом: аллель 4 – содержал четыре тандемных (tttta)n повтора; аллель 6 — шесть тандемных (tttta)n повторов; аллель 8 — восемь тандемных (tttta)n повторов; аллель 9 – девять тандемных (tttta)n повторов; аллель 10 – десять тандемных (tttta)n повторов (см. рис. 3).
Пентануклеотидный ((tttta)n) полиморфизм гена CYP11A определяли с помощью электрофоретического разделения продуктов амплификации в 8% полиакриламидном геле (рис. 3). VNTR аллели в гене CYP11A1 обозначали следующим образом: аллель 4 – содержал четыре тандемных (tttta)n повтора; аллель 6 — шесть тандемных (tttta)n повторов; аллель 8 — восемь тандемных (tttta)n повторов; аллель 9 – девять тандемных (tttta)n повторов; аллель 10 – десять тандемных (tttta)n повторов (см. рис. 3).
Реакцию амплификации проводили на термоциклере «Терцик» (НПФ «ДНК-Технология», Россия) при следующих условиях: денатурация (95° С – 3 мин), 32 цикла в режиме 92° С – 10 с, 68° С – 10 с, 72° С – 10 с, заключительный синтез (72° С – 3 мин). Общий объем реакционной смеси составил 15 мкл. Визуализацию продуктов амплификации осуществляли с помощью видеосистемы для документирования гелей GelDoc XR+ System (Bio-Rad, США).
Типирование полиморфизма гена CYP17A1 (rs743572) осуществляли с помощью метода асимметричной полимеразной цепной реакции в режиме реального времени (Real-time ПЦР) с использованием флуоресцентно-меченого олигонуклеотидного зонда, комплементарного исследуемому участку ДНК. Общий объем реакционной смеси составил 20 мкл. Реакцию амплификации проводили в следующих условиях: начальная денатурация 3 мин при 96° С; затем 40 циклов, включающих денатурацию при 96° С – 8 с, отжиг праймеров и последующую элонгацию при 60° С – 35 с (каждый шаг сопровождался регистрацией флуоресцентного сигнала в диапазонах, соответствующих интервалам флуоресценции флуорофоров).
Типирование полиморфизма гена CYP19A1 (rs2470152) проводили методом TaqMan Real-time ПЦР. Реакцию амплификации проводили в следующих условиях: начальная денатурация (96° С – 3 мин); затем 50 циклов, включающих денатурацию при 96° С – 8 с, отжиг праймеров при 58° С – 40 с и последующую элонгацию при 72° С – 8 с. Общий объем реакционной смеси составил 20 мкл.
Амплификацию проводили с помощью термоциклера CFX96 (Bio-Rad, США).
Статистическую обработку полученных результатов производили с использованием пакета прикладных программ StatSoft Statistica 6.1, IBM SPSS Statistics 20.0. Характер распределения данных оценивали с помощью критерия Шапиро–Уилка. Количественные данные представлены центральными тенденциями и рассеянием: среднее арифметическое (M) и стандартное отклонения (SD) в формате М (SD).
Сравнение двух независимых групп, имеющих нормальное распределение, проводили с помощью t-критерия Стьюдента. В этом случае и при использовании других критериев нулевую гипотезу отвергали при р≤0,05.
Соответствие частот генотипов полиморфных вариантов исследуемых генов равновесию Харди–Вайнберга проверяли по критерию χ2. Попарное сравнение частот аллелей и генотипов исследуемых генов проводили с помощью критерия χ2 и двустороннего точного теста Фишера (при n <5).
Результаты и обсуждение
Основными причинами обращения пациенток с СПКЯ были бесплодие (первичное − у 41 (43,6%) женщины, вторичное − у 11 (11,7%) женщин; нарушение менструального цикла – олиго/аменорея у 28 (29,7%) женщин; нарушение менструального цикла – олиго/аменорея и первичное бесплодие – у 14 (14,8%) женщин.
Средний возраст женщин в исследованных группах не имел статистически значимых отличий (28,2 (2,3) против 28,6 (1,7)) (р=0,92). На следующем этапе исследования изучали влияние генетического фактора на риск развития СПКЯ.
Анализ распределения частот генотипов генов CYP17A1 rs743572 и CYP19A1 rs2470152 в группах женщин с СПКЯ и у здоровых женщин на их соответствие равновесию Харди–Вайнберга показал, что наблюдаемые частоты генотипов изучаемых полиморфных вариантов генов в обеих группах соответствовали их ожидаемым частотам (PHWE>0,05, табл. 1).
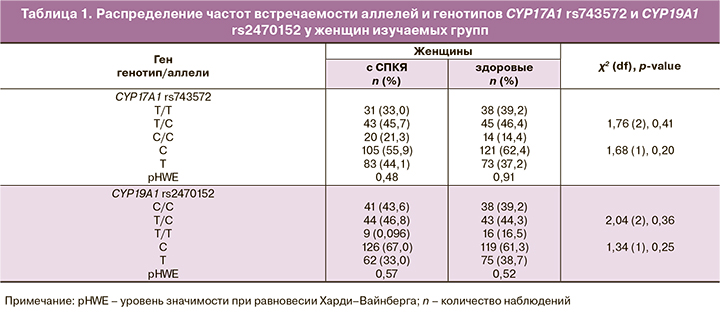
Сопоставление частот аллелей и генотипов генов CYP17A1 -34T>C (rs743572) и CYP19A1 c.-39+15658 C>T (rs2470152) у женщин изучаемых групп не выявило каких-либо статистических отличий между ними (p>0,05).
Согласно данным литературы, аллель А2 (-34С) в гене CYP17A1 обладает усиленной скоростью транскрипции, поэтому предполагается, что у его носителей может наблюдаться повышение активности фермента 17α-гидроксилазы и, соответственно, усиливаться синтез стероидов. Анализ литературы показал, что связь между полиморфизмом гена CYP17A1 -34T>C (rs743572) и СПКЯ далеко не однозначна. Так, одни исследователи указывают на связь полиморфизма – 34T>C гена CYP17A1 с СПКЯ, тогда как другие, напротив, считают, что аллель А2 (-34С) играет незначительную роль в развитии СПКЯ, но может оказывать влияние на гиперандрогенный фенотип [13–17].
Отдельные медико-генетические исследования указывают на наличие ассоциации между полиморфизмом гена CYP19A1 c.-39+15658 C>T (rs2470152) и риском СПКЯ [18]. Gharani N. была предложена гипотеза, согласно которой при изменении в структуре гена, кодирующего P450 arom, снижается ароматазная активность в клетках гранулезы [19]. Предполагается, что ген CYP19A1 является одним из ключевых факторов, ответственных за этиопатогенез СПКЯ, особенно в подростковом возрасте. Это может быть связано с активностью фермента ароматазы. Полиморфизм гена CYP19A1 c. -39+15658 C>T (rs2470152) оказывает влияние на активность фермента ароматазы, катализирующего превращение тестостерона и андростендиона в эстрадиол и эстрон. Предполагается, что избыток андрогенов у девочек может способствовать менархе в более раннем возрасте [20]. С другой стороны, имеются работы, не подтверждающие связь полиморфизма rs2470152 гена CYP19A1 с развитием СПКЯ у женщин отдельных этносов [21, 20]. Исходя из данных литературы и собственного исследования, можно предположить, что полиморфные локусы генов CYP17A1 rs743572 и CYP19A1 rs2470152 не являются основными факторами риска СПКЯ у обследуемых нами женщин, но они могут оказывать влияние на клиническую картину СПКЯ, поэтому требуется продолжение исследования.
Установлено, что полиморфизм промоторной области гена CYP11A1 включает разное количество пентануклеотидных повторов (tttta)n, начиная с позиции -528. Как выяснилось, повышенная продукция андрогенов коррелирует с большим количеством (tttta)n-повторов у женщин и ассоциирована с риском СПКЯ [9]. Поэтому далее мы изучали распределение частот генотипов полиморфизма гена CYP11A1 (tttta)n в двух группах – у женщин с СПКЯ и у здоровых женщин (табл. 2).
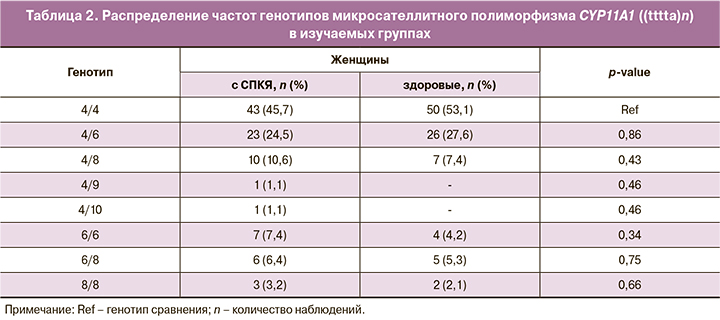
Сопоставление частот генотипов гена CYP11A1 (tttta)n у женщин изучаемых групп показало отсутствие статистически значимых отличий между ними (p>0,05). Следует отметить, что наиболее часто выявляемым генотипом у женщин в двух группах был генотип 4/4 (45,7% в группе СПКЯ и 51,5% у здоровых женщин соответственно). В то же время наблюдалась тенденция к накоплению у женщин с СПКЯ аллелей с большим количеством (tttta)n-повторов, чем у здоровых женщин. Типичны были VNTR-генотипы с 6/6, 6/8 и 8/8 пентануклеотидными повторами. Возможно, данное количество обследуемых женщин не позволило нам выявить какой-либо четкой закономерности связи полиморфизма гена CYP11A1 (tttta)n с СПКЯ, поэтому необходимо продолжить исследование.
Заключение
Проведенное нами исследование не выявило ассоциации между полиморфными локусами генов CYP11A1 (tttta)n, CYP17A1 rs743572 и CYP19A1 rs2470152 и развитием СПКЯ. По-видимому, у обследуемых нами женщин генетический фактор не играл ключевой роли в развитии СПКЯ. Наше исследование может быть полезным для проведения последующих метаанализов, которые могут позволить раскрыть представление о патогенезе заболевания.



