Известно, что ключевым симптомом синдрома поликистозных яичников (СПКЯ) является наличие поликистозных яичников, сочетающихся с определенными эндокринно-метаболическими нарушениями. Наличие совокупности тех или иных симптомов позволяет диагностировать один из представленных в классификации фенотипов СПКЯ [1]. Именно поликистозное строение яичников обуславливает трудности проведения их стимуляции в программах экстракорпорального оплодотворения (ЭКО). Также известно, что стимуляция яичников у этой категории больных сопровождается высоким риском развития синдрома гиперстимуляции яичников (СГЯ), низким процентом зрелых ооцитов по отношению к общему числу полученных, нарушением этапов эмбриогенеза [2–4]. В клинической практике при СПКЯ в большинстве случаев во избежание развития СГЯ используют замену триггера овуляции и сегментацию цикла с криоконсервацией всех полученных эмбрионов [5, 6]. Вопрос о необходимости проведения преимплантационного генетического тестирования на анеуплоидии (ПГТ-А) эмбрионов у этой категории больных является дискуссионным. Некоторые исследователи считают, что, исходя из патогенеза развития заболевания и его возможной генетической детерминации, ПГТ-А улучшит результаты лечения [7, 8]. Другие же не видят в этом необходимости, ориентируясь на молодой возраст пациенток и достаточное количество получаемых эмбрионов [7, 8].
Интересным является вопрос о влиянии возраста пациенток на качество получаемых эмбрионов и исходы программ ЭКО у пациенток с СПКЯ. Известно, что параметры овариального резерва при СПКЯ не совпадают с общепопуляционными возрастными значениями и значительно превосходят их в более позднем репродуктивном возрасте, что дает возможность получать больше ооцитов [9]. Это позволяет предположить, что при условии нормализации гормонального фона в старшем репродуктивном возрасте у таких пациенток можно было бы ожидать лучших исходов программ вспомогательных репродуктивных технологий (ВРТ) по сравнению с пациентками старшего репродуктивного возраста с другими факторами бесплодия. Вместе с тем вопрос качества получаемых яйцеклеток у пациенток позднего репродуктивного возраста с СПКЯ недостаточно освещен в литературе.
Есть литературные данные, свидетельствующие об эффективности проведения ПГТ-А у пациенток с СПКЯ молодого возраста (до 35 лет) [10], однако вопрос остается дискутабельным. Недавнее исследование Михайловой Н.Д. и соавт. [11] показало клиническую значимость проведения ПГТ-А у женщин, однако влияние возраста пациенток на исходы программ ВРТ в этом исследовании не изучалось.
В связи с этим цель данного исследования: провести сравнительную оценку эффективности программ переноса криоконсервированных/размороженных эмбрионов в полость матки после ПГТ-А у пациенток старшего репродуктивного возраста с СПКЯ и пациенток старшего репродуктивного возраста с трубно-перитонеальным фактором бесплодия.
Материалы и методы
Было проведено нерандомизированное экспериментальное клиническое исследование на базе 1-го гинекологического отделения НМИЦ АГиП им. В.И. Кулакова за период с сентября 2020 г. по апрель 2022 г. В исследование вошли 63 женщины 38–42 лет, проходившие лечение бесплодия в программах ЭКО/ИКСИ (интрацитоплазматическая инъекция сперматозоида в ооцит) по протоколу с антагонистами гонадотропин-рилизинг-гормона (ГнРГ) с ПГТ-А, а затем в программах переноса криоконсервированного/размороженного эмбриона в полость матки при наличии эмбриона, рекомендованного к переносу.
Пациентки находились под наблюдением до наступления одного из возможных исходов – отрицательного результата анализа крови на β-субъединицу хорионического гонадотропина человека, биохимической беременности, выкидыша, эктопической беременности, неразвивающейся беременности или живорождения.
Первую группу (n=30) составили женщины с трубно-перитонеальным фактором бесплодия. Во вторую группу (n=33) вошли женщины с СПКЯ (диагноз поставлен на основании Роттердамских критериев), проходившие лечение в программах ЭКО/ИКСИ в качестве 3-й линии терапии при неэффективности терапии 1-й и 2-й линии (кломифена цитрат/летрозол и стимуляция овуляции гонадотропинами/лапароскопический дриллинг яичников соответственно) при ановуляторном бесплодии, обусловленном СПКЯ [12, 13].
Участники данного исследования не были ослеплены в отношении распределения по условиям исследования.
Перед программами ЭКО/ИКСИ всем пациенткам проводилось стандартное клинико-лабораторное обследование согласно приказу Минздрава России № 803н.
Критериями исключения являлись наличие противопоказаний к проведению программ ВРТ, преждевременная недостаточность яичников, тяжелый мужской фактор, аномалии развития половых органов, иммунодефицитные состояния.
Стимуляцию функции яичников у всех пациенток начинали со 2–3-го дня менструального цикла. Применялись препараты рекомбинантного фолликулостимулирующего гормона (ФСГ) и человеческих менопаузальных гонадотропинов, содержащих равное количество ФСГ и лютеинизирующего гормона (ЛГ). Для подавления преждевременного пика ЛГ использовался препарат антагонистаГнРГ. В качестве триггера овуляции во всех циклах применялся препарат трипторелина ацетат в дозировке 0,2 мг.
Оплодотворение аспирированных ооцитов производилось методом ИКСИ, на 5–6-е сутки культивирования производили биопсию трофэктодермы бластоцист (при условии наличия морфологически подходящих эмбрионов для генетического тестирования, согласно классификации Гарднера). Все эмбрионы надлежащего качества были витрифицированы.
Последующее ПГТ-А по 46 хромосомам проводилось в лаборатории молекулярно-генетических методов методом высокопроизводительного секвенирования следующего поколения (NGS).
При условии, что по результатам ПГТ-А есть эмбрионы, рекомендованные к переносу, пациентки вступали в программу переноса криоконсервированных/размороженных эмбрионов в полость матки на фоне заместительной гормональной терапии с 4–5-го дня следующего менструального цикла. Подготовка эндометрия проводилась препаратом эстрадиола валерат в дозировке от 6 до 8 мг, с 15–16-го дня менструального цикла добавляли микронизированный прогестерон в дозировке 600 мг либо дидрогестерон в дозировке 30 мг; на 6-й день приема препаратов прогестерона производился перенос одного эмбриона лучшего качества в полость матки.
Эффективность программ ВРТ оценивали по частоте наступивших беременностей, биохимических беременностей, эктопических беременностей, самопроизвольных выкидышей и неразвивающихся беременностей, живорождения.
Статистический анализ
Для обработки полученных данных использовалась программа Statistica (версии 8.0, StatSoft Inc., США).
Количественные переменные были описаны с использованием таких числовых характеристик, как среднее значение (М), среднеквадратическое отклонение (SD) в формате М (SD) – для нормального распределения; медиана (Ме) и Q25% и Q75% – верхний и нижний квартили в формате квартильного размаха Me (Q1; Q3) – для параметров, имеющих распределение, отличающееся от нормального Для описания качественных переменных – частоты (%).
Соответствие количественных параметров нормальному распределению проверяли с помощью критерия Шапиро–Уилка. Нулевая гипотеза – исследуемое распределение является нормальным. При р<0,05 (критический уровень значимости) принимали, что исследуемое распределение не является нормальным.
При сравнении двух групп для числовых показателей использовался t-критерий Стъюдента для двух независимых выборок при условии нормального распределения данных, в других случаях применялся непараметрический U-критерий Манна–Уитни для несвязанных совокупностей при сравнении количественных данных.
По методу Woolf был рассчитан относительный риск (ОР) с 95% доверительным интервалом (ДИ). В случае бинарных исходов размер эффекта определялся как отношение рисков и абсолютное снижение риска также с 95% ДИ.
Проверяемая гипотеза – получение превосходства в эффективности наступления и вынашивания беременности, которая завершается живорождением. На основании частоты наступления клинической беременности и живорождения был основан расчет размера выборки.
Результаты
При сравнении групп по основным клиническим характеристикам (табл. 1) были зафиксированы статистически значимые различия в показателях массы и индекса массы тела, показателях овариального резерва и андрогенного профиля (общего тестостерона). Признаки гиперандрогении выявлены у 6/33 (18,2%) женщин в группе пациенток с СПКЯ. У части пациенток, кроме СПКЯ, отмечали и другие факторы бесплодия, однако во всех случаях ведущим был эндокринный фактор; трубный и маточный факторы были выявлены у 7/33 (21,2%) и 12/33 (36,4%) женщин соответственно. Мужской фактор бесплодия был отмечен у 27/33 (81,8%) пациенток.
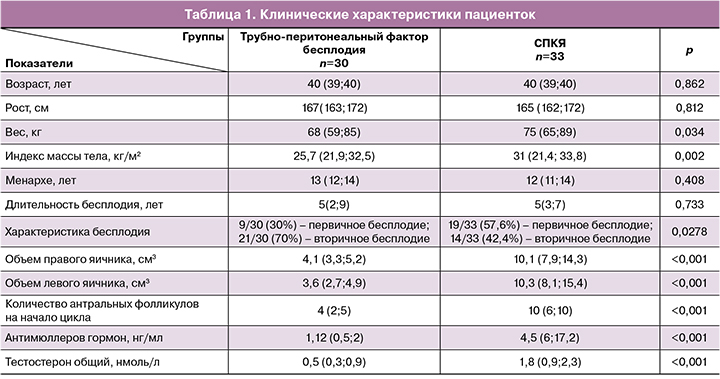
В группе с трубно-перитонеальным фактором у женщин с вторичным бесплодием было зафиксировано суммарно 29 беременностей; из них 6/29 (20,7%) родов, 6/29 (20,7%) внематочных беременностей, 2/29 (6,9%) абортов, 12/29 (41,4%) неразвивающихся беременностей, 4/29 (13,8%) выкидыша. 9/29 (31,03%) беременностей наступили в результате ЭКО, из них 3/9 (33,3%) закончились родами, 4/9 (44,4%) составили неразвивающиеся беременности и 2/9 (22,2%) – выкидыши.
В группе пациенток с СПКЯ всего было зафиксировано 14 беременностей; из них 2/14 (14,3%) родов, 0/14 внематочных беременностей, 1/14 (7,1%) абортов, 8/14 (57,1%) неразвивающихся беременностей, 3/14 (21,4%) выкидышей. 10/14 (71,4,5%) беременностей наступили в результате ЭКО, из них 2/10 (20%) закончились родами, 6/10 (60%) составили неразвивающиеся беременности и 2/10 (25%) – выкидыши.
В данной группе пациенток у 2/33 (6,1%) женщин в анамнезе был дриллинг яичников.
При сравнении параметров фолликуло-, оо- и эмбриогенеза (табл. 2) в обеих группах были зафиксированы статистически значимые различия: в группе СПКЯ наблюдали большее количество антральных фолликулов и получали большее количество зрелых ооцитов, бластоцист и бластоцист, пригодных к криоконсервации, по сравнению с группой пациенток с трубно-перитонеальным фактором бесплодия.
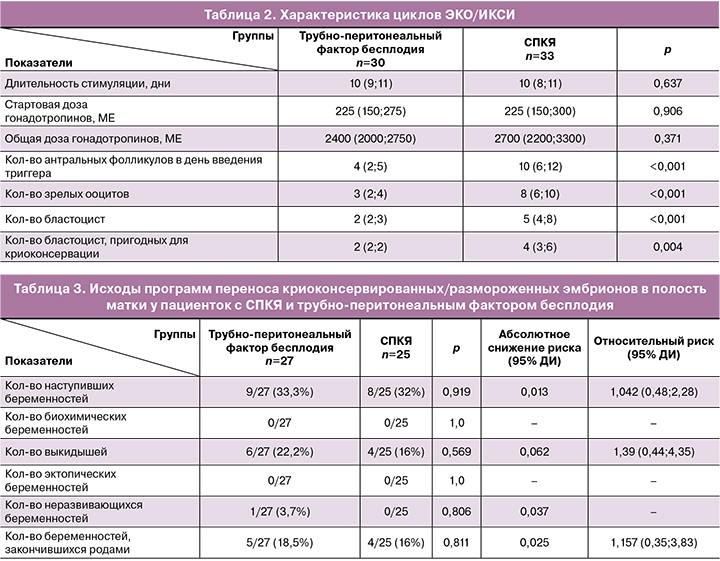
После программы ЭКО/ИКСИ в каждой группе было по 1 пациентке, у которой не было ни одной бластоцисты надлежащего качества, в связи с чем биопсия трофэктодермы и витрификация не производились. Указанные пациентки были исключены из исследования на данном этапе.
В группе пациенток с трубно-перитонеальным фактором суммарно биопсия трофэктодермы была произведена у 75 эмбрионов; из них 32 были рекомендованы к переносу, 5 оказались мозаичными. У 15/38 (39,5%) эмбрионов были обнаружены трисомии, у 12/38 (31,5%) – моносомии, еще у 7/38 (18,4%) эмбрионов – другие анеуплоидии/сочетанные изменения. 4 эмбриона были исключены из исследования в связи с отсутствием прохождения сигнала; 2 пациентки данной группы выбыли из исследования, поскольку по результатам ПГТ-А у них не было эмбрионов, рекомендованных к переносу. В результате в программу переноса криоконсервированных/размороженных эмбрионов вступили 27 женщин с трубно-перитонеальным фактором бесплодия.
В группе пациенток с СПКЯ суммарно биопсия трофэктодермы была произведена у 119 эмбрионов; из них 45 были рекомендованы к переносу, 6 оказались мозаичными. У 29/68 (42,6%) эмбрионов были обнаружены трисомии, у 27/68 (39,7%) – моносомии и у 6/68 (8,8%) – другие анеуплоидии/сочетанные изменения. 6 эмбрионов были исключены из исследования в связи с отсутствием прохождения сигнала. В данной группе 7 женщин выбыли из исследования на данном этапе, поскольку по результатам ПГТ-А у них не было эмбрионов, рекомендованных к переносу. Таким образом, в программу переноса криоконсервированных/размороженных эмбрионов вступили 25 женщин с СПКЯ.
Полученные результаты (табл. 3) не показали статистически значимых различий в эффективности программ ВРТ между двумя исследуемыми группами пациенток, несмотря на более высокие показатели в группе пациенток с СПКЯ на эмбриологическом этапе. В группе с трубно-перитонеальным фактором бесплодия всего было зафиксировано 9/27 (33,3%) беременностей против 8/25 (32%) в группе с СПКЯ (p=0,919), различие статистически не значимо (ОР 1,042 (ДИ 0,48; 2,28); р=0,919); из которых 5/27 (18,5%) и 4/25 (16%) закончились родами, различие статистически не значимо (ОР 1,157 (ДИ 0,35; 3,83); р=0,811); 6/27 (22,2%) и 4/25 (16%) составили выкидыши, различие статистически не значимо (ОР 1,39 (ДИ 0,44; 4,35); р=0,569). Была зафиксирована только 1/27 (3,7%) неразвивающаяся беременность в группе пациенток с трубно-перитонеальным фактором бесплодия.
Обсуждение
По результатам недавнего исследования Gordon C.E. et al., для женщин старше 40 лет при наличии менее 4 нормально оплодотворившихся зигот показан перенос 1-го или более недиагностированных эмбрионов на 3-и или 5-е сутки культивирования. И, несмотря на обсуждаемую целесообразность проведения ПГТ-А эмбрионов у пациенток старшего репродуктивного возраста, об этом можно говорить только при наличии эмбрионов для диагностики [14]. В нашем исследовании мы наблюдали 2 случая выбывания пациенток из исследования в связи с отсутствием эмбрионов надлежащего качества – по одному в каждой из групп.
Несмотря на удовлетворительные параметры овариального резерва у женщин старшего репродуктивного возраста с СПКЯ, по сравнению с женщинами с нормальным менструальным циклом, с возрастом снижаются вероятность получения эуплоидного эмбриона и частота наступления беременности. Это опять же можно частично объяснить тем, что при СПКЯ качество ооцитов может страдать, несмотря на высокие показатели антимюллерова гормона [3, 4]. Однако существуют литературные данные, свидетельствующие о том, что эффективность программ ВРТ у пациенток с СПКЯ остается высокой до 38 лет включительно [15]. Также есть данные, что эффективность программ ВРТ у данной категории пациенток в целом медленнее снижается с возрастом [16]. Тем не менее в нашем исследовании 6/33 (18,2%) пациенток в группе СПКЯ выбыли из дальнейшего исследования из-за того, что все эмбрионы, отданные на ПГТ-А, оказались анеуплоидными.
У пациенток старшего репродуктивного возраста использовались более высокие дозы гонадотропинов (по сравнению с пациентками молодого возраста), что объясняется снижением овариального резерва и рисков развития СГЯ и не противоречит данным литературы [15].
Неудачи в программах ВРТ у пациенток с СПКЯ можно объяснить в целом повышенными рисками невынашивания беременности у данной категории пациенток [17], более высокими рисками хромосомных аномалий [18], а также тем, что результат ПГТ-А не может быть абсолютной гарантией переноса эуплоидной бластоцисты. Также необходимо учитывать маточный фактор, поскольку существуют данные о возможной резистентности эндометрия к прогестерону при СПКЯ [19].
У значительной части женщин с СПКЯ после 35 лет наблюдаются нормализация цикла, уменьшение количества фолликулов и снижение уровня антимюллерова гормона до нормальных показателей. С другой стороны, отмечается снижение уровня андрогенов, которые являются одним из регуляторов фолликулогенеза, что может оказывать негативное влияние на эмбриологический этап.
В то же время, согласно данным литературы, гиперандрогения у пациенток с СПКЯ может оказывать негативное влияние на исходы программ ВРТ, что подтверждается исследованиями. Так, существуют данные о негативном влиянии гиперандрогении на фолликулярный рост, формирование бластоцист и имплантацию [6, 15]. Также есть данные о повышении рисков невынашивания беременности у пациенток с СПКЯ и гиперандрогенией при переносе эмбриона в индуцированном цикле, в связи с чем также предпочтительна сегментация цикла [20].
Поэтому с точки зрения наличия гиперандрогении можно было бы ожидать, наоборот, улучшения исходов программ ВРТ у пациенток с СПКЯ с увеличением возраста. Но также необходимо учитывать и другие факторы, которые могут влиять на результаты и менять клиническую картину.
Необходимо также помнить, что результаты нашего исследования могут отличаться от классически ожидаемой клинической картины у пациенток с СПКЯ, поскольку основная часть женщин с СПКЯ достигают беременности в циклах естественной фертильности, а программы ВРТ – 3-я линия терапии бесплодия при СПКЯ [2]. Поэтому все женщины, которые принимали участие в данном исследовании, имели показания для проведения программ ВРТ, а значит – более отягощенный анамнез по сравнению с другими женщинами с СПКЯ и, возможно, сочетанное влияние других факторов бесплодия.
Для пациенток с СПКЯ также характерно увеличение индекса массы тела, что может негативно влиять на исходы программ ВРТ. Это подтверждается результатами исследований – есть данные об увеличении риска невынашивания беременности после переноса криоконсервированного/размороженного эмбриона у женщин с СПКЯ и ожирением [15, 21]. Поэтому, даже несмотря на негативное отношение самих пациенток, необходима нормализация веса перед вступлением в программы ВРТ.
Заключение
Программы ЭКО/ИКСИ и ПГТ-А с последующим проведением программы переноса витрифицированного/размороженного эмбриона в полость матки демонстрируют одинаковую эффективность у пациенток позднего репродуктивного возраста как с СПКЯ, так и с трубно-перитонеальным фактором бесплодия.
Несмотря на более высокие параметры овариального резерва, эффективность программ ВРТ у пациенток с СПКЯ также снижается с возрастом, что требует проведения ПГТ-А у пациенток старшего возраста, независимо от фактора бесплодия.
Необходимы дальнейшие исследования данной проблемы на большей выборке пациенток.



