Понятие микробиома подразумевает совокупность бактерий, грибов и вирусов, которые в норме обитают в организме человека и являются компонентами его врожденной иммунной системы [1, 2]. Микробный состав напрямую влияет на эффективность иммунного ответа, защищает от чрезмерного роста патогенных микроорганизмов и модулирует баланс между воспалением и иммунным гомеостазом [1, 2].
Несмотря на то что каждый день люди контактируют с огромным количеством различных микроорганизмов, большая часть таких встреч проходит незаметно. Даже при инвазии патогенного микроорганизма системные признаки инфекционного воспаления у людей со здоровым иммунитетом угасают после окончания «противостояния» так же быстро, как и появляются. Подобные результативность и скоротечность иммунной реакции являются отражением эффективности работы агентов врожденного иммунитета и системы иммунного гомеостаза, регулирующих и ограничивающих распространение воспаления [3, 4].
Микробиоценоз влагалища и цервикального канала крайне разнообразен и представлен индигенной и транзиторной микрофлорой. Местная противоинфекционная защита обеспечивается сложным комплексом приспособлений, включающих в себя анатомо-физиологические особенности, секреторный иммунитет, фагоцитирующие клетки, гуморальные микробицидные факторы и нормальную микрофлору [5]. Колонизационная резистентность подразумевает совокупность механизмов, обеспечивающих постоянство количественного и видового состава нормальной микрофлоры, что предотвращает заселение влагалища патогенными бактериями или чрезмерное размножение условно-патогенных микроорганизмов [5]. В отличие от влагалища, в полости матки биоценоз менее разнообразен. Утверждение, что полость матки стерильна, было опровергнуто в ХХ в. В настоящее время микробиоценоз эндометрия изучен не до конца, но имеется достаточно публикаций, указывающих на присутствие в эпителии матки бактериальных и вирусных агентов [6]. По мнению Moreno I. [7] и Kyono K. [8], наличие в эндометрии бактерий, не относящихся к семейству лактобацилл, ассоциируется с нарушениями репродуктивной функции. На основании этого было предложено использовать терминологию «доминирующая лактобациллярная микрофлора эндометрия», когда содержание Lactobacillus sp. превышает 90% всех других микроорганизмов, и «не доминирующая лактобациллярная микрофлора», когда содержание их менее 90%.
По данным Cicinelli E., вагинальный и эндоцервикальный биоценоз имеют низкую конкордантность с микрофлорой эндометрия. В частности, наличие стафилококков в эндометрии не имеет связи с их присутствием во влагалищном микробиоценозе, в то время как Chlamydia trachomatis в 100% случаев определяется и в эндоцервиксе, и в эндометрии [9, 10]. Положительные связи обнаружены для Mycoplasma genitalium, Mycoplasma hominis и грибов рода Candida. По данным Кобаидзе Е.Г., нарушение микробиоты влагалища установлено у 66,9% пациенток с хроническим эндометритом с доминированием роста Escherichia coli в 49% случаев, Enterococcus faecalis – в 29,9%, Streptococcus sp. – в 28,8%, Staphylococcus sp. – в 23,5%, с преобладанием нелактобактериальной микрофлоры во влагалищном биотопе [11].
Методом секвенирования 16S рибосомальной РНК (типичная основа рибосомы прокариотической клетки) Liu Y. провел количественную и качественную оценку состава микроорганизмов в ткани эндометрия у пациенток с хроническим эндометритом и без него. Было обнаружено, что в норме преобладают лактобактерии, а при хроническом воспалении чаще выявляются Prevotella sp., G. vaginalis, Anaerococcus sp., Dialister sp. и Bifidobacterium sp. [12].
Для предотвращения колонизации бактериями полости матки существуют защитные механизмы, ограничивающие бактериальную пролиферацию и инвазию. К ним относятся цервикальная слизистая пробка, непрерывность и обновляемость эндометрия, а также элементы врожденного иммунитета (нейтрофилы, макрофаги, естественные киллеры, антимикробные пептиды) [13, 14]. Однако при избыточности бактериальной микрофлоры в нижних отделах полового тракта или недостаточности иммунной системы возможна реализация восходящего пути инфицирования полости матки, особенно при выполнении внутриматочных манипуляций, являющихся провоцирующим фактором контаминации эндометрия условно-патогенной микробиотой.
Учитывая тот факт, что частота инфекционных осложнений после хирургических операций составляет от 7 до 25%, а у женщин с высоким риском – практически в каждом втором случае, существует необходимость профилактики осложнений [15].
Самым безопасным и удобным способом профилактики воспалительных заболеваний, ассоциированных с урогенитальными инфекциями, перед проведением гинекологических операций для врача амбулаторной практики, направляющего пациентку в стационар или самостоятельно выполняющего внутриматочные вмешательства, является санация половых путей локально применяемым препаратом широкого спектра действия, закрывающим максимально потребность в элиминации патогенов, при этом незначительным образом влияющим на аутентичные лактобациллы [16].
Цель исследования: продемонстрировать целесообразность профилактического предоперационного применения препарата «Эльжина», таблетки вагинальные с аппликатором (АО «ВЕРТЕКС», Россия), для профилактики контаминации полости матки влагалищной микрофлорой при выполнении гистероскопии и раздельного диагностического выскабливания.
Материалы и методы
Набор пациенток проводился на базе консультативно-диагностического отделения родильного дома при ГКБ №40 Департамента здравоохранения г. Москвы в течение 2021 г. Работа проводилась с использованием когортного проспективного метода. Проверка первичной документации выполнена на кафедре акушерства и гинекологии лечебного факультета ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России.
Сформированы основная (n=30) и контрольная (n=20) группы. Критерии включения были едины для обеих групп, после набора пациентки случайным образом распределены на 2 группы.
Критерии включения
1. Добровольно подписанное пациенткой информированное согласие на участие в исследовании.
2. Возраст от 20 до 45 лет включительно.
3. Наличие показаний для проведения гистероскопии и раздельного диагностического выскабливания (полип эндометрия, бесплодие, гиперпластический процесс эндометрия).
4. Установленный ранее нормоценоз влагалища по данным полимеразной цепной реакции с детекцией результатов в режиме реального времени (ПЦР-РВ).
5. Пациентки, способные понять предоставленную информацию о клиническом исследовании, готовность к соблюдению требований протокола исследования.
6. Согласие на использование адекватных мер контрацепции в ходе всего исследования (кроме женщин после хирургической стерилизации или с длительностью периода менопаузы более года).
7. Согласие воздерживаться от половых контактов на период участия в исследовании.
8. Согласие не использовать какие-либо вводимые во влагалище средства (спермициды, тампоны, спринцевания, диафрагмы, презервативы) в течение 48 ч до первого визита и на протяжении всего исследования.
Критерии невключения в исследование
1. Бактериальный вагиноз, согласно критериям Амселя и данным ПЦР-РВ.
2. Вагинит любой этиологии.
3. Беременность или лактация либо планируемая в период исследования беременность.
4. Другие заболевания вульвы или влагалища, которые могут затруднить интерпретацию результатов исследования.
5. Гиперчувствительность к любому компоненту исследуемого препарата.
6. Прием системных или местных противогрибковых, антибактериальных или антипротозойных препаратов в течение 3 недель до визита скрининга.
7. Применение внутриматочных устройств (содержащих и не содержащих гормональный компонент).
8. Применение местных вагинальных противогрибковых и/или антибактериальных препаратов в течение 7 дней до 1-го визита.
9. Применение антисептиков вагинально в течение 7 дней до 1-го визита.
10. Сахарный диабет без достижения целевых значений гликемии в течение 3 месяцев до 1-го визита.
11. Необходимость в приеме антибиотиков во время участия в исследовании.
12. Прием системных глюкокортикостероидов или применение местных глюкокортикостероидов в течение 1 месяца до 1-го визита.
13. Применение иммунодепрессантов в течение 1 месяца до 1-го визита.
14. Потребность в применении иммунодепрессантов, включая системные или местные (вагинальные) глюкокортикостероиды, на протяжении исследования.
15. Применение каких-либо вводимых во влагалище средств (например, спермицидов, тампонов, спринцевания, диафрагмы, презерватива) в течение 48 ч до планируемого первого применения исследуемого препарата.
16. Органические заболевания центральной нервной системы, заболевания системы кроветворения (лейкоз, нарушения гемопоэза).
17. Первичные и вторичные иммунодефициты, в т.ч. ВИЧ-инфекция.
18. Тяжелые заболевания печени (цирроз, хронический гепатит, повышение уровня билирубина общего более 2 верхних границ норм, уровень АЛТ или АСТ более 3 верхних границ нормы).
19. Анамнестические указания на болезнь Крона, язвенный колит или ассоциированный с применением антибиотиков колит.
20. Тяжелые декомпенсированные хронические или острые заболевания и другие состояния, которые, по мнению врача-исследователя, могут препятствовать участию пациентки в исследовании или влиять на результаты исследования.
21. Участие в других клинических исследованиях лекарственных средств на момент 1-го визита либо участие в них в течение 90 дней до 1-го визита.
22. Хирургическая операция в течение 30 дней до 1-го визита и пациентки, планирование в ходе исследования хирургических операций, включая диагностические процедуры, или пребывание в стационаре.
23. Известная или подозреваемая наркотическая/алкогольная зависимость.
24. Предполагаемая низкая приверженность пациентки лечению или неспособность выполнять процедуры и соблюдать ограничения согласно протоколу исследования (например, вследствие психических заболеваний).
Пациентки подписали информированное согласие на участие в исследовании, использование биологического материала и обработку персональных данных. Всего было осуществлено 2 визита: 1-й визит – включение, на котором проводились отбор пациенток, подписание информированного согласия, cбор материала из заднего свода влагалища для ПЦР-РВ-исследования и распределение на группы. Пациенткам основной группы назначался препарат «Эльжина» в течение 6 дней, пациентки контрольной группы не получали никакой терапии. 2-й визит совпадал с днем оперативного лечения, когда проводился повторный cбор биологического материала из заднего свода влагалища для ПЦР-РВ-исследования и интраоперационно – из полости матки (у пациенток обеих групп). Пациентки контрольной группы приглашались на 2-й визит на 12–13-й день от визита включения.
Пациентки основной группы проводили санацию влагалища препаратом «Эльжина», таблетки вагинальные с аппликатором (АО «ВЕРТЕКС», Россия), в течение 6 дней. Препарат представляет собой комбинированное лекарственное средство с антибактериальным, противогрибковым и противовоспалительным действиями, эффективность которого обусловлена суммарным действием входящих компонентов. Орнидазол – противопротозойное средство с противомикробным действием, активен в отношении Trichomonas vaginalis, Entamoeba histolytica, Giardia lamblia, а также некоторых анаэробных бактерий (Bacteroides sp., Clostridium sp., Fusobacterium sp.) и анаэробных кокков (Peptostreptococcus sp.). Неомицин – антибиотик широкого спектра действия группы аминогликозидов, активен в отношении грамположительных и грамотрицательных аэробных микроорганизмов. Эконазол сочетает в себе противогрибковое действие в отношении дрожжевых и дрожжеподобных грибов рода Candida с антибактериальным действием по отношению к грамположительным бактериям Staphylococcus sp., Streptococcus sp. Преднизолон – дегидрированный аналог гидрокортизона, оказывает противовоспалительное, противоаллергическое и противозудное действия.
Влагалищную таблетку пациентки вводили с помощью специального аппликатора, который играет особую роль для доставки действующих веществ непосредственно в область заднего свода влагалища, где представители микробиоты наиболее вариабельны [17].
Изучение влагалищной микробиоты и микробиоценоза полости матки проводили с использованием молекулярно-биологического метода ПЦР-РВ при помощи тест-системы «Фемофлор-16» (ООО «НПО ДНК-Технология»).
Сбор материала из влагалища производился до мануального исследования, после введения зеркал Куско. За 48 ч до этого пациентки исключали любые влагалищные манипуляции (влагалищный душ, использование тампона, спермицида, половой жизни, гинекологического осмотра). Исследование проводилось двукратно: в момент включения в исследование и через 7–9 дней после окончания местной терапии в день операции. Сбор материала из полости матки проводился интраоперационно, до расширения цервикального канала, при помощи пайпель-аспирационной биопсии (стерильный зонд Pipelle de Cornier).
Полученный клинический образец помещался в пробирку типа «Эппендорф», содержащую транспортную среду, и в течение 2–4 ч доставлялся в коммерческую лабораторию «Гемотест» с соблюдением температурного режима (+4°С). Количественная оценка микробиоценоза проводилась в абсолютных и в относительных показателях, которые рассчитывались с помощью программного обеспечения приборов для ПЦР-РВ (ДТ96, ДТ322) на основании номера «порогового» цикла. Количество ДНК искомого микроорганизма в образце выражалось в геном-эквивалентах (ГЭ), которое пропорционально количеству микроорганизма.
Статистический анализ
Статистическую обработку данных проводили с помощью программного пакета SPSS Statistics версии 20.0. В качестве меры центральной тенденции количественных признаков была выбрана медиана. Достоверность различий проверяли с помощью двустороннего критерия Фишера (при сравнении данных по частоте выявления) и критерия Манна–Уитни (для сравнения средних значений), уровень значимости p принимался равным 0,05.
Результаты
Возраст пациенток основной группы был от 25 до 40 лет (31,6±1,7), в контрольной группе – от 21 до 38 лет (28,4±2,2). Среди пациенток сформированных групп не выявлено женщин с ожирением, значимых различий в показателях индекса массы тела выявлено не было.
Показанием для проведения гистероскопии и раздельного диагностического выскабливания у пациенток основной группы было: у 5/30 (16,7%) – бесплодие неясного генеза, у 14/30 (46,7%) – полип эндометрия и у 11/30 (36,7%) – подозрение на патологический процесс эндометрия. Среди женщин контрольной группы показанием для хирургического вмешательства было: у 4/20 (20%) – бесплодие неясного генеза, у 10/20 (50%) – полип эндометрия и у 6/20 (30%) – патологический процесс эндометрия.
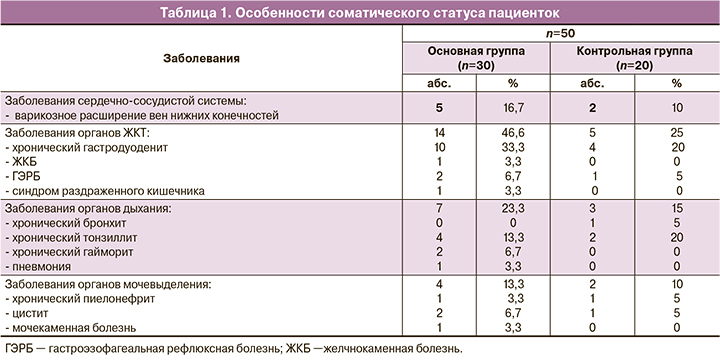
Особенности соматического статуса пациенток сформированных групп приведены в таблице 1. Среди экстрагенитальных заболеваний у всех женщин преобладала патология органов желудочно-кишечного тракта (46,6 и 25% соответственно), наиболее часто выявлялся хронический гастродуоденит (33,3 и 20% соответственно). Варикозное расширение вен нижних конечностей чаще диагностировалось у пациенток основной группы (р=0,04). Суммарно заболевания органов мочевыделительной (13,3 и 10%) и дыхательной систем (23,3 и 15%) встречались значимо чаще у пациенток основной группы (р≤0,05).
Средний возраст менархе у женщин основной группы был 11,9±2,1 года, у 2 (2/30, 6,7%) пациенток отмечен нерегулярный характер менструаций с олигоменореей до 39–45 дней. В остальных случаях средняя продолжительность цикла была 27,4±3,5 дней. У пациенток контрольной группы возраст менархе составил 12,4±1,2 года, менструальный цикл имел продолжительность 29,1±1,2 дня и был регулярным. Данные о частоте и характере гинекологических заболеваний приведены в таблице 2.
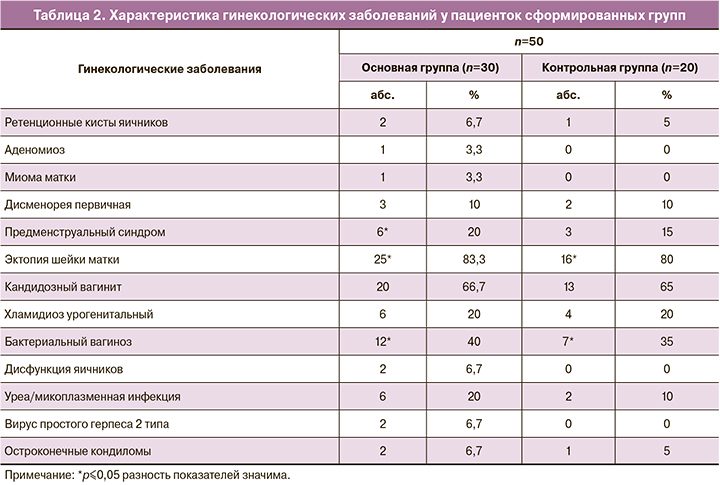
Среди пациенток сформированных групп наиболее распространенными гинекологическими заболеваниями были эктопия шейки матки (83,3 и 80%), кандидозный вагинит (66,7 и 65%), бактериальный вагиноз (40 и 35%) и дисменорея (10 и 10%).
Репродуктивная функция была реализована у большинства обследованных. В анамнезе влагалищные своевременные роды были у 70% (21/30) и 60% (12/20) пациенток соответственно группам, артифициальный аборт отмечен у 16,7% (5/30) и 10% (2/20) пациенток, а прерывание беременности (самопроизвольное или в связи с неразвивающейся беременностью) значимо чаще отмечено у пациенток контрольной группы (10%, 2/20), чем в основной (3,3%, 1/30), р≤0,05.
В таблице 3 и на рисунке 1 представлены результаты исследования микробиоценоза влагалища и полости матки у пациенток основной группы до и после проведения терапии.
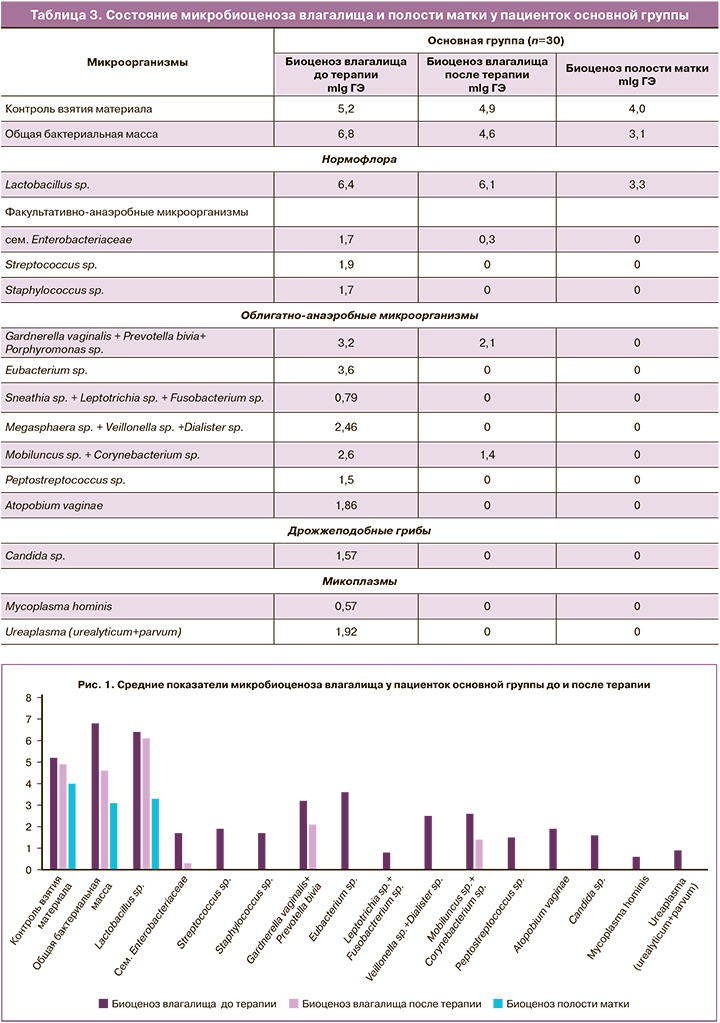
У пациенток основной группы исходно был выявлен нормоценоз влагалища, в составе которого преобладали лактобациллы. Общая бактериальная обсемененность была достаточно высокой (6,8 mlgГЭ). Среди условно-патогенных микроорганизмов в незначительных количествах присутствовали разнообразные факультативно- и облигатно-анаэробные бактерии в количестве, не превышающем 3,2 mlgГЭ.
После местного применения препарата «Эльжина» в течение 6 дней было выявлено значимое снижение общей бактериальной обсемененности в 1,47 раза.
После проведения курса профилактической терапии препаратом «Эльжина» во влагалище не изменялась концентрация лактобацилл, но значимо снизилась концентрация условно-патогенной микрофлоры (представителей семейства Enterobacteriaceae в 5,7 раза, G. vaginalis в 1,5 раза и Mobiluncus в 1,86 раза) (р≤0,001). А такие микроорганизмы, как стафилококки, стрептококки, микоплазмы, грибы рода Candida, вейлонеллы и фузобактерии, не выявлялись.
Исследование внутриматочной микробиоты у пациенток основной группы показало, что она представлена только лактобациллами. В полости матки показатель общей бактериальной массы был в 1,48 раза ниже, чем таковой во влагалище (р≤0,001), а концентрация лактобацилл была меньше, чем во влагалище, почти в 1,5 раза (р≤0,001).
В таблице 4 представлены результаты молекулярно-биологического исследования микробиоценоза влагалища и полости матки у пациенток контрольной группы.
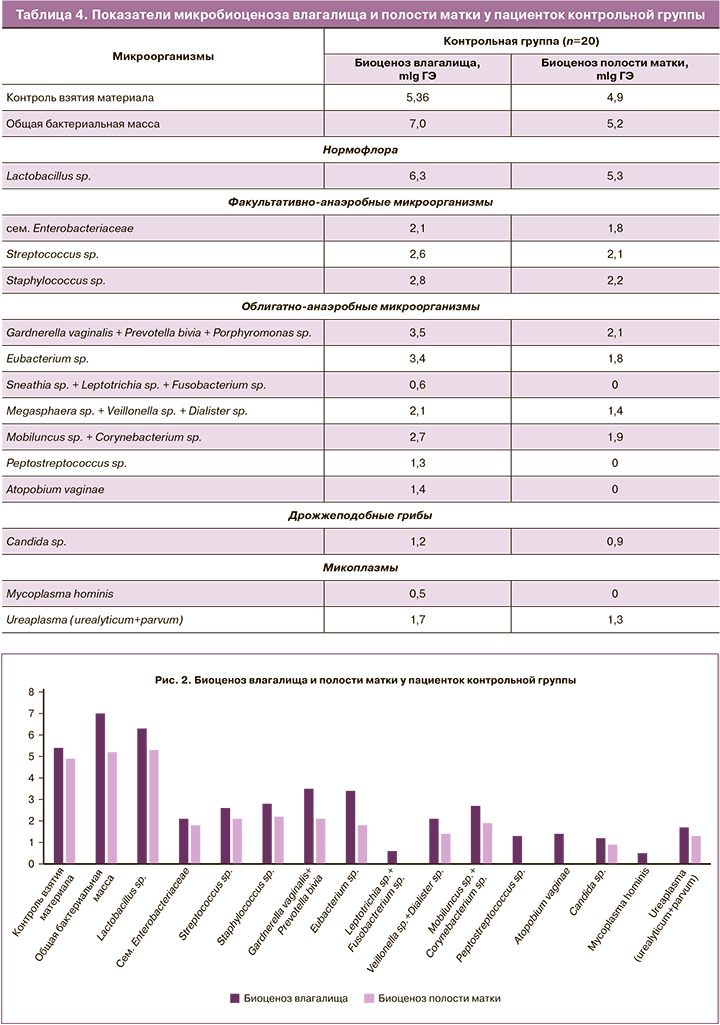
Общая бактериальная масса в полости матки у пациенток контрольной группы была в 1,34 раза ниже, чем во влагалище, и преимущественно состояла из лактобактерий. При этом сохранялась контаминация полости матки разнообразными условно-патогенными облигатно- и факультативно-анаэробными микроорганизмами.
Для всех бактерий было выявлено количественное снижение при сравнении с показателями влагалищного биоценоза. Титр стрептококков и стафилококков в полости матки был ниже влагалищного в 1,2, гарднерелл – в 1,7, эубактерий – в 1,9, вейлонелл – в 1,5, мобилункус – в 1,4 раза, грибов рода Candida и уреаплазм – в 1,3 раза (р≤0,001).
При сравнении уровня контаминации микроорганизмами полости матки у пациенток основной и контрольной групп были выявлены значимые различия (табл. 5, рис. 3).
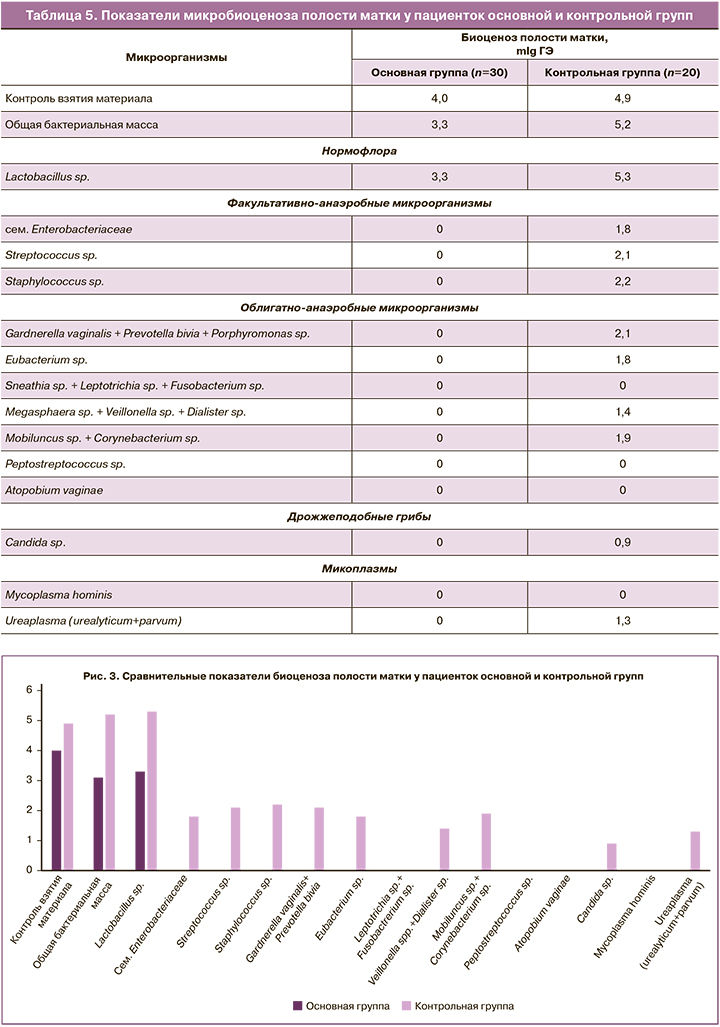
После профилактического применения препарата «Эльжина» в течение 6 дней до проведения внутриматочного вмешательства отмечалось значимое снижение контаминации полости матки как факультативно-анаэробными, так и облигатно-анаэробными микроорганизмами.
У пациенток основной группы общая бактериальная масса в полости матки была ниже в 1,6 раза по сравнению с таковой у пациенток контрольной группы (рис. 3).
У пациенток основной группы, которым была проведена санация влагалища с профилактической целью, в полости матки присутствовали только лактобациллы. Другие представители индигенной и транзиторной влагалищной микрофлоры отсутствовали, что свидетельствует об отсутствии восходящего пути контаминации микроорганизмами при проведении хирургического вмешательства.
У пациенток контрольной группы, которым внутриматочное вмешательство было выполнено без предварительной санирующей терапии в полости матки, в значимо более высоком титре выявлялись разнообразные условно-патогенные микроорганизмы. При сравнении с основной группой титр представителей кишечной микрофлоры и эубактерий был выше в 1,8, стрептококков и стафилококков – в 2,1, вейлонелл и уреаплазм – в 1,3, а мобилункус – в 1,9 раза.
Обсуждение
Миф о том, что полость матки стерильна, был опровергнут в исследованиях Cicinelli E. и Romero R. [10, 18]. Доказано, что доминирование в эндометрии лактобацилл свидетельствует о ее нормальном состоянии [18]. Изменение в соотношении микроорганизмов в сторону условно-патогенных бактерий является патологией, однако на фоне уже существующего и гистологически подтвержденного эндометрита у 32–90% пациенток в полости матки возбудители отсутствуют [19].
В работе Доброхотовой Ю.Э. и соавт. были получены схожие результаты [20, 21]. В группе здоровых женщин у 90% пациенток в эндометрии отсутствовали представители бактериальной или грибковой микрофлоры. Только у 10% обнаружены Lactobacillus sp. и Atopobium vaginae. У пациенток с хроническим эндометритом до лечения бактерии отсутствовали у 1/3, а в остальных образцах преобладали лактобациллы, Atopobium vaginae, энтеробактерии и грибы рода Candida.
Бактерии попадают в полость матки преимущественно восходящим путем, для реализации которого необходимы не только высокие концентрации микроорганизмов во влагалище, но и поломки в иммунном статусе слизистых влагалища и цервикального канала. В случае хирургических вмешательств создаются необходимые условия не только для распространения микроорганизмов, но и для временного угнетения мукозального иммунитета.
В нашем исследовании микробиоценоз влагалища у пациенток основной и контрольной групп характеризовался широким качественным и количественным разнообразием индигенных микроорганизмов, которые отчасти коррелировали с флорой в полости матки. Полученные результаты согласуются с данными Cicinelli E. [9, 10]. Однако в работе Кобаидзе Е.Г. у 66,9% пациенток с ХЭ был диагностирован дисбиоз с доминированием нелактобациллярной микрофлоры [11]. Подобные расхождения могут быть обусловлены применяемыми методами верификации бактерий и критериями формирования выборок.
Заключение
Результаты нашего исследования показали, что у пациенток с нормоценозом влагалища, подтвержденным данными молекулярно-биологического исследования, во влагалище сохраняется значительное видовое и количественное разнообразие представителей индигенной и транзиторной микрофлоры.
Проведение внутриматочного вмешательства без предварительной санации влагалища ассоциировано со значительной внутриматочной контаминацией влагалищными бактериями. Проведение 6-дневного курса профилактической терапии препаратом «Эльжина» позволяет снизить общую бактериальную массу во влагалище без значимого влияния на количество лактофлоры, но в разы снижает количество условно-патогенных факультативно-анаэробных и облигатно-анаэробных бактерий и грибов рода Candida. Проведение впоследствии внутриматочного вмешательства не ассоциировано с реализацией восходящего пути распространения возбудителей.



