Кистозно-аденоматозный порок развития легких (КАПРЛ) и легочная секвестрация (ЛС) являются наиболее частыми патологиями легких плода.
Установлено, что КАПРЛ возникает в результате нарушения развития терминальных бронхиол и образования кист различного диаметра [1–4]. Данная патология начинает формироваться на 5-й неделе гестации. Впервые признаки КАПРЛ были описаны Ch’in K., Tang M. в 1949 г. [5], а первое сообщение о пренатальной диагностике этой патологии легких опубликовано в 1980 г. [6, 7].
ЛС – порок развития, при котором часть аномально развитой легочной паренхимы отделяется от неизмененного легкого. При этом образовавшийся секвестр не связан с воздухоносными путями, не имеет функционального кровотока, а его кровоснабжение осуществляется изолированным сосудом, отходящим непосредственно от аорты [3, 4, 8]. Впервые данная патология была описана Rokitansky в 1861 г. [9] и в дальнейшем детализирована Pryce в 1946 г. [10].
За последние 20 лет отношение к данным порокам развития претерпело существенные изменения. Ранее эта внутриутробная патология легких обычно рассматривалась как крайне неблагоприятный для жизни порок развития, в связи с чем рекомендовалось прерывание беременности [6,11–14]. Однако в настоящее время большинство авторов сообщают о высокой выживаемости новорожденных с данной патологией [6, 12, 14–17]. Хорошо известен также феномен самопроизвольного исчезновения ее патологических признаков в конце беременности, что, по мнению ряда авторов, может достигать 50% [1, 12, 15, 16]. Также ранее высказывалось мнение, что смещение средостения большими размерами патологического участка легкого относится к прогностически неблагоприятному признаку. Однако в настоящее время установлено, что смещение средостения наблюдается довольно часто – в 50–60% наблюдений [1, 6, 14, 18] и не оказывает заметного влияния на выживаемость новорожденных. Последнее, как было установлено, связано с тем, что в процессе прогрессирования беременности в 60% случаев происходит уменьшение объема патологической ткани [5, 15, 19].
В настоящее время к единственно прогностически неблагоприятному признаку относят развитие водянки плода, что встречается в 5–10% наблюдений [6, 14–16, 20]. Ряд авторов [6, 15, 16, 21] считают, что проведение внутриутробного лечения при водянке плода позволяет повысить выживаемость новорожденных, тогда как другие придерживаются выжидательной тактики ведения беременности при этом осложнении.
Частота и диагностика
По данным исследований, опубликованных в начале 2000 гг., частота КАПРЛ варьирует в пределах 1 на 11 000–35 000 новорожденных [18]. Stocker L. и соавт. [18], в результате ретроспективного анализа выявления данной патологии за 19-летний период наблюдений в одном из регионов Англии отметили значительное увеличение ее диагностики в пренатальном периоде в последнее десятилетие. Так, по их данным, за период 1994–1998 гг. частота встречаемости составила 1,27 на 10 000 новорожденных, в то время как за период с 2008 по 2012 гг. – 4,15 на 10 000. Это, по их мнению, связано с увеличением разрешающей способности ультразвуковых приборов и повышением опыта оператора [7, 18], что подтверждают также и исследования Walker L. [15]. Так, проведенный им анализ пренатально диагностированных случаев легочной патологии в двух регионах Северной Англии (население более 8 млн человек), показал, что частота встречаемости этой патологии составляет 1:3000. По данным некоторых авторов, частота данной аномалии достигает 1:2000–2500 новорожденных [12, 13, 20].
Частота встречаемости ЛС точно не известна [8]. По данным Walker L. [15], диагноз ЛС был поставлен в 11% случаев (из 228 плодов с патологий легких) на основании выявления отдельного питающего сосуда.
Не отмечено зависимости патологии легких от пола плода. Она встречалась с одинаковой частотой у плодов как мужского, так и женского пола [4, 18, 20].
Сопутствующая патология при КАПРЛ выявляется в 3–18% случаев и наиболее часто сочетается с аномалиями сердечно-сосудистой и мочевыделительной систем [1, 6, 15, 16]. Хромосомная патология встречается редко, она отмечена только у 1% плодов с наличием сочетанных пороков развития [15].
При ЛС сочетанные пороки развития выявляются в 10–22%, из них наиболее часто встречаются врожденная диафрагмальная грыжа, патология сердечно-сосудистой системы, легочная гипоплазия [1].
Классификация кистозного аденоматоза
В настоящее время предложено несколько классификаций КАПРЛ. Согласно классификации Stocker J. [22], которая основана на размере кист и выстилающего их эпителия, выделяют следующие типы этой патологии:
- I тип – большие кисты 2–10 см в диаметре, выстланные многослойным эпителием, данный тип составляет 50% всех КАПРЛ;
- II тип – кисты 0,5–2 см, выстланные цилиндрическим эпителием, наблюдается в 35% КАПРЛ;
- III тип – микрокисты, менее 0,5 см, выстланные кубическим эпителием, определяется в 10% КАПРЛ.
Впоследствии к этой оригинальной классификации было добавлено еще два типа: 0 тип – солидная ткань и IV тип – одна большая киста. Эти два типа составляют всего 5% всех КАПРЛ.
Классификация Adzick N. [23] основана на эхографических и анатомических признаках:
- I тип – единичные или множественные кисты (более 5 мм в диаметре);
- II тип – множественные микрокисты (менее 5 мм в диаметре), создающие при эхографии эффект гиперэхогенного легкого.
Delacourt C. [19] предлагает в пренатальном периоде в зависимости от эхографической картины выделять два типа аномалии: кистозный/смешанный (при наличии хотя бы одной крупной кисты) или гиперэхогенный (при котором кисты не определяются).
Классификация легочного секвестра основана на его локализации. Выделяют интралобарный секвестр, который окружен нормальной легочной паренхимой, он встречается в 85% наблюдений, экстралобарный – имеет собственную плевру, составляет 10% случаев, и абдоминальный, т.е. расположенный в брюшной полости, обычно ретроперитонеально, около 5% от всех ЛС [8]. Однако в настоящее время существует мнение, что данные патологические состояния нельзя рассматривать как самостоятельные нозологические единицы. Это подтверждается морфологическими исследованиями, свидетельствующими о том, что около 50% КАПРЛ и ЛС являются «гибридными формами», а КАПРЛ II типа в 50% наблюдений непосредственно определяется в ЛС [6]. При этом «гибридная форма» патологии легких может иметь гистологические признаки КАПРЛ и в то же время кровоснабжаться отдельным сосудом, отходящим от аорты, что характерно для ЛС [3, 6, 24, 25]. В исследованиях Davenport M. [26] «гибридная форма» патологии легких у плода имела место в 25% случаев, а в 44% пренатально диагностируемых случаев КАПРЛ с наличием макрокист после рождения был установлен либо ЛС, либо «гибрид».
Возможно, этим объясняется то, что, несмотря на предложенные в настоящее время несколько классификаций КАПРЛ, все еще недостаточно велико совпадение пренатально установленного и гистологического диагнозов [1, 19].
Учитывая схожее течение беременности и одинаковые исходы при обеих нозологиях, следует считать логичным объединение их в пренатальном периоде в одну группу – мальформация легких.
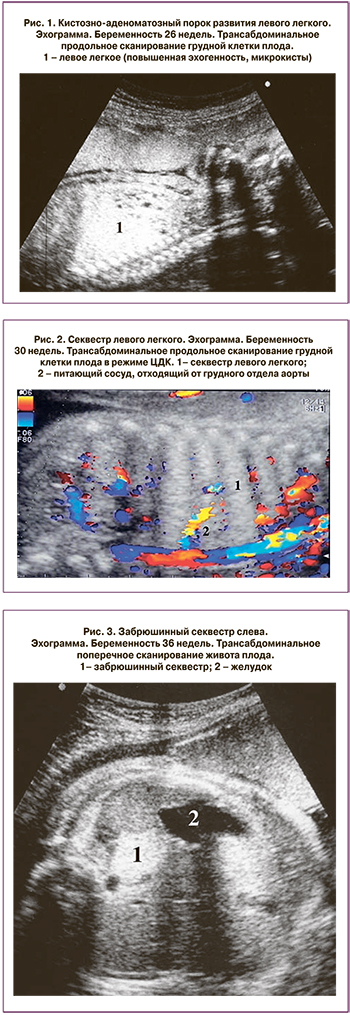 Пренатальная диагностика
Пренатальная диагностика
Пренатальная диагностика аномалий легочной ткани обычно возможна с 20–21 недели беременности [1, 2, 6, 15]. При эхографии в грудной клетке плода определяется увеличение размеров и повышение эхогенности легкого с наличием или отсутствием в нем кистозных включений (рис. 1–3).
В подавляющем числе наблюдений изменениям подвергается одна из долей легкого и процесс имеет одностороннюю локализацию (более чем в 95% наблюдений это нижняя доля). В крайне редких случаях, менее 5%, имеет место двусторонняя локализация или поражается несколько долей легкого [1, 3, 6, 15].
По данным Cavoretto P. [16] и M. Davenport [26], КАПРЛ практически с одинаковой частотой встречается как в правом, так и в левом легком, 43–48% и 52–54% соответственно.
Микрокисты внутриутробно определяются чаще, чем макрокисты, – 40–80% и 20–40% соответственно, их сочетание имеет место в 10–20% наблюдений [5, 15, 16].
Большинство исследователей отмечают, что пиком роста легочной патологии является срок 26–28 недель беременности [1, 15]. В дальнейшем, обычно после 32 недель, может происходить уменьшение размера или полное исчезновение внутриутробных признаков данной патологии [4, 12, 14, 16, 19, 20, 27, 28].
Уменьшение в размерах патологической ткани и снижение эхогенности легких в процессе прогрессирования беременности происходит в 32–76% случаев. Чаще это отмечается при микрокистах – 64–75% и ЛС – 54% по сравнению с макрокистами – 38% [6, 15, 20, 29].
Полное исчезновение выявляемых ранее при ультразвуковом исследовании признаков патологии легких в III триместре беременности отмечается у 15–50% плодов [1, 4, 6, 12, 15, 16, 29].
В 45–70% случаев увеличенная доля легкого может являться причиной смещения средостения и компрессионного сдавления нормального легкого [6, 15, 18]. Смещение средостения наиболее часто происходит при наличии макрокист – в 64% и реже при микрокистах – в 43% [15]. В результате сдавления пищевода патологически измененным участком легкого может нарушиться процесс глотания и развиться многоводие. Многоводие выявляется у 28% плодов, причем тоже преимущественно при макрокистах и ЛС [18]. Однако данные изменения не являются предикторами неблагоприятного прогноза [6]. На исход беременности не влияют также тип образования (солидная или кистозная его структура) и срок внутриутробной диагностики [1].
Исходы после рождения в группе с наличием рассматриваемой легочной патологии у плода без развития водянки благоприятные. Выживаемость новорожденных составляет 88–97%. Причинами неблагоприятного исхода могут стать преждевременные роды, внутриутробная или неонатальная гибель, прерывание беременности по показаниям, не связанным с патологией легких, вирусная пневмония после рождения [6, 15, 16].
В настоящее время принято полагать, что неблагоприятным вариантом течения беременности при легочной мальформации является развитие водянки плода [1, 2, 6].
Во внутриутробном периоде появление данного осложнения отмечено в 5–9% наблюдений [15, 16], в отдельных исследованиях достигает 17,6% [6]. Развитие водянки в преимущественном большинстве отмечается при наличии макрокист и ЛС.
Причины возникновения водянки плода остаются до конца не выясненными. Ряд исследователей придерживаются мнения, что появление данного симптома связано со сдавлением нижней полой вены или сердца большими размерами образования и смещением средостения [30]. Другие же исследователи [6], напротив, сосудистую теорию считают основной при возникновении водянки плода. В качестве аргумента они приводят врожденную диафрагмальную грыжу, когда даже большой объем органов брюшной полости, сдавливая сердце, не приводит к развитию водянки. Некоторые авторы [6] придерживаются мнения, что увеличенная циркуляция крови через секвестрированное легкое приводит к возникновению хронической сердечной недостаточности, в результате чего развивается водянка плода.
Crombleholme T.M. и соавт. [31] предложили внутриутробно вычислять показатель СVR (cystic adenomatoid malformation volume ratio) – отношение объема КАПРЛ к окружности головы. Чем он выше, тем более вероятно развитие водянки плода. При CVR более 1,6 водянка плода развилась в 75% случаев. При CRV менее 1,6 и отсутствии макрокист развитие водянки отмечалось только в 3% [6, 32]. Анализ 8 наблюдений КАПРЛ с водянкой, проведенный Chon A. и соавт. [21], показал, что CRV у этих плодов варьировало от 1,6 до 7,0, составляя в среднем 3,3. По данным ряда авторов [14, 28, 33, 34], у 90% плодов без водянки с благоприятным исходом после рождения CVR был менее 1,0. При CRV >1,0 в 75% случаев после рождения отмечалось развитие дыхательных нарушений .
Выживаемость при водянке при выжидательной тактике ведения беременности и без внутриутробного вмешательства не превышает 38–50% [6, 16]. В настоящее время при развитии данного осложнения внутриутробно возможно проведение хирургического лечения. Cavoretto P. [16] при осложнении КАПРЛ водянкой плода внутриутробно проводил торако-амниотическое шунтирование. Выживаемость составила 44%, антенатальная и постнатальная смертность – 56%.
Chon A. и соавт. [21] при КАПРЛ и водянке у 8 плодов применяли внутриутробную склеротерапию, в результате которой выживаемость составила 50% и внутриутробная гибель – 50%.
По данным Walker L. [15], выживаемость при развитии водянки составила 38% (из них в 38% наблюдениях было проведено торако-амниотическое шунтирование и в 62% – без внутриутробного вмешательства произошло спонтанное исчезновение патологии).
В исследованиях P. Cavoretto [16] ЛС в сочетании с выраженным гидротораксом и смещением средостения диагностирована в 8 наблюдениях. Внутриутробно была проведена лазерная коагуляция питающего сосуда с благоприятным исходом – в 3 случаях произошло полное исчезновение секвестра до рождения и в 5 проведена секвестрэктомия после рождения.
Как уже отмечалось ранее, в процессе прогрессирования беременности в 15–50% случаев в III триместре отмечалось исчезновение патологических признаков рассматриваемой патологии [1, 6, 15, 16]. Однако после проведения компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ) у новорожденных «исчезнувшая» патология вновь выявлялась в 60–100% наблюдений [5, 12, 16].
При этом авторы отмечают низкую диагностическую точность рентгенографии (около 60%) по сравнению с КТ.
P. Cavoretto и соавт. [16] высказали предположение, что возможное полное исчезновение признаков патологии легких после рождения объясняется внутриутробной транзиторной обструкцией бронхов и скоплением жидкости дистальнее их обструкции, а не развитием КАПРЛ.
Тактика ведения
Тактика ведения беременности при патологии легких зависит от размеров образования. Большие размеры и смещение средостения требуют родоразрешения в условиях стационара с возможностью оказания хирургической помощи. При небольших или исчезнувших образованиях роды могут проводиться в обычных родовспомогательных учреждениях, однако новорожденный в дальнейшем должен быть обследован детским хирургом. После рождения дети с наличием соответствующих симптомов требуют немедленного оперативного вмешательства [1, 13].
Что касается тактики ведения новорожденных с бессимптомным течением патологического процесса, то часть специалистов придерживаются консервативной тактики ведения, полагая, что симптомы в дальнейшем могут и не появиться, а риск заболеваемости и смертности при лобэктомии довольно высок [1, 13, 35]. L.J. Stocker и соавт. [18] в своих исследованиях отмечают, что хирургическое лечение в подобных случаях было проведено только у 9,7% новорожденных.
Walker L. и соавт. [15] также придерживаются консервативной тактики ведения с асимптоматичным течением данной патологии. Хирургическое лечение было проведено только у 28 (12%) детей. Послеоперационная летальность имела место у 2 новорожденных, причем оба ребенка были недоношенными. Несмотря на высокую диагностическую значимость КТ с контрастированием, эти авторы считают, что для новорожденного данный метод обладает высокой радиоактивной нагрузкой, и в их практике он выполняется только перед хирургическим вмешательством. В приведенном ими исследовании в постнатальном периоде бессимптомное течение заболевания, по данным рентгенографии, имело место у 44 новорожденных. У 19 детей в последующем за период с 7 месяцев до 5 лет появились симптомы заболевания, и им было проведено хирургическое лечение.
Однако большинство детских хирургов полагают, что проведение плановой операции до появления явных симптомов более безопасно и дает лучшие результаты. Пациенты с патологией легких, диагностированной внутриутробно, несмотря на отсутствие симптомов после рождения, должны пройти КТ с внутривенным контрастированием в возрасте 4–6 недель, а в 3–6 месяцев жизни им проводится лобэктомия [7]. В дальнейшем КАПРЛ может явиться причиной таких осложнений, как пневмония, пневмоторакс, гемоторакс, хилоторакс [4, 27, 32]. В литературе описаны также случаи малигнизации образования – легочная бластома, бронхогенная карцинома, рабдомиосаркома. Точное количество случаев малигнизаций, связанных с КАПРЛ, неизвестно, по всей вероятности, очень небольшое [13]. В настоящее время отмечается, что риск после хирургического вмешательства низкий. Ранняя резекция патологического участка легкого может также способствовать компенсаторному росту и увеличению нормального легкого. По данным авторов [1], за период с 1996 по 2005 гг. послеоперационная смертность составила 0%, а осложнения имели место в 6,7% случаев, что, прежде всего, было связано с развитием кровотечения. Установлено также отсутствие значительных различий в исходе лечения у пациентов разных возрастных групп. В то же время раннее удаление патологического образования способствует значительному компенсаторному увеличению легкого, которое было компрессировано аномально развитой тканью [3, 4, 7, 36].
Заключение
Таким образом, проведенный нами обзор данных литературы за последние десятилетия свидетельствует, что частота патологии легких в пренатальном периоде значительно увеличилась и составляет в среднем 1:2500–3000 новорожденных, что, как полагают, связано в основном с повышением разрешающей способности ультразвукового оборудования.
Наиболее часто встречающейся патологией легких в пренатальном периоде являются КАПРЛ и ЛС. В 30–50% наблюдений отмечается их сочетание, что приводит к образованию «гибридных форм».
В 95% наблюдений при указанной мальформации легких исход для новорожденного благоприятный. Неблагоприятный исход отмечен в 5–9% случаев и связан с развитием водянки плода. При консервативной тактике ведения водянки плода летальный исход варьирует от 50 до 100%. При проведении внутриутробного хирургического лечения выживаемость колеблется от 40 до 50%.
В 15–50% наблюдений в процессе прогрессирования беременности происходит спонтанное исчезновение выявляемых ранее признаков рассматриваемой патологии. В постнатальном периоде рентгенологическое исследование имеет низкую диагностическую ценность. Проведение в постнатальном периоде КТ с внутривенным контрастированием практически в 100% наблюдений позволяет обнаружить диагностируемую ранее патологию.
Наличие симптомов дыхательной недостаточности после рождения однозначно является показанием к хирургическому лечению.
Тактика ведения новорожденных с бессимптомным течением заболевания неоднозначна. В подавляющем большинстве случаев проводится резекция пораженного участка легкого или секвестрэктомия. Другая точка зрения заключается в динамическом наблюдении за развитием ребенка. Оперативное лечение проводится при возникновении каких-либо осложнений. Существует мнение, что более длительный период наблюдения за такими детьми будет способствовать выработке наиболее рациональной тактики их ведения.



