Преэклампсия (ПЭ) – мультисистемное патологическое состояние, возникающее во второй половине беременности, характеризующееся артериальной гипертензией в сочетании с протеинурией, отеками и системным воспалением [1]. На сегодняшний день ПЭ – одна из главных причин материнской, перинатальной заболеваемости и смертности, поскольку данное заболевание не имеет значимых диагностических и прогностических признаков на ранней стадии. Известные в настоящий момент механизмы развития ПЭ сложны и не до конца изучены и предполагают вовлечение большого ряда молекул в патогенез заболевания, что не позволяет точно определить главные причины развития ПЭ и назначить эффективное лечение [2].
На сегодняшний день существуют доказательства того, что важным фактором развития ПЭ является активация воспаления [3, 4]. Одним из потенциальных воспалительных маркеров ПЭ считается прокальцитонин (PCT). РСТ является предшественником кальцитонина, который принимает участие в процессе гомеостаза кальция. В норме его количество в сыворотке крови минимально (<0,05 нг мл), однако во время тяжелого воспаления уровень РСТ быстро повышается (до 2–10 нг/мл). По этой причине РСТ выступает в качестве общепринятого прогностического и диагностического маркера воспалительного процесса [5]. Недавно выяснилось, что PCT связан с нарушениями беременности, такими как ПЭ, поскольку данное состояние характеризуется выработкой большого количества провоспалительных цитокинов, а они, в свою очередь, могут непосредственно вызывать увеличение уровня PCT [4]. По данным зарубежных и российских авторов, было показано, что у беременных женщин с ПЭ уровень PCT в сыворотке крови выше, чем в сыворотке крови здоровых беременных женщин, что подчеркивает наличие воспалительного статуса у этих пациенток [3, 6]. В связи с этим рассматривается необходимость оценки в клинической практике уровня данного показателя совместно с другими маркерами заболевания [7].
Помимо активации воспаления, ПЭ может развиваться в результате стойкой гипоксии плаценты, которая приводит к эндотелиальной дисфункции, воспалительному ответу и тканевой гипоксии матери [8]. В условиях гипоксии тканей увеличивается синтез лактата, а повышение его концентрации может являться предиктором развития ПЭ.
Несмотря на подтвержденную в разных исследованиях диагностическую значимость измерения уровня РСТ и лактата в исследовании патогенеза ПЭ, данные показатели все еще не включены в российские стандарты диагностики и лечения ПЭ, что ограничивает раннее выявление заболевания и своевременное лечение.
На развитие ПЭ могут влиять и нарушения гемостаза у беременных женщин [9–11]. Среди факторов риска развития данного осложнения беременности выделяют полиморфные варианты генов, ответственных за развитие тромбозов – ген F2, кодирующий фактор свертываемости крови II (протромбин), ген F5, кодирующий фактор свертываемости крови V (фактор Лейден), а также ген MTHFR, кодирующий белок метилентетрагидрофолатредуктазу, ответственный за превращение фолиевой кислоты в метаболически активные формы. Изучение данных генов является важным для практики, поскольку наличие описанных выше полиморфизмов приводят к гиперкоагуляции, которая способствует снижению перфузии плаценты за счет микротромбов в кровеносных сосудах плаценты, что в конечном итоге приводит к ишемии плаценты и развитию ПЭ [12].
Цель исследования: изучить уровень РСТ и лактата в сыворотке крови, а также проанализировать распространенность полиморфных вариантов генов тромбофилии и фолатного цикла у беременных с ПЭ.
Материалы и методы
В исследование были включены 40 беременных женщин, с диагнозом ПЭ, поступивших в отделение реанимации, анестезиологии и интенсивной терапии КГБУЗ «КМРД №5». Диагноз ПЭ устанавливали на основании клинических проявлений и по результатам клинико-лабораторного обследования в соответствии с протоколами Минздрава Российской Федерации относительно гипертензивных состояний во время беременности [1]. Средний возраст группы пациентов – 30,45 (3,23) года. В контрольную группу были включены 40 женщин с физиологическим течением беременности. Средний возраст контрольной группы – 30,4 (2,83) года.
Среди обследованных пациенток с ПЭ легкая степень тяжести была установлена у 13/40 женщин (32,5 %), средняя – у 25/40 (62,5 %) и тяжелая – у 2/40 (5 %). ПЭ при прошлых беременностях отмечена у 14 из 40 пациенток, среди которых с легкой степенью тяжести – 4/14 женщины (28,6 %), со средней – 10/14 (71,4 %).
Всем беременным женщинам были выполнены стандартные клинико-биохимические исследования: подсчет количества тромбоцитов в цельной крови, определение количества фибриногена в плазме крови, билирубина в сыворотке крови, активности ферментов АЛТ, АСТ и ЛДГ в сыворотке крови, а также количества белка в моче. Биохимические исследования проводились на автоматическом анализаторе BS-380 (Mindrау, КНР), гематологические исследования – на анализаторе BC-5800 (Mindray, КНР), количественное определение белка в моче – с использованием набора «Белок-ПГК-Ново» («Вектор-Бест», Россия) на фотометре Photometer 5010 V5+ (Германия).
Кроме стандартных клинико-лабораторных исследований, всем обследованным беременным женщинам было проведено измерение показателей уровня РСТ и лактата, а также проведен генетический анализ на наличие полиморфизмов в генах, ассоциированных с тромбофилиями: F2 (rs1799963, G20210A), F5 (rs6025, G1691A) и MTHFR (rs1801133, C677T).
Определение количества РСТ в сыворотке крови проводилось с помощью иммунохроматографического метода набором реагентов «ИХА-прокальцитонин-тест» (ООО «ИнВитроТест», Россия). Уровень лактата в сыворотке крови оценивали с помощью анализатора GEM Premier 3500 (IL Werfen, США).
Для анализа полиморфизмов в генах F2, F5 и MTHFR использовалась геномная ДНК, выделенная из лейкоцитов цельной крови с использованием комплекта реагентов «ДНК-экспресс-кровь» (НПФ «Литех»). Далее с образцами выделенной ДНК была проведена ПЦР с использованием комплектов реагентов для амплификации «SNP-экспресс-РВ» (НПФ «Литех») с детекцией результатов в режиме реального времени.
Статистический анализ
Статистическую обработку результатов проводили с помощью пакета прикладных программ Statistica (Версия 13.0) и программы MS Excel for Windows (2016). Статистические расчеты количественных показателей включали в себя описательные статистики: медиана (Me) и интерквартильный интервал в формате Me (Q1; Q3) при несоответствии выборки нормальному закону распределения. Проверка нормальности распределения значений проводилась с использованием критерия Колмогорова–Смирнова. Для сравнения средних значений двух независимых выборок при несоответствии нормальному закону распределения применялся критерий Манна–Уитни с поправкой Бонферрони. Для вычисления силы взаимосвязей показателей вычислялся коэффициент ранговой корреляции по Спирмену с последующим расчетом доверительного интервала. Для качественных показателей вычислялись следующие показатели: число наблюдений и доля (в %) от общего количества пациентов или от количества пациентов в соответствующей подгруппе. Для категориальных переменных применяли точный критерий Фишера. Значения считали статистически значимыми при р<0,05.
Результаты и обсуждение
Исследованные в ходе работы клинико-лабораторные показатели всех обследованных беременных женщин представлены в таблице 1. Женщины с беременностью, осложненной ПЭ, характеризовались повышенным артериальным давлением (>140/90 мм рт.ст.) по сравнению с группой женщин с физиологическим течением беременности (<120/80 мм рт.ст.), а также имели наиболее высокие показатели уровня белка в моче, фибриногена, билирубина, активности ферментов АСТ, АЛТ и ЛДГ в сыворотке крови по сравнению с контрольной группой, что подтверждает адекватность использования данных маркеров в качестве диагностических критериев заболевания.

Согласно литературным данным [13], одной из причин развития ПЭ является эндотелиальная дисфункция, в результате чего эндотелий легко повреждается. Для репарации повреждений активируется система сосудистого гемостаза, приводящая к появлению на стенках сосудов микротромбов и фибриновых отложений, которые затрудняют кровоток, особенно во внутрипеченочных сосудах. Все это приводит к дегенерации клеток печени с последующим высвобождением в кровоток ферментов – АСТ, АЛТ, ЛДГ, а также билирубина. В ответ на развивающееся при ПЭ системное воспаление увеличивается содержание в крови фибриногена, который является белком острой фазы воспаления, что также может приводить к повышенному тромбообразованию [14].
Протеинурия же при ПЭ обуславливается изменениями в почечных клубочках, называемыми «гломерулярный эндотелиоз», при котором происходит набухание и вакуолизация эндотелиальных клеток нефронов, а также отложение фибрина в эндотелии. В результате поражения клубочков развивается их проницаемость, которая позволяет большому количеству белка из плазмы проникать в первичную мочу [15].
Помимо повышения уровня стандартных клинико-лабораторных показателей, у женщин с ПЭ наблюдалось повышение уровня показателей PCT и лактата по сравнению с контрольной группой. Как отмечалось ранее, РСТ может синтезироваться в организме под действием провоспалительных цитокинов, которые характерны для состояния ПЭ. Таким образом, исходя из полученных данных, можно отметить, что PCT – биомаркер, необходимый для понимания воспалительного профиля матери и может быть полезным для диагностики серьезных осложнений таких, как HELLP-синдром и эклампсия. Увеличение уровня лактата в сыворотке крови обусловлено повышением активности ЛДГ, в частности изофермента ЛДГ-5, в результате деградации гепатоцитов и может свидетельствовать о клеточной гипоксии из-за описанных ранее макроциркуляторной или микроциркуляторной дисфункций [7].
Хотя при ПЭ, в частности при тяжелой степени ПЭ, наблюдается развитие тромбоцитопении, обусловленной истощением тромбоцитов в результате образования микротромбов при повреждении эндотелия [13], в нашем исследовании статистически значимых отличий по показателю количества тромбоцитов между группами женщин с ПЭ и женщин с физиологическим течением беременности не обнаружено. Это может объясняться малой выборкой пациенток с тяжелой степенью ПЭ, которые могли бы внести наибольший вклад в суммарное количество тромбоцитов.
Сравнение клинико-лабораторных показателей между группами женщин с разной степенью тяжести ПЭ и контрольной группы представлены в таблице 2. Нужно обратить внимание на то, что группа женщин с тяжелой степенью ПЭ представлена лишь 2 пациентками, что ограничивает поиск ассоциаций между исследуемыми показателями и степенью тяжести заболевания. По результатам исследования обнаружено статистически значимое повышение лишь уровня белка в моче в группе со средней степенью тяжести по сравнению с соответствующим показателем в группе с легкой степенью ПЭ. Стоит отметить, что в зарубежных странах протеинурию исключили из диагностических критериев ПЭ, поскольку количество белка не коррелировало со степенью тяжести заболевания [16, 17].

Также было показано, что развитие тяжелой степени заболевания не ассоциировано с повышением уровня РСТ и лактата в сыворотке крови, что ограничивает использование этих маркеров в целях уточнения степени тяжести ПЭ.
Проведение корреляционного анализа показало, что у женщин с ПЭ значения РСТ и лактата положительно коррелируют с уровнем фибриногена в сыворотке крови (r=0,38, p<0,05, ДИ [-0,07; 0,53] и r=0,35, p<0,05, ДИ [-0,1; 0,51], соответственно), а также с содержанием белка в моче (r=0,44, p<0,05 ДИ [-0,007; 0,58] и r=0,5, p<0,05, ДИ [0,07; 0,63], соответственно). Это, по-видимому, также объясняется развитием эндотелиальной дисфункции, воспаления и набуханием эндотелиальных клеток нефронов при данном состоянии. Кроме того, наблюдалась слабая положительная корреляционная взаимосвязь между уровнем фибриногена и количеством тромбоцитов в крови (r=0,49, p<0,05, ДИ [0,06; 0,62]), а также содержанием белка в моче (r=0,43, p<0,05, ДИ [-0,02; 0,57]). Однако таких взаимосвязей не наблюдалось в контрольной группе. Нужно отметить, что в группе женщин с ПЭ, как и в группе женщин без патологии, наблюдалась сильная положительная корреляция между уровнем АСТ и АЛТ (r=0,87, p<0,05, ДИ [0,97; 0,99] и r=0,86, p<0,05, ДИ [0,95; 0,99] соответственно). Кроме этого, у женщин с ПЭ выявлены корреляционные взаимосвязи активности АЛТ с уровнем ЛДГ (r=0,37, p<0,05, ДИ [-0,08; 0,53]) и билирубина (r=0,38, p<0,05, ДИ [-0,07; 0,53]). Также значения активности АЛТ у женщин с ПЭ положительно коррелировали с показателями количества тромбоцитов в крови (r=0,46, p<0,05, ДИ [0,02; 0,59]), в то время, как в контрольной группе между данными показателями наблюдалась обратная отрицательная связь (r=-0,4, p<0,05, ДИ [-0,47; 0,15]).
В ходе генетического анализа нуклеотидных полиморфизмов генов тромбофилии (F2, F5) и фолатного цикла (MTHFR) была изучена распространенность разных вариантов генотипов среди группы беременных женщин с ПЭ и группы женщин с физиологическим течением беременности (табл. 3). Статистически значимых отличий по распространенности полиморфизмов G20210A (rs1799963) в гене F2, G1691A (rs6025) в гене F5 и C677T (rs1801133) в гене MTHFR между исследованными группами выявлено не было.
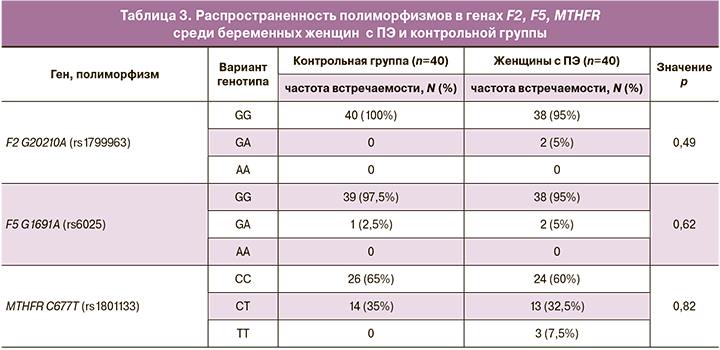
Согласно литературным источникам, распространенность генотипов GG, GA, AA полиморфизма G20210A гена F2 среди русских женщин с ПЭ составила 67%, 22%, 11%, соответственно; генотипов GG, GA, AA полиморфизма G1691A в гене F5 – 57%, 41% и 4%, соответственно; генотипов CC, CT, TT полиморфизма C677T гена MTHFR – 46%, 37%, 17%, соответственно [18].
Хотя минорные аллели изучаемых нами полиморфизмов и связывают с рисками тромбозов и развития ПЭ, информация об ассоциации с заболеванием изучаемых полиморфизмов разноречива. Так, в некоторых исследованиях сообщалось, что полиморфизмы G20210A в гене F2, G1691A в гене F5 и C677T в гене MTHFR не ассоциированы с ПЭ и потерей беременности, предполагая, что развитие данного состояния может объясняться возможной мультифакторной этиологией, этническими особенностями группы, а также вовлеченностью других генов [19, 20].
Интересно отметить, что уровень РСТ в группе женщин с ПЭ, имеющих в генотипе мутантный аллель Т полиморфизма C677T в гене MTHFR в гетеро- или гомозиготном варианте (СТ и ТТ) был ниже, чем у женщин с ПЭ, имеющих только нормальный вариант аллеля С в гомозиготном состоянии (СС). Для объяснения данного результата требуется увеличение выборки обследуемых женщин с ПЭ и проведение дополнительных исследований.
Заключение
Результаты проведенного исследования показали, что при ПЭ наблюдается повышение уровней PCT и лактата, что подчеркивает наличие воспалительной реакции и клеточной гипоксии. Это доказывает, что исследование РСТ и лактата в совокупности со стандартными клинико-лабораторными показателями имеет клиническое значение в ранней диагностике ПЭ. Однако использование РСТ и лактата в качестве маркера для уточнения степени тяжести заболевания ограничено, поскольку увеличение степени тяжести ПЭ не влечет за собой повышение уровней данных показателей в сыворотке крови беременных. Интересно отметить, что уровень РСТ в группе женщин с ПЭ, имеющих генотипы СТ и ТТ полиморфизма C677T в гене MTHFR ниже по сравнению с соответствующим показателем в группе женщин с ПЭ с генотипом СС.



