На фоне продолжающегося снижения численности населения России вопросы преодоления бездетности исключительно актуальны.
Основная доля репродуктивных потерь происходит на ранних сроках беременности. Ключевым фактором нарушения имплантации является недостаточная инвазия слизистой оболочки матки экстравиллярным трофобластом [1]. В период «окна имплантации» железы эндометрия достигают пика функциональной активности, изменяется структурный состав стромы [2]. Поверхностный эпителий полости матки (люминальный эпителий, ЛЭ) обеспечивает восприимчивость эндометрия к имплантации бластоцисты и становится тканью первого контакта матери с эмбрионом [3].
Установлено, что нарушение имплантации в 14–67% случаев [4–7] и невынашивание беременности на ранних сроках в 9,3–67,6% случаев [4, 7, 8] обусловлены хроническим эндометритом (ХЭ). Распространенность ХЭ составляет 2,8–56,8% у бесплодных пациенток и 9,3–67,6% у женщин с рецидивирующей потерей беременности [7].
Несмотря на многочисленные исследования, ХЭ остается недостаточно изученной патологией. Отсутствуют системные представления о механизмах возникновения ХЭ, критериях диагностики, не разработаны методы эффективной терапии [9].
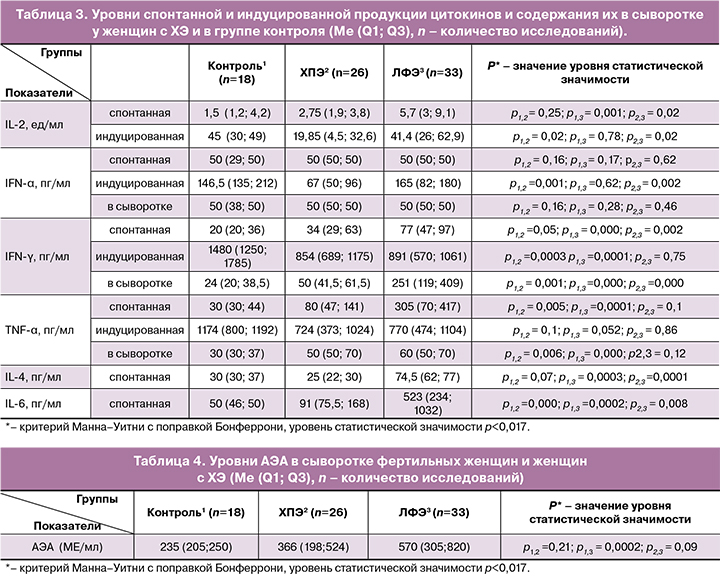
ХЭ – длительно текущий процесс, при котором экссудация, альтерация и репарация могут присутствовать одновременно в различных комбинациях. Воспаление проявляется развитием очагового или диффузного клеточного инфильтрата, обусловленного отеком и мигрирующими в строму лейкоцитами. Прогрессирующее продуктивное воспаление приводит к развитию новых морфологических структур, способствующих разрешению воспаления и одновременно препятствующих имплантации. Так, за счет гиперплазии функционального слоя изменяется поверхностный эпителий – формируются микрополипы, тип строения ЛЭ при этом сохраняется. Микрополипоидность эндометрия является типичным проявлением хронического воспаления [10]. Микрополипы свидетельствуют о наличии стимулирующего пролиферацию агента и характеризуют более выраженную степень воспаления в эндометрии. При гистологическом исследовании микрополипы состоят из небольших васкуляризированных выростов отечной стромы, покрытых однорядным эпителием [11, 12]. По завершении воспаления микрополипы исчезают бесследно [13].
Выявить микрополипоз возможно при гистологическом и гистероскопическом исследованиях [14]. Микрополипы могут располагаться по эндометрию неоднородно: очагово, диффузно или группами [15, 16]. Частота встречаемости микрополипов в эндометрии при гистероскопии варьирует, по данным разных авторов, от 2,1% [17] –11% [15] до 41,8% [18].
В отличие от микрополипа, истинный полип эндометрия представляет собой доброкачественное узловое экзофитное образование слизистой тела матки, состоящее из эндометриальных желез и стромы, преимущественно фиброзной, содержащей «клубок» толстостенных кровеносных сосудов [19].
В норме у женщины репродуктивного возраста в базальном слое эндометрия с поздней пролиферативной до поздней секреторной стадии менструального цикла присутствуют лимфоидные инфильтраты, состоящие из зоны В-клеток, окруженной Т-клетками и ореолом макрофагов. Размер лимфоидных инфильтратов изменяется в зависимости от стадии менструального цикла, увеличиваясь в секреторную фазу до 3000–4000 клеток по сравнению с 300–400 клетками в пролиферативную фазу за счет миграции иммунных клеток [20]. Количество В-лимфоцитов, присутствующих в базальном слое эндометрия, увеличивается от пролиферативной фазы, составляя 0,3%, к секреторной фазе цикла, достигая 1,6–2% лимфоидной популяции [21, 22]. Выявляют В-лимфоциты в стромальном слое эндометрия крайне редко, они отсутствуют в поверхностном железистом эпителии или просвете желез.
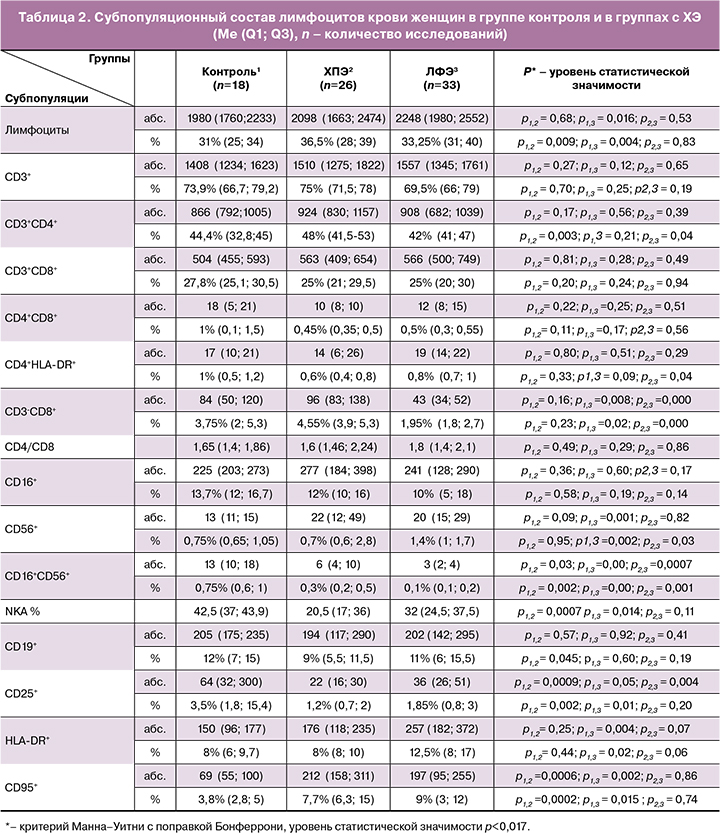
При ХЭ В-клетки рекрутируются в функциональный слой эндометрия, накапливаются в строме, проникают в слой железистого эпителия, могут мигрировать сквозь него в просвет желез и формировать лимфоидные инфильтраты интра-, перигландулярно и периваскулярно, независимо от фазы менструального цикла [21, 23]. В стромальной области функционального слоя В-клеточная инфильтрация сочетается с наличием плазматических клеток [4, 7], синтезирующих различные антитела.
В-клетки в эндометрии идентифицируются по наличию на мембране иммунофенотипического маркера – молекулы CD20, которая способствует оптимальному гуморальному ответу, в том числе на Т-независимые антигены, исчезает на стадии дифференцировки активированных В-лимфоцитов в плазматические клетки.
Показателем активации иммунных клеток является молекула HLA-DR, которая присутствует на мембране клеток, участвующих в иммунном ответе, и конститутивно экспрессируется антигенпрезентирующими клетками, к которым относятся и В-лимфоциты. Молекулы HLA-DR участвуют в представлении генетически чужеродных антигенов (патогены) или аберрантно экспрессированных аутоантигенов (опухолевые клетки) клеткам-эффекторам иммунной системы. Количественное содержание клеток HLA-DR+ определяет степень участия клеток в защитных реакциях [24].
Эллиниди В.Н. с соавт. (2017), обобщив данные гистологического и гистероскопических исследований, предложили выделять две клинико-морфологические формы ХЭ: полипоидный (ХПЭ) и лимфофолликулярный (ЛФЭ) [11].
Сегодня под диагнозом ХЭ подразумеваются различные состояния [25]. Диагностика ХЭ только по наличию экспрессии молекулы синдеканa-1 (Sdc-1)
CD138, выявляемой при иммуногистохимическом исследовании в отсутствии доказательства экспрессии этой молекулы плазматическими клетками не корректна [26], так как CD138 экспрессируют клетки эпителия и пре-В-клетки [27], что может являться причиной гипердиагностики, необоснованного и неэффективного эмпирического лечения. Плазматические клетки в норме представлены в эндометрии, идентификация определяется фенотипом CD38+CD138+.
Цель работы: изучить особенности иммунного ответа при ХЭ у женщин с нарушением имплантации.
Материалы и методы
При обследовании женщин, обратившихся по поводу бесплодия и невынашивания беременности в ФГБУ «Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова» МЧС России и клинику акушерства и гинекологии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. И.П. Павлова» Минздрава России (Санкт-Петербург) выделена клиническая группа пациенток с наличием в эндометрии классических гистологических признаков ХЭ [10, 28].
Исследование было одобрено Локальным этическим комитетом ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова.
В основную группу включено 59 женщин репродуктивного возраста с ХЭ. В зависимости от наличия лимфоидных инфильтратов-фолликулов в межгландулярной и периваскулярной зонах в функциональном слое эндометрия, состоящих из В-клеток, или микрополипоидных (в виде ворсинок, микрососочков) изменений ЛЭ и с диффузным расположением В-клеток, основная группа была разделена на 2 клинические группы. В 1-ю группу вошли 26 женщин с ХПЭ в возрасте 30 (18–39) лет, во 2-ю группу – 33 женщины с ЛФЭ в возрасте 30 (20–43) лет. Критериями исключения были: миома матки более 35 мм, выраженный аденомиоз, антифосфолипидный синдром, наличие инфекционных и тяжелых соматических заболеваний.
Группа контроля составила 48 соматически здоровых фертильных женщин, обследованных ранее при раздельном изучении локального и системного иммунитетов. Критериями включения в контрольную группу было рождение одного и более ребенка. В этой группе у 30 пациенток были детально исследованы параметры местного иммунитета и у 18 женщин – показатели системного иммунитета.
Средний возраст пациенток контрольной группы составил 29 (18–40) лет. Критериями включения были: отсутствие гинекологической и соматической патологии, острых и хронических воспалительных заболеваний.
Получение материала эндометрия выполнялось в фолликулярную фазу менструального цикла.
Использовали стандартное гистологическое исследование операционного материала с окраской гематоксилином и эозином. Для биоптатов эндометрия применялся иммуногистохимический метод с определением лимфоцитов, несущих маркеры HLA-DR+ и CD20+. Результаты иммуногистохимической реакции в контрольной и исследуемой группах оценивали при положительной экспрессии исследуемых маркеров (CD20, HLA-DR) путем прямого подсчета иммунокомпетентных клеток в строме эндометрия под микроскопом Leica DM2000 при увеличении микроскопа ×400 (окуляр 10, объектив 40), что составило стандартный размер диаметра поля зрения для всех образцов, который равен был 250 мкм. Результаты отражены с указанием маркеров CD20 и HLA-DR в таблице 1.
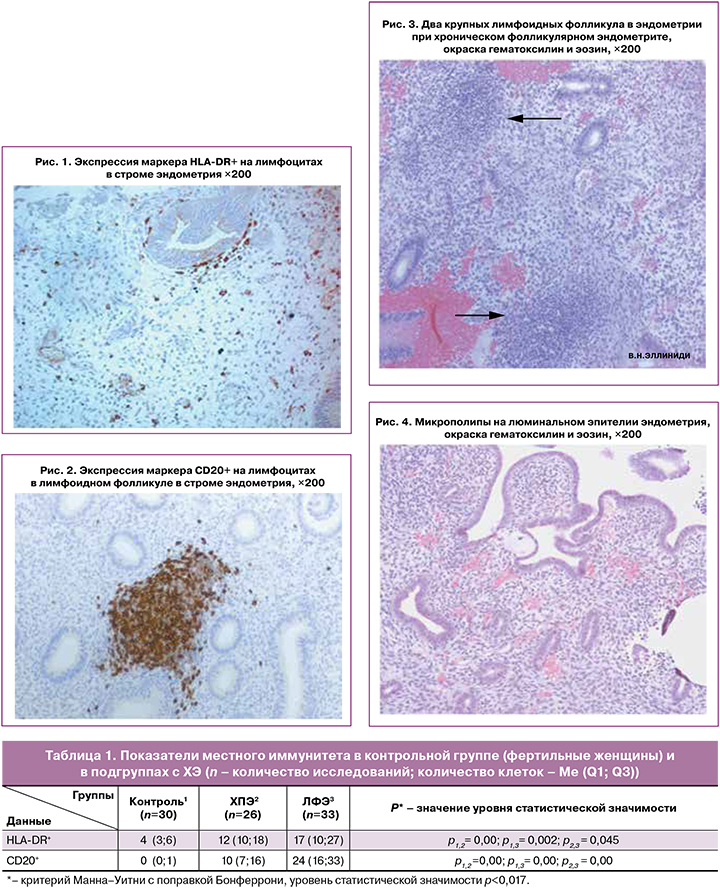
Экспрессия маркеров HLA-DR+ и CD20+ на лимфоцитах (коричневое окрашивание мембран диаминобензидином), лимфоидные скоплениях в функциональном слое и микрополипы эпителия эндометрия представлены на рисунках 1–4.
У всех пациенток выполнены иммунологические исследования, включавшие методы проточной цитометрии, ДНК-проточной цитометрии по методике, описанной Дмитриевой И.Б. с соавт. (2004) [29], иммуноферментного анализа (ИФА). Данные представлены в таблицах 2–4. Для визуализации субпопуляций лимфоцитов использовали моноклональные антитела: HLADR-FITC, CD4-PE, CD3-ECD, CD56-PC5.5, CD16-PE, CD25-PC7, CD8-APC, CD95-APC, CD19-APC-AF700, CD45-APC-AF750. Пробы анализировали на проточном цитофлюориметре Navios в многоцветном протоколе (прибор и реактивы Beckman Coulter). Популяцию лимфоцитов оценивали, как CD45+bright SSdim клетки. Анализ образцов проводился при наборе 5000 событий в лимфоцитарном регионе.
Уровни цитокинов интерлейкин (IL)-2, IL-4, IL-6, фактор некроза опухоли (TNF-α), интерферон (INF)-γ, INF-α в культуральных средах (спонтанная, индуцированная продукция; для стимуляции продукции IL-2, IL-4, INF-γ использовали ФГА, для IL-6, TNF-α – пирогенал, для INF-α – вирус болезни Ньюкасл) и в сыворотке определяли с использованием наборов реагентов для ИФА (производитель АО «Вектор-Бест», Россия, Новосибирск). Содержание в сыворотке IgA, M, G определяли турбодиметрическим методом, sIgA – методом ИФА с использованием тест-систем (производитель АО «Вектор-Бест»). Антиэндометриальные антитела (АЭА) в сыворотке определяли методом ИФА с использованием тест-систем производства лаборатории биотехнологии ЦНИРРИ по авторской методике (патент РФ N2303267). Цитотоксическую активность NK-клеток (NKA%) определяли методом ДНК-проточной цитометрии (табл. 2). При исследовании учитывали различное содержание ДНК в NK-клетках и в клетках-мишенях. В качестве клеток-мишеней использовали эритромиелобластоидную линию К-562, полученную из банка НИИ цитологии РАН. Модальное число хромосом лимфоцитов 46, а клеток линии К-562 – 64 (согласно паспорту). Лимфоциты крови, выделенные методом центрифугирования в градиенте плотности Фиколл-пак, и клетки линии К-562 смешивали в соотношении 20:1. Одну пробу гетерогенной взвеси клеток обрабатывали раствором тритона, что позволяло бромистому этидию проникнуть в ядро и окрасить нуклеиновые кислоты. Применяли фермент РНК-азу для обеспечения окраски только ДНК. Пробу перемешивали и инкубировали 30 минут при 4+–8+. Другую пробу взвеси инкубировали в течение 4 часов в СО2 инкубаторе, после чего перемешивали, окрашивали и инкубировали 30 минут при 4+–8+. Затем пробы анализировали на проточном цитофлюориметре с использованием ДНК-протокола System II. При оценке ДНК-гистограмм выявляли два клеточных цикла с модальными значениями G1, различающиеся в 1,47 раза, анализ ДНК-проб проводили с использованием программы MultiCycle AV (Phocnix Flow System).
Статистический анализ
Статистическая обработка материала проводилась с использованием программ Stat Soft Statistica v. 7 и Excel 2003. Описательная статистика полученных данных представлена в виде медиан (Me), первой и третьей квартилей (Q1; Q3) с указанием абсолютных значений и процентов. Сравнение межгрупповых различий выполнено с использованием непараметрического критерия Манна–Уитни с поправкой Бонферрони. При использовании поправки Бонферрони для попарного сравнения 3 групп за уровень статистической значимости был взят уровень p<0,017.
Для оценки взаимосвязи переменных использовали корреляционный анализ с использованием коэффициента Спирмена, вычисляли доверительные интервалы коэффициентов корреляции. Пороговым уровнем статистической значимости считали p<0,05.
Результаты и обсуждение
Результаты исследования содержания в эндометрии женщин с ХЭ В-клеток CD20+ и лимфоцитов, экспрессирующих HLA-DR+, представлены в таблице 1.
В сравнении с контрольной группой в группах с ХПЭ и ЛФЭ статистически значимо увеличено количество клеток HLA-DR+. Количество В-лимфоцитов CD20+ в эндометрии в группе с ЛФЭ статистически значимо превышало этот показатель в группе с ХПЭ.
По данным, представленным в таблице 2, абсолютное количество лимфоцитов в группе с ЛФЭ было статистически значимо выше, чем в группе фертильных женщин. В обеих исследуемых группах относительное количество лимфоцитов было выше, чем у здоровых женщин.
По относительному и абсолютному количеству Т-клеток CD3+, по абсолютному количеству Т-хелперов CD3+CD4+, Т-цитотоксических клеток CD3+CD8+, «дубль» позитивных Т-клеток CD4+CD8+, В-клеток CD19+, Т-хелперов CD4+HLADR+ и NK-клеток CD16+ контрольная и группы с ХПЭ и ЛФЭ были сопоставимы. Однако относительное количество лимфоцитов с фенотипом CD3+CD4+ в группе с ХПЭ статистически значимо было больше, чем в группе здоровых женщин.
По данным таблицы 2, в сравнении с контрольной группой в группе с полипоидным эндометритом в крови относительное и абсолютное количество лимфоцитов, экспрессирующих CD25+ – рецептор к ростовому фактору IL-2, было статистически значимо снижено, в группе с лимфофолликулярным эндометритом абсолютное количество лимфоцитов CD25+ было также статистически значимо снижено, а относительное имело тенденцию к снижению. CD25+ является маркером ранней активации, вероятно, при воспалении экспрессирующие CD25+ лимфоциты, элиминируются путем апоптоза. Так, установлена прямая корреляционная связь между относительным и абсолютным количеством лимфоцитов, экспрессирующих CD25+, и увеличенным относительным и абсолютным количеством клеток, экспрессирующих CD95+ в группе ЛФЭ (r=0,752 95% ДИ 0,439–0,902, p=0,0003; r=0,771 95% ДИ 0,47–0,910, p=0,0002; r=0,779 95% ДИ 0,491–0,914, p=0,0001; r=0,814 95% ДИ 0,560–0,928, p=0,00004).
Хронический воспалительный процесс характеризовался статистически значимым увеличением относительного и абсолютного количества лимфоцитов с маркером готовности к апоптозу CD95+ в группах с ХПЭ и ЛФЭ в сравнении с группой фертильных женщин. В группе женщин с ХПЭ установлена прямая корреляция между абсолютным количеством лимфоцитов CD4+ и абсолютным и относительным количеством лимфоцитов CD95+ (r=0,706 ДИ 0,371–0,878, p<0,05; и r=0,666 ДИ 0,304–0,860, p<0,05), также прямая корреляция выявлена между абсолютным количеством лимфоцитов CD3+CD8+ и абсолютным количеством лимфоцитов CD95+ (r=0,518 ДИ 0,030–0,807, p<0,05) и абсолютным количеством лимфоцитов CD3-CD8+и относительным и абсолютным количеством лимфоцитов CD95+ (r=0,610 ДИ 0,215–0,833, p<0,05, и r=0,593 ДИ 0,190–0,825, p<0,05).
В группе женщин с ЛФЭ выявлена прямая корреляция между абсолютным количеством лимфоцитов CD4+ и абсолютным и относительным количеством лимфоцитов, экспрессирующих маркер готовности к апоптозу CD95+ (r=0,475 ДИ 0,01–0,771, p<0,05; и r=0,493 ДИ 0,034–0,780, p<0,05).
Это указывает на готовность к апоптозу специфических клеток – эффекторов, способных реализовать иммунный ответ, в отношении как клеток, «инфицированных» возбудителями, так и клеток эндометрия с измененной антигенной структурой. В обоих случаях иммунный ответ не является адекватным.
Выявлена прямая корреляция между относительным и абсолютным количеством NK-клетками CD56+, лимфоцитов с преимущественно регуляторными функциями, и клетками с маркером готовности к апоптозу CD95+ (r=0,626 95% ДИ 0,224–0,846, p=0,004 и r=0,559 95% ДИ 0,125–0,814, p=0,02). Установлена прямая корреляция между содержанием в сыворотке TNF-α и относительным и абсолютным содержанием CD95+-лимфоцитов в крови (r=0,726 95% ДИ 0,223–0,924, p=0,008 и r=0,695 95% ДИ 0,163–0,914, p=0,02).
При воспалении цитокины влияют на процессы презентации антигена, клональную экспансию и дифференцировку специфических клонов лимфоцитов, продукцию антител. Данные о содержании цитокинов представлены в таблице 3.
В группе с ХПЭ выявлена прямая корреляция между количеством лимфоцитов HLA-DR+ в эндометрии и уровнями спонтанной, индуцированной продукции и содержанием IFN-γ в сыворотке (r=0,561 95% ДИ 0,110–0,820, p=0,02; r=0,587 95% ДИ 0,129–0,839, p=0,02; r=0,636 95% ДИ 0,313–0,827, p=0,0008 соответственно).
Известно, что IFN-γ является стимулятором экспрессии HLA-DR не только классическими антигенпрезентирующими клетками гемопоэтического происхождения, но и нетрадиционными антигенпрезентирующими клетками, к числу которых относятся клетки эпителия легких, желудочно-кишечного тракта, эндометрия и другие [30–35].
В группе ХПЭ установлена прямая корреляция между количеством В-клеток в эндометрии и цитокинами Th-1 типа: спонтанной продукцией (r=0,662 95% ДИ 0,353–0,841, p=0,0003) и содержанием в сыворотке (r=0,633 95% ДИ 0,154–0,871, p=0,015) IFN-γ и спонтанной продукцией TNF-α (r=0,658 95% ДИ 0,220–0,875, p=0,003).
В группе с ЛФЭ уровни спонтанной продукции IL-4, спонтанной продукции и содержания в сыворотке IFN-γ превышали границы популяционной нормы. Выявленные изменения свидетельствуют о возможной презентации, как экзоантигенов, так и антигенов эпителия эндометрия, и переключении иммунного ответа на Th-2 тип (гуморальный).
Содержание АЭА в сыворотке обследованных женщин представлено в таблице 4.
В группе с ЛФЭ количество АЭА было статистически значимо выше, чем в группе фертильных женщин. Уровни иммуноглобулинов A, M, G и sIgA были сопоставимы во всех обследованных группах (данные не приведены).
В группе ЛФЭ выявлена обратная корреляция между количеством лимфоцитов CD20+ в эндометрии, которые, в основном, формировали лимфоидные образования, и относительным, абсолютным количеством лимфоцитов, экспрессирующих маркер готовности к апоптозу CD95+ (r=-0,621 95% ДИ -0,217–-0,843, p=0,006; r=-0,604 95% ДИ -0,206–-0,830, p=0,008), что, возможно, указывает на то, что CD20+-клетки эндометрия при ЛФЭ не подвергаются апоптозу.
В обеих группах с ХЭ установлена прямая корреляция между увеличенным количеством В-клеток эндометрия и антителами к антигенам эндометрия (r=0,484 95% ДИ 0,110–0,738, p=0,014 и r=0,549 95% ДИ 0,110–0,809, p=0,012), что подтверждает аутоиммунный компонент ХЭ. Установленная прямая корреляция между уровнем АЭА и количеством клеток в эндометрии, экспрессирующих HLA-DR, в обеих группах с ХЭ (r=0,616 95% ДИ 0,263–0,824, p=0,002 и r=0,572 95% ДИ 0,159–0,815, p=0,008).
При ХЭ иммунный ответ характеризуется рядом особенностей:
- при ХПЭ локальным ответом на наличие антигена и миграцию иммунокомпетентных клеток являются изменения поверхностного эпителия, которые сопровождаются формированием микрополипов; в функциональном слое стромы эндометрия диффузно накапливаются В-лимфоциты, повышается количество клеток, экспрессирующих маркер активации HLA-DR+. Системные изменения характеризуются снижением цитотоксической активности NK-лимфоцитов, количества лимфоцитов, экспрессирующих CD25+, увеличением количества CD95+-лимфоцитов. Имеет место повышенная спонтанная продукция TNF-α и IL-6;
- при ЛФЭ, мигрировавшие в эндометрий В-клетки, формируют лимфоидные скопления, содержание в эндометрии клеток CD20+ и активированных HLA-DR+-лимфоцитов увеличивается. В периферической крови выявлено снижение клеток-эффекторов CD3-CD8+ и CD16+CD56+, лимфоцитов, экспрессирующих CD25+, низкая цитотоксическая активность NK-клеток, увеличение количества активированных HLA-DR+- и CD95+-клеток.
Хронический воспалительный процесс в эндометрии характеризуется повышенной спонтанной продукцией провоспалительных цитокинов IL-2, IFN-γ, TNF-α, и повышенными уровнями IL-4, IL-6 – цитокинов, участвующих в пролиферации и дифференцировке β-клеток.
В сыворотке увеличено содержание антител к антигенам эндометрия. Особенность ЛФЭ – аутоиммунный характер воспаления.
Заключение
Хронический воспалительный процесс в эндометрии способствует морфологическим изменениям эндометрия в виде микрополипов люминального слоя эпителия или формированием лимфоидных скоплений в функциональном слое эндометрия, изменяет микроокружение бластоцисты и приводит к нарушению имплантации и репродуктивным потерям.
Выявленные иммунологические и иммуногистохимические параметры ЛФЭ позволяют предположить аутоиммунный характер воспаления в эндометрии.



