Известно, что 60–70% ГПЭ могут быть обусловлены длительной монотонной эстрогенной стимуляцией при отсутствии антипролиферативного действия прогестерона и низком половом стероиде, связывающем глобулин (свободные эстрогены). В репродуктивном и перименопаузальном возрасте эти процессы могут быть вызваны ановуляторными циклами, а также нарушением жирового и углеводного обмена. Но у 30–40% пациенток пери- и постменопаузального возраста ГПЭ могут возникать в условиях нормального для них гормонального фона (подавление процессов апоптоза, нарушение рецепторного аппарата эндометрия по отношению к факторам роста). Важно отметить, что в значении риска развития ГПЭ в настоящее время выделяют также такой показатель, как отсутствие родов в анамнезе в совокупности с отсутствием указаний на использование гормональной контрацепции в течение 12 и более месяцев.
Патогенез гиперпластических процессов эндометрия нельзя рассматривать как последовательное увеличение степени тяжести пролиферативных, структурных и клеточных изменений. Степень тяжести зависит от клеточной атипии, что и определяет неоднородность патогенеза и клинического течения ГПЭ и их предраковых форм. Современная классификация ГПЭ основана на морфологическом принципе и выполняется при гистологической оценке полного соскоба эндометрия (табл.).

Необходимо отметить, что частота расхождения морфологического диагноза очень высока и может достигать 82,1–93,2%. Указанные причины нередко требуют пересмотра гистологических препаратов в онкологических центрах. Все виды атипической ГПЭ считаются предраком эндометрия с риском дальнейшей малигнизации от 10 до 40%.
К основным факторам риска атипичной ГПЭ относятся:
- ожирение (преимущественно висцеральное);
- нарушения менструального цикла (в течение 12 и более лет);
- синдром поликистозных яичников;
- инсулинонезависимый сахарный диабет;
- отсутствие родов в анамнезе в совокупности с отсутствием указаний на использование комбинированных гормональных контрацептивов в течение хотя бы 12 или более мес.
Показаниями к диагностике ГПЭ являются любые нарушения менструального цикла от аменореи до аномальных маточных кровотечений (АМК). На сегодняшний день ультразвуковое исследование (УЗИ) представляет собой достаточно специфичный метод диагностики, который в среднем в 94% случаев позволяет исключить патологию.
Выделяют основные УЗИ-критерии ГПЭ:
- увеличение толщины эндометрия (передне-заднего размена) М-эхо;
- толщина эндометрия >16 мм в конце условной 2-й фазы;
- толщина эндометрия >9 мм на 5–8-й день от начала кровотечения;
- выявление кистозно-расширенных желез, анэхогенных фокусов диаметром 0,5–1,5 мм.
Необходимо также отметить, что попытки установления морфотипа ГПЭ по УЗИ не имеют клинического значения, т.к. не отменяют необходимости раздельного диагностического выскабливания (РДВ).
Основные показания к проведению РДВ:
- АМК;
- УЗИ-критерии ГПЭ при других нарушениях менструального цикла;
- нарушения менструального цикла у больных группы высокого риска развития атипической гиперплазии и рака эндометрия.
Проведение РДВ ограничено следующими показаниями:
- подростковый возраст (кроме витальных показаний и рецидивирующих АМК, не поддающихся гормональной коррекции);
- первый эпизод нарушений менструального цикла у женщины в возрасте до 40 лет, не входящей в группу высокого риска по атипической гиперплазии и раку эндометрия;
- наличие в недавнем (3–4 мес.) анамнезе РДВ с гистологическим заключением и отсутствием проведения гормональной противорецидивной терапии в анамнезе (кроме случаев атипической гиперплазии).
Абсолютным противопоказанием к проведению РДВ являются воспалительные заболевания гениталий.
В зависимости от тактики ведения пациентки лечение ГПЭ может включать в себя:
- оперативное лечение;
- удаление патологически измененной ткани слизистой тела матки;
- консервативную гормональную терапию.
Консервативное лечение является необходимой составляющей профилактики рецидивирования и представлено следующими группами гормональных препаратов:
- прогестины (прогестагены);
- гормональные контрацептивы (ГК);
- агонисты гонадотропин-рилизинг гормона (ГнРГ).
Прогестины могут использоваться при любых формах гиперпластических процессов эндометрия от простой гиперплазии без атипии до атипической ГПЭ. Дальнейшее морфологическое заключение позволяет модифицировать выбор прогестагена и режим его введения. К основным эффектам прогестинов, позволяющим достичь терапевтической и профилактической целей, относятся подавление овуляции и секреторная трансформация эндометрия. ГК являются препаратами выбора у пациентки репродуктивного возраста, нуждающейся в контрацепции. Пролонгированное применение ГК позволяет снизить частоту рецидивирования до 7%.
Среди агонистов ГнРГ одним из наиболее широко применяемых препаратов является Диферелин. Проведенные нами в течении последних лет клинические исследования Диферелина показали высокую эффективность этого препарата при его адекватном назначении. Особенно важно его применение при сочетанных гинекологических патологиях: миома матки, эндометриоз и ГПЭ. Это обусловлено тем, что во многом лечение миомы матки, эндометриоза и ГПЭ осуществляется фактически с использованием одних и тех же лечебных подходов. Диферелин применяется также в послеоперационном противорецидивном лечении этих заболеваний. Во многом это обусловлено тем, что Диферелин снижает высвобождение промитогенных цитокинов интерлейкина-1β и VEGF (сосудистого эндотелиального фактора роста), мидкайна и тем самым обеспечивает ингибирование пролиферации и неоангиогенеза.
При этом при применении Диферелина отсутствуют прогестагенные и андрогенные побочные эффекты, негативный эффект в отношении липидного профиля. Препарат может применяться при сопутствующих заболеваниях: фиброзно-кистозной мастопатии, гиперкоагуляции, поликистозном овариальном синдроме, дислипидемиях. Диферелин значительно лучше переносится, чем антигонадотропины, что способствует адекватному комплаенсу, и на современном этапе олицетворяет патогенетическую терапию доброкачественных ГПЭ и эндометриоза всех локализаций.
На сегодняшний день единственным 100% безрецидивным методом лечения атипической ГПЭ является гистерэктомия. Однако прямые последствия в виде раннего прекращения функции яичников и формирования у женщины метаболических нарушений определяют строгий перечень показаний, при наличии которых необходимо сделать выбор в пользу гистерэктомии:
- невозможность гормональной терапии;
- неэффективность терапевтического лечения;
- потенциальный риск рецидивов;
- риск злокачественной трансформации превышает потенциальный вред операции для здоровья у женщин с низкой фертильностью.
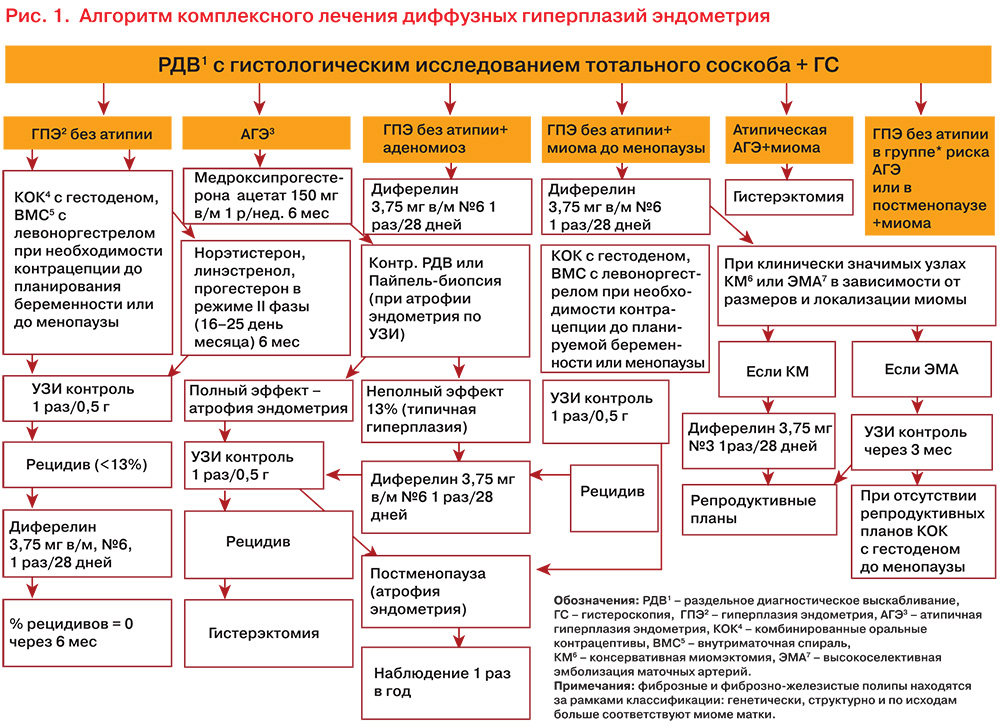
В связи с тем, что при сочетанных доброкачественных ГПЭ онкологическую суспициозность (малигнизация атипической гиперплазии эндометрия составляет 10–40%) представляет именно гиперплазия эндометрия, автором был разработан алгоритм ведения таких пациенток, основанный прежде всего на объективной оценке типа гиперпластического процесса эндометрия. В вопросе онкопрофилактики такие параметры, как количество, локализация и объем узлов миомы и очагов аденомиоза не актуальны. Они касаются лишь чисто технических вопросов сохранения матки и репродуктивной функции, многократно представлены и хорошо известны, но принципиально также обозначены в этой схеме (рис. 1). Профилактика рецидивов ГПЭ комбинированными оральными контрацептивами (КОК) при отсутствии клеточной атипии по данным морфологического исследования эффективна у не курящих женщин до 45 лет. Безусловно, главным протективным механизмом КОК является подавление овуляции и фолликулогенеза, т.е. ежемесячных циклических процессов в эндометрии и миометрии. Однако не только выключение циклических процессов обусловливает представленные эффекты КОК. Немаловажное значение имеет также вид прогестина, входящего в состав применяющихся препаратов. Это связано с тем, что подавляющее количество КОК с изученными не контрацептивными лечебными эффектами в качестве эстрогенного компонента, обеспечивающего стабилизацию и имитирование цикла, содержат в своем составе этинилэстрадиол (ЕЕ). Такое влияние ЕЕ обусловлено не только его высокой биодоступностью, но и невозможностью из-за наличия этинильной группы трансформироваться в организме женщины в эстрадиол, эстрон, эстрон-сульфат и вновь в эстрадиол с его пролиферативными воздействиями на ткани-мишени.
Эффективность прогестагенов в составе КОК определяется по следующим параметрам: способности блокировать овуляцию, связывать рецепторы прогестерона, вызывать гистологические изменения в тканях матки и задержку менструации. Прогестагены наряду с гестагенным влиянием обладают и другими биологическими эффектами. Особое место среди гестагенов, входящих в состав КОК, занимают прогестагены 3-го поколения. Среди прогестагенов 3-го поколения имеются различия, но они не столь существенны. Основное различие – это расположение отдельных восстановительных боковых цепочек основной молекулы стероида. Гестоден, входящий в состав микродозированного КОК Линдинет-30 – один из тщательно изученных прогестагенов 3-го поколения. Этот прогестаген с высокой прогестагенной активностью при пероральном введении обладает также и высокой селективностью. Двойная связь в положении С15 у гестодена увеличивает его связывающую способность с рецепторами прогестерона по сравнению с рецепторами тестостерона. Поступая в кровь, а затем к органам и тканям женского организма, стероиды связываются с рецепторами к прогестерону, тестостерону, эстрогену, минералокортикоидам и т.д. и оказывают свое биологическое действие. Выраженность того или иного действия обусловлена различным сродством прогестагенов к рецепторам соответствующего стероида. Как гестоден, так и дезогестрел более селективны в отношении рецепторов прогестерона и обладают меньшим антиэстрогенным действием по сравнению с левоноргестрелом. По сравнению с другими гестагенами (дезогестрел, норгестимат) гестоден наиболее активен. Он не метаболизируется при первичном прохождении через печень, обладает 100% биодоступностью и по своим эффектам наиболее близок к естественному прогестерону. Иными словами, весь принимаемый гестоден поступает в системный кровоток, что позволяет избежать как недостатка, так и превышения оптимальной дозировки и соответственно устранить зависимость действующей концентрации гестагена от скорости обменных процессов, которая определяется целым рядом факторов (особенностями питания, временем суток, психоэмоциональным состоянием и др.). Как и левоноргестрел, прогестагены 3-го поколения входят в группу прогестагенов под названием «гонаны» – производных 19-нортестостерона, обладающих остаточной андрогеничностью. Гестоден обладает большей способностью связываться с рецепторами прогестерона (следовательно, и подавлять овуляцию) по сравнению с левоноргестрелом, хотя различия между этими двумя прогестагенами в отношении способности контактировать с глобулином, связывающим половые стероиды, а следовательно, и в степени андрогеничности, не столь уж и велики. Гестоден обладает не только большей прогестагенной активностью по сравнению с левоноргестрелом, но и является существенно менее андрогеничным. Это подтверждается анализом изменений уровней HDL-фракции холестерина и соотношением HDL/LDL в многочисленных исследованиях, посвященных КОК, содержащим гестоден.
Отношение между процентом связывания прогестагенов с прогестероновыми рецепторами и уровнем их связывания с рецепторами андрогенов называется индексом селективности. Некоторые исследования прогестероновых рецепторов in vitro как на человеке, так и на мышах показали, что связывание норэтинодрона и левоноргестрела (прогестагенов 1-го и 2-го поколений) на 80 и 40% ниже, чем гестодена. А связывание гестодена с андрогенными рецепторами ниже, чем у левоноргестрела (прогестагена 2-го поколения). Итак, гестоден обладает выраженным гестагенным действием, чуть меньшим антиэстрогенным действием, практически не оказывает андрогенного эффекта и не найден его эстрогенный эффект. В последнее время в литературе появились публикации о положительном влиянии на течение различных гинекологических заболеваний (в частности миома матки, ГПЭ, эндометриоз) КОК с продленным циклом приема препаратов.
Целью обычной схемы приема КОК служит моделирование естественных циклов путем индукции периодических кровотечений отмены, которых можно избежать, пропуская интервалы отмены гормонов, продолжающиеся 7 дней. Поэтому применение схем с продленным циклом, предусматривающих прием КОК в течение 3 мес. с последующим интервалом отмены гормонов продолжительностью 7 дней, позволяет уменьшить частоту развития менструаций и жалоб, связанных с менструальным циклом. Отсрочка кровотечения отмены может снизить или устранить клинические проявления, связанные с менструацией, например, гиперменорею и дисменорею, и оказывает благоприятное влияние на фоне рассматриваемых гинекологических заболеваний. Непрерывный прием КОК сопровождается более выраженной супрессией гипоталамо-гипофизарной системы (подавляет выработку гонадотропных гормонов), предотвращает циклические колебания уровня стероидов в сыворотке крови. Было предположено, что применение КОК может маскировать наличие миомы матки, уменьшая выраженность их клинических проявлений, например, меноррагии. При миоме матки лечение КОК не оказывает статистически значимого влияния на размер или объем полости матки, но снижает продолжительность менструальных кровотечений и повышает показатель гематокрита. При пролонгированном применении КОК Линдинет-30 частота рецидивов типичных гиперплазий эндометрия после РДВ у относительно молодых (до 45 лет) не курящих женщин не превышает 7%. При этом наблюдается преждевременная секреторная и децидуоподобная трансформация эндометрия, угнетение спиральных артерий при уменьшении гиперандрогении, снижении менструально-подобной кровопотери, симптомов дисменореи.
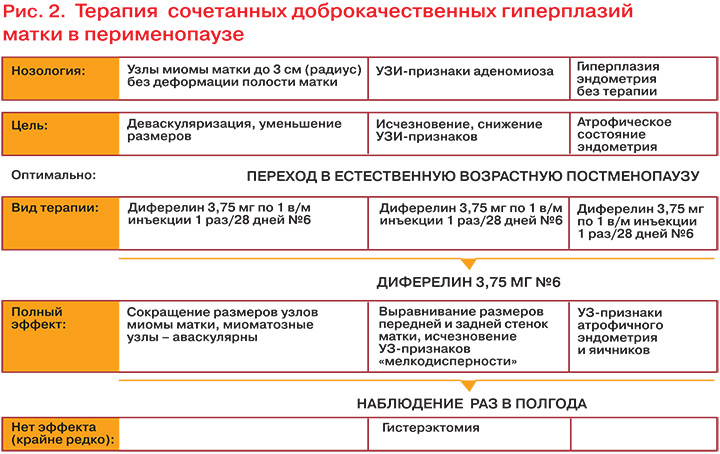
В зависимости от планов женщины Линдинет-30 можно применять либо до планируемой беременности, либо для профилактики и контрацепции вплоть до менопаузы, учитывая его положительный не контрацептивный эффект на различные системы организма. Когда репродуктивные планы женщины объективно завершаются в связи с достижением возраста перименопаузы, алгоритм ведения сочетанных доброкачественных гиперплазий матки может выглядеть в упрощенном виде (рис. 2).
Профилактический, даже, можно сказать, «наступательный» потенциал КОК определяется, в частности, тропностью к эндометрию гестагена, входящего в его состав. Поэтому после базовой терапии Диферелином ГК могут успешно применяться в профилактике рецидива ГПЭ при отсутствии клеточной атипии у женщин, не планирующих беременность в ближайшей перспективе, при отсутствии стандартных для КОК противопоказаний.
Несмотря на появление новых направлений в ведении больных с ГПЭ, вопросы лечения данной патологии остаются одними из наиболее актуальных вопросов гинекологии и еще далеки от окончательного решения. Это обусловлено прежде всего сложным и неоднородным пато- и морфогенезом заболевания и индивидуальной чувствительностью организма к различным лечебным воздействиям.



