Злокачественные заболевания системы крови (ЗЗСК) – это большая группа патологий системы кроветворения. В Российской Федерации в 2017 г. число заболевших каким-либо онкологическим заболеванием детей составило 88,1:100 000 человек [1, 2]. При этом, по данным мировой статистики, у девочек в возрасте от 0 до 14 лет до 40% онкопатологии приходится на острые лейкозы [3]. У женщин 15–44 лет данный показатель существенно ниже и составляет около 17% [4]. В общей возрастной группе выделяют следующие виды злокачественных состояний кроветворения: болезни вследствие повреждения лимфоидного (лимфомы, острый лимфобластный лейкоз (ОЛЛ), хронический лимфоцитарный лейкоз, множественная миелома) и миелоидного (острый миелоидный лейкоз (ОМЛ), миелодиспластические синдромы, хронические миелопролиферативные заболевания) ростков кроветворения. Схожим по клиническим проявлениям с лимфомой является лангергансоклеточный гистиоцитоз – группа патологий, ранее называемая гистиоцитозом X, в основе которой лежит иммунопатологический процесс, вызывающий пролиферацию макрофагов. Детский и подростковый возраст является фактором риска развития гистиоцитоза ввиду высокой вероятности наследственной предрасположенности. Особое место среди заболеваний крови занимают апластические анемии, при которых очевидно отсутствие злокачественности течения, но возникают риски осложнений на фоне проводимого специфического лечения, аналогичные таковым при ЗЗСК. Современные достижения в лечении онкогематологической патологии позволили обеспечить высокую выживаемость пациентов с ЗЗСК и схожими состояниями, что связано с широким применением трансплантации гемопоэтических стволовых клеток от аллогенного донора (алло-ТГСК) [5–7]. Однако данный вид лечения имеет высокие риски осложнений, которые затрагивают, в том числе, органы репродуктивной системы [8]. Таким образом, можно заключить, что гинеколог, оказывающий помощь детям, должен быть информирован об особенностях работы с данной группой пациенток. В то же время четко сформулированных клинических рекомендаций для гинекологов по работе с данной категорией пациентов не существует [9].
Около 80% пациенток с ЗЗСК находятся в группе повышенного риска по нарушению репродуктивной системы после алло-ТГСК, которая включает лучевую или полихимиотерапию (ПХТ), обладающие гонадотоксичностью [5, 8, 10–13]. По этой причине большое внимание в ведении девочек с ЗЗСК уделяется области гонадопротекции, необходимость в которой возникает у всех пациенток после наступления менархе. Ее методы и способы хорошо изучены, внесены в протоколы и, как правило, назначаются врачами-онкогематологами самостоятельно [10]. В настоящее время основными способами гонадопротекции признаны агонисты гонадотропин-рилизинг-гормона и методы криоконсервации яичниковой ткани и ооцитов. Степени риска повреждающего воздействия на яичниковую ткань зависят от возраста пациентки, а также от стадии полового развития на момент проведения специфического лечения [3, 8, 13]. В допубертатном периоде овариальная недостаточность приводит к нарушению полового развития (задержке или отсутствию полового созревания), а в постпубертатном – к первичной, реже вторичной или сочетанной яичниковой недостаточности [3]. Чем старше пациент на момент начала терапии, тем выше риск развития преждевременной недостаточности функции яичников (ПНЯ) [3]. При проведении ПХТ повреждаются те клетки яичниковой ткани, которые находятся в фазе активного роста и деления – преантральные и антральные фолликулы [14]. Считается, что воздействие на примордиальные, так называемые «спящие фолликулы», сказывается в меньшей степени, что может обуславливать восстановление менструального цикла у пациенток более раннего возраста, у которых ПХТ и алло-ТГСК были проведены до периода менархе [3].
Еще одним важным аспектом в работе с пациентами с ЗЗСК является проблема маточных кровотечений. В первую очередь речь идет о пациентках, которым планируется алло-ТГСК. Маточное кровотечение, возникающее вследствие развивающейся тромбоцитопении, коагулопатии и дискоординации гипоталамо-гипофизарно-яичниковой оси, приводит к усугублению тяжести состояния пациентки, часто требует массивных гемотрансфузий, что влечет осложнения в виде аллоиммунизации, вторичного генерализованного инфекционного процесса, аллергических реакций, а также нарушений в системе «сердце–легкие» [9, 15, 16]. Медикаментозная супрессия менструаций может проводиться агонистами гонадотропин-рилизинг-гормона, комбинированными оральными контрацептивами (КОК), чисто прогестиновыми контрацептивами [9, 17]. К отдельному виду терапии относятся внутриматочные гормональные системы [9, 17]. Каждый метод лечения имеет свои потенциальные преимущества и риски. Наиболее часто применяются агонисты гонадотропин-рилизинг-гормона [9]. По данным литературы, минимальное количество срочных консультаций гинеколога по поводу маточных кровотечений в период лечения онкогематологических заболеваний требуется именно на этом виде терапии [18]. Преимуществами агонистов гонадотропин-рилизинг-гормона являются возможность парентерального введения препарата (внутримышечно, подкожно и/или интраназально), а также режим введения 1 раз в месяц или в 3 месяца [10]. Механизм действия заключается в связывании препарата с соответствующими рецепторами в передней доле аденогипофиза с последующей стимуляцией, а затем и супрессией продукции гонадотропинов. В связи с этим через 2–4 недели после первого введения препарата на фоне первичного стимулирующего влияния возникает пик ЛГ и ФСГ, что приводит к эпизоду маточного кровотечения [10]. Это обстоятельство важно учитывать, и введение агониста следует проводить за 2 недели до предполагаемого начала специфического лечения, чтобы избежать маточного кровотечения в момент максимальной уязвимости пациента [10].
Другим широко используемым способом менструальной супрессии является прием КОК. Впервые использование КОК с этой целью у пациенток после менархе при подготовке к алло-ТГСК было предложено ассоциацией онкологов Pediatric Blood and Marrow Transplant Consortium (PBMTC) в 2002 г. [19]. Особенность метода состоит в непрерывном, длительном и ежедневном приеме КОК или чисто прогестиновых контрацептивов в период лечения онкогематологического заболевания. Однако обычно ПХТ, проводимая в период алло-ТГСК, провоцирует такие побочные эффекты, как рвота или диарея, что изменяет всасывание пероральных средств и нарушает постоянство концентрации лекарственного препарата в крови. Результатом становится прорывное маточное кровотечение, опасное для пациента в период панцитопении. Также длительный прием КОК или чисто прогестиновых контрацептивов может привести к токсическому поражению печени и развитию тромбофилических осложнений [10, 20].
Клиническое наблюдение №1
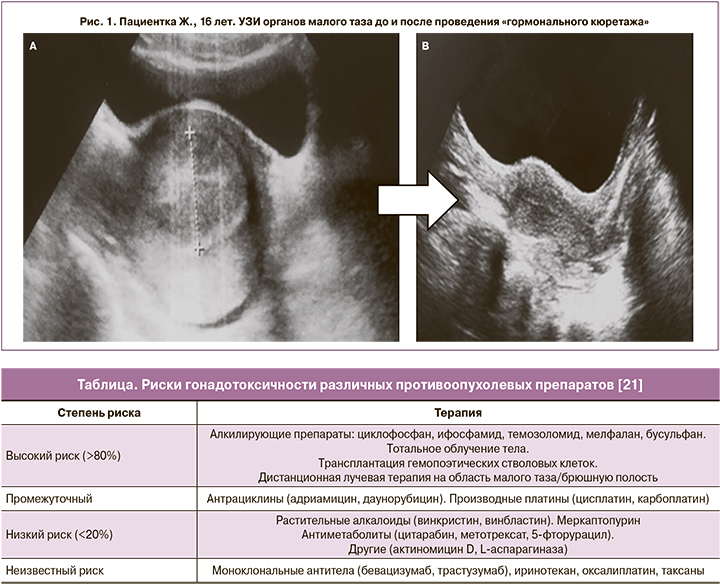
Пациентка Ж., 16 лет, с приобретенной идиопатической апластической анемией, сверхтяжелой формой, пароксизмальной ночной гемоглобинурией. До заболевания менструации регулярные, с 13 лет. В связи с тяжестью состояния больной до начала ПХТ и алло-ТГСК не проводилась супрессия менструальной функции, и в период панцитопении у девочки развилось маточное кровотечение, потребовавшее инициации гормонального гемостаза низкодозированным КОК в стартовой дозе 3 таблетки в сутки. Попытки снизить дозу препарата приводили к рецидивам кровотечения, сильным приступообразным болям внизу живота, в результате чего длительность применения такой ежедневной дозы составила 60 дней. Отмечено повышение уровня АЛТ – до 141 Е/л, АСТ – до 44 Е/л. По данным ультрасонографии малого таза выявлены признаки выраженной гиперплазии эндометрия, гематометры: тело матки шаровидной формы, 7,1×6,4×4,8 см, полость матки расширена до 2,8 см, содержимое гиперэхогенное, неоднородное (рис. 1А). Условия для снижения дозы препарата и проведения «гормонального кюретажа» возникли только после достижения приживления трансплантата при уровне гемоглобина 87 г/л. После отмены препарата последовало умеренное кровотечение, сопровождавшееся выделением «старых» свертков крови. По результатам ультразвукового исследования (УЗИ) полость матки сократилась, приобрела щелевидный вид (рис. 1B).
Согласно рекомендациями ВОЗ от 2015 г., использование внутриматочной спирали (ВМС) с левоноргестрелом («Мирена») признано возможным методом выбора при тяжелых маточных кровотечениях у пациентов, в том числе подросткового возраста [21]. Накоплен положительный опыт использования ВМС у женщин репродуктивного возраста [9]. Однако недостаточно данных о применении данного метода у подростков.
При некоторых видах онкогематологических заболеваний влияние лечения на яичниковую ткань минимально. Сюда можно отнести хронические миелопролиферативные заболевания, при которых применяют ингибиторы тирозинкиназ, с минимальным гонадодеструктивным действием [22]. При некоторых вариантах лимфом, наряду с ПХТ, используют краниальную лучевую терапию, опасную повреждением гипоталамо-гипофизарных структур [5, 23]. При абдоминальном облучении степень повреждения овариальной ткани зависит напрямую от его дозы [5, 12]. Известно, что при облучении пахово-подвздошных областей в дозе 4–5 Гр стойкая гипергонадотропная аменорея развивается у 40% пациенток в возрасте до 20 лет. Существует понятие об «эффективной стерилизующей дозе» лучевой терапии, которая, как установлено, уменьшается по мере взросления девочки: при рождении – 20,3 Гр, в 10 лет ‒ 18,4 Гр, в 20 лет ‒ 16,5 Гр, в 30 лет ‒ 14,3 Гр [14]. Лучевая терапия также может оказывать повреждающее действие на тело матки вследствие склероза сосудистой сети мио- и эндометрия. Происходит уменьшение размеров матки, и снижается эластичность стенок; повреждается железистый и стромальный компонент эндометрия, разрушаются стволовые клетки его базального слоя [14].
Предполагают, что повреждающее действие алкилирующих агентов при проведении ПХТ на яичниковую ткань может реализоваться двумя путями. Первый – это сосудистый путь вследствие повреждения сосудов тканей яичника с формированием фиброза кортикального слоя, снижением продукции эндотелиального фактора роста и уменьшением микрососудистой сети. Все это приводит к гибели фолликулярного аппарата. Второй механизм – это феномен «выгорания». Считается, что может происходить преждевременная активация примордиальных фолликулов через фосфатидилинозитол-3-киназный сигнальный путь, что приводит к истощению пула фолликулов [14]. Аменорея, индуцированная ПХТ, может быть транзиторной. Приблизительно у 40% пациентов менструации могут самостоятельно восстановиться через несколько месяцев после завершения терапии ЗЗСК [20]. Риски гонадотоксичности различных групп препаратов отражены в таблице.
В 6% случаев нарушение функции яичников может наступать сразу после специфического онкологического лечения [22]. В подавляющем же большинстве случаев нарушение функции яичников наступает спустя некоторое время с формированием ПНЯ [3, 22]. Большинство подростков с ПНЯ относятся к группе пациентов-кандидатов на проведение долгосрочной менопаузальной гормональной терапии, необходимой для снижения последствий тяжелого дефицита эстрогенов в виде остеопенического синдрома и ранних проявлений ишемической болезни сердца [23]. По данным мировой литературы, не выявлена патологическая взаимосвязь между менопаузальной гормональной терапией и рисками рецидива онкогематологических заболеваний [5, 20].

Помимо задач гонадопротекции и коррекции ПНЯ, гинеколог может играть важную роль в первичной диагностике ЗЗСК. Так, описаны клинические случаи выявления первичной неходжкинской лимфомы с локализацией очага на вульве [24]. При ведении больных с ЗЗСК гинеколог является участником консилиума в диагностике рецидива основного заболевания. Речь идет о возможной генитальной локализации экстрамедуллярных рецидивов. При экстрамедуллярном рецидиве ОЛЛ и ОМЛ наиболее часто наблюдается поражение центральной нервной системы и гонад как у мужчин (особенно при ОЛЛ), так и у женщин [25, 26]. По данным аутопсии пациенток, погибших от ОЛЛ, в 35–50% случаев наблюдается опухолевая инфильтрация яичников на поздних стадиях заболевания [26]. Гораздо реже встречается клиническая ситуация первичного очага опухолевого процесса в яичниках. Период между первичным выявлением ЗЗСК и экстрамедуллярным рецидивом в яичниках может превышать 53 месяца [26].
Клиническое наблюдение №2
 Пациентка П., 12 лет, с диагнозом: ОЛЛ, пре-пре-В иммунологический вариант, с коэкспрессией миелоидных маркеров CD13+, CD33+low; первая клинико-гематологическая ремиссия; поздний изолированный костномозговой рецидив, химиорезистентное течение; вторая клинико-гематологическая ремиссия, гаплоидентичная трансплантация костного мозга (донор – отец). Пациентка осмотрена гинекологом в порядке профилактического протокола наблюдения. При осмотре установлено, что 2 месяца назад у девочки наступило менархе, и за период наблюдения прошло две самостоятельные менструации. Клинико-лабораторных признаков рецидива заболевания на момент консультации не было. При ректоабдоминальном исследовании в правой половине малого таза на уровне внутреннего зева шейки матки выявлен каменистой плотности узкий инфильтрат без четких контуров, распространявшийся вдоль стенки таза кверху. Пальпируемая часть инфильтрата составляла 4,0×3,0×2,0 см. Проведено УЗИ, затем магнитно-резонансная томография малого таза, по результатам которых выявлено опухолевое образование в области правых придатков матки размерами 6,4×3,2×4,0 см, а также уретерогидронефроз справа. Уровень СА-125 – 52,9 ЕД/мл, ФСГ – 24,2 МЕ/л, ЛГ – 9,8 МЕ/л. Заподозрен экстрамедуллярный рецидив в яичнике. Выполнена диагностическая лапароскопия: выявлены двусторонние мягковатые, крошащиеся опухолевые инфильтраты в обоих яичниках (рис. 3). По результатам цитологического исследования клетки асцитической жидкости – многочисленные лимфоидные элементы, преимущественно незрелые, с наличием бластных форм.
Пациентка П., 12 лет, с диагнозом: ОЛЛ, пре-пре-В иммунологический вариант, с коэкспрессией миелоидных маркеров CD13+, CD33+low; первая клинико-гематологическая ремиссия; поздний изолированный костномозговой рецидив, химиорезистентное течение; вторая клинико-гематологическая ремиссия, гаплоидентичная трансплантация костного мозга (донор – отец). Пациентка осмотрена гинекологом в порядке профилактического протокола наблюдения. При осмотре установлено, что 2 месяца назад у девочки наступило менархе, и за период наблюдения прошло две самостоятельные менструации. Клинико-лабораторных признаков рецидива заболевания на момент консультации не было. При ректоабдоминальном исследовании в правой половине малого таза на уровне внутреннего зева шейки матки выявлен каменистой плотности узкий инфильтрат без четких контуров, распространявшийся вдоль стенки таза кверху. Пальпируемая часть инфильтрата составляла 4,0×3,0×2,0 см. Проведено УЗИ, затем магнитно-резонансная томография малого таза, по результатам которых выявлено опухолевое образование в области правых придатков матки размерами 6,4×3,2×4,0 см, а также уретерогидронефроз справа. Уровень СА-125 – 52,9 ЕД/мл, ФСГ – 24,2 МЕ/л, ЛГ – 9,8 МЕ/л. Заподозрен экстрамедуллярный рецидив в яичнике. Выполнена диагностическая лапароскопия: выявлены двусторонние мягковатые, крошащиеся опухолевые инфильтраты в обоих яичниках (рис. 3). По результатам цитологического исследования клетки асцитической жидкости – многочисленные лимфоидные элементы, преимущественно незрелые, с наличием бластных форм.
Таким образом, лапароскопически выявлено наличие экстрамедуллярной (яичниковой) локализации рецидива ОЛЛ, что было подтверждено гистологическим и иммуногистохимическим способами. Проведением специфического лечения достигнута третья полная клинико-лабораторная ремиссия.
Еще одним аспектом внимания гинеколога могут стать генитальные проявления хронической реакции «трансплантат против хозяина» (РТПХ) – одной из самых распространенных форм отдаленных осложнений у пациентов после алло-ТГСК [27]. Патогенез хронической РТПХ состоит в системном иммунном ответе, характеризующемся патологической реакцией Т-лимфоцитов донора против антигенов гистосовместимости хозяина, развивающейся в течение 100 дней (острая) и более (хроническая) после проведения алло-ТГСК [27]. Генитальная форма относится к достаточно распространенной форме хронической РТПХ у детей, частота ее составляет, по разным данным, 10–52% от всех пациентов после алло-ТГСК [28]. Время формирования генитальной формы хронической РТПХ у пациентов колеблется, по разным данным, в диапазоне от 5 до 47 месяцев, что требует долгосрочного гинекологического наблюдения в период полной клинико-гематологической ремиссии [27, 29]. Поражение половых органов сопряжено с эрозивными или склеротическими изменениями тканей вульвы и влагалища с развитием механических препятствий для оттока биологических жидкостей (моча, менструальная кровь). В 68% случаев поражается только вульва, в 26% – вульва и влагалище. На ранних этапах развитие хронической РТПХ может протекать бессимптомно, в 25% случаев патологические изменения обнаруживают только при гинекологическом осмотре [29]. Предложена градация степени вульвовагинального поражения при хронической РТПХ. Стадия I (минимальные изменения) – эритема и отек вульвы, стадия II (умеренные изменения) – эрозии слизистой оболочки вульвы и влагалища или трещины в естественных складках, стадия III (выраженные изменения) – склеротические изменения, приводящие к слипанию краев крайней плоти клитора, стенозированию интроитуса, синехиям влагалища или тотальному сращению тканей промежности [30, 31]. В 63% случаев пациенткам может потребоваться оперативное лечение [29]. Жалобы пациентки с клиническими проявлениями генитальной формы хронической РТПХ могут включать зуд, жжение, сухость, вульводинию, усиление слизистых выделений; у некоторых пациентов может наблюдаться дизурия, диспареуния, боли в животе из-за развившегося гематокольпоса и гематометры [27]. При лечении генитальной формы хронической РТПХ перед гинекологом стоят такие задачи, как купирование локальных симптомов и предупреждение развития необратимых изменений полового тракта [31]. Характер терапии варьирует в зависимости от степени поражения тканей. При стадии I–II применяют наружно и/или интравагинально антисептики, глюкокортикоиды или эстрогены [31]. При стадии III может потребоваться назначение глюкокортикоидов системно. В ряде случаев, при сочетании генитальной формы хронической РТПХ с синдромом эстрогенного дефицита, проведение МГТ также улучшает результаты лечения. Оперативное лечение сращений вульвы, влагалища может заключаться как в их механическом разведении, так и вскрытии гематокольпоса с последующим бужированием влагалища. Описаны случаи, при которых пришлось прибегнуть к гистерэктомии [31].
 Клиническое наблюдение №3
Клиническое наблюдение №3
Типичным примером РТПХ с генитальными проявлениями умеренной степени может быть следующий клинический случай.
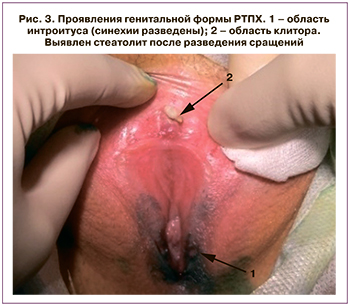
Пациентка К., 17 лет, получала лечение по поводу ОЛЛ, перенесла трансплантацию костного мозга от донора с мужским кариотипом 46,ХY; в состоянии клинико-гематологической ремиссии, имела осложнения в виде распространенной формы хронической РТПХ кожи. При плановом осмотре гинекологом выявлен распространенный спаечный процесс вульвы с грубыми сращениями крайней плоти клитора и входа во влагалище. В плановом порядке под общей анестезией с использованием электроножа пациентке была проведена операция разъединения сращений вульвы (рис. 4). После разделения сращений в области клитора выявлен стеатолит размерами 0,5×1,8 см.
Иммуносупрессия как вследствие течения заболевания, так и проводимой терапии обусловливает подверженность онкогематологических больных воспалительным заболеваниям половых органов. Общеизвестна подверженность пациенток с ЗЗСК инфекциям, вызываемым вирусом простого герпеса, в том числе с генитальной локализацией. Чаще всего герпесвирусная инфекция возникает в первый месяц после алло-ТГСК, реже встречается дебют заболевания в течение 6 месяцев после трансплантации [32]. Для девочек с ЗЗСК характерно развитие гнойной формы вульвовагинита с торпидным течением, выделением флоры, устойчивой к большинству антибактериальных препаратов. Подверженность больных ЗЗСК инфекциям мягких тканей общеизвестна; при этом вульвит и перианальный дерматит могут прогрессировать до очаговых (абсцессы) и разлитых (флегмона) гнойных воспалений. Тяжелое затяжное течение вульвовагинальной кандидозной инфекции у девочек с ЗЗСК также описано [33]. Примером особой формы некупируемого воспалительного процесса может быть поражение кожи вульвы при лангергансоклеточном гистиоцитозе [34].
Клиническое наблюдение №4
Так, в своей практике мы встретили пациентку 3,5 лет, которая поступила в инфекционный стационар с гинекологическим отделением для детей с диагнозом: генерализованная герпетическая инфекция. Именно характерное поражение вульвы у ребенка помогло заподозрить, а затем подтвердить лангергансоклеточный гистиоцитоз (рис. 4).
Проведение системной цитостатической терапии привело к купированию генитальных проявлений заболевания.
Гинекологу также следует помнить, что в случае сексуальной активности пациентки с ЗЗСК до начала специфического лечения следует в обязательном порядке провести обследование на инфекции, передаваемые половым путем, с целью исключения инфекционных осложнений на фоне панцитопении. Известно, что местное и, особенно, системное применение иммуносупрессивной терапии при ЗЗСК повышает риск развития поражений шейки матки, вызванных вирусом папилломы человека (ВПЧ) [31]. По этой причине пациентки после алло-ТГСК должны регулярно проходить скрининг на ВПЧ-ассоциированный рак шейки матки и предраковые состояния, а в возрасте 9–26 лет через 6–12 месяцев после алло-ТГСК следует рекомендовать ВПЧ-вакцинацию [31].
Заключение
На основании вышеизложенных литературных данных и клинических примеров можно сделать вывод, что пациентки с ЗЗСК нуждаются в сопровождении гинеколога на всех этапах лечения и наблюдения. Врач-гинеколог, оказывающий помощь детям и подросткам, должен знать спектр лечебно-диагностических задач и пути их решения при ведении данной категории пациенток. Таким образом, мультидисциплинарный подход позволит не только сохранить жизнь девочкам с ЗЗСК, но и обеспечит такое ее качество, когда становится возможной реализация репродуктивного потенциала.



